Ceturegel™ 基底膜マトリックス - あなたの第一選択
幹細胞療法とオルガノイドベースの医薬品開発の進歩により、基底膜マトリックスは、幹細胞培養とオルガノイド、3D細胞培養、および血管新生、in vivo腫瘍形成実験などの他の用途のための栄養および支持担体として極めて重要な役割を果たしています。 Ceturegel™基底膜抽出物は、ラミニン、IV型コラーゲン、ネスチンなどの細胞外マトリックスタンパク質、IGF、FGF、およびその他の成長因子が豊富なEngelbreth-Holm-Swarm(EHS)マウス腫瘍から抽出されています。 室温で、Ceturegel™基底膜マトリックスは重合して、生物学的に活性な3次元マトリックスを形成します。 これは、in vivoの細胞基底膜の構造、組成、物理的特性、および機能をシミュレートできるため、in vitroでの細胞の培養と分化に有益であり、マトリゲルの優れた代替品です。
1. Ceturegel™ 基底膜マトリックスとは何ですか?
2. Ceturegel™ 基底膜マトリックスの役割は何ですか?
3. Ceturegel™ 基底膜マトリックスの特徴は何ですか?
4. Ceturegel™基底膜マトリックスの人気の用途
5. よくある質問
6.
1. Ceturegel™ 基底膜マトリックスとは何ですか?
内皮細胞、上皮細胞、筋肉、神経細胞に隣接する基質は、基底膜と呼ばれる連続した層状の細胞外マトリックスを形成します。基底膜は、発生や創傷治癒の過程で変性と再生を繰り返します。細胞や細胞層を支持するだけでなく、基底膜の機能である細胞接着、移動、増殖、分化に影響を与え、組織の形成に重要な役割を果たします。そのため、基底膜は転移性腫瘍細胞の侵入に対する主な障壁であると言えます。
図1. Ceturegel™基底膜マトリックス
YEASENが開発・製造したCeturegel™基底膜マトリックスには、LDEV(乳酸脱水素酵素増強ウイルス)が含まれておらず、エンドトキシン含有量が非常に低くなっています。また、マイコプラズマ検出後、基本濃度、高濃度、低成長因子などのさまざまなタイプを含め、マイコプラズマ汚染がないことを確認しています。
2. Ceturegel™ 基底膜マトリックスの役割は何ですか?
Ceturegel™ 基底膜マトリックスは、さまざまな要件の基底膜マトリックスを調製するために使用できます。マウスの腎臓幹細胞による尿細管の形成における成長因子の役割の研究、マウスの乳腺上皮幹細胞の遺伝子発現研究、および Transwell の腫瘍浸潤実験などの細胞シグナル伝達研究に使用できます。同時に、細胞の形態、生化学的機能、移動、感染、および遺伝子発現の研究にも使用できます。Ceturegel™ 基底膜マトリックスは、神経細胞、幹細胞、哺乳類上皮細胞、黒色腫細胞、血管内皮細胞、甲状腺細胞、および毛包細胞を含む上皮細胞およびその他の種類の細胞の接着と分化を効果的に助けることができます。同時に、Ceturegel™ 基底膜マトリックスは、マウス乳腺上皮細胞のタンパク質発現レベルにも影響を及ぼし、末梢神経の再生をサポートします。

図2. Ceturegel™基底膜マトリックスの主な適用方向
細胞の移動と浸潤の詳細:細胞の移動は、細胞の這い、移動、または運動とも呼ばれ、細胞が移動信号を受け取ったり、特定の物質の勾配を感じたりした後の移動を指します。細胞の移動は、細胞頭部の仮足の伸長、新しい接着の確立、および細胞体の尾部の収縮を交互に繰り返すプロセスです。細胞の移動は、正常細胞の基本機能の1つであり、体の正常な成長と発達の生理学的プロセスでもあります。生細胞の遍在する動きの形態として、さまざまな集合的な生理学的および病理学的プロセスに参加できます。胚の発達、血管新生、創傷治癒、免疫反応、炎症反応、アテローム性動脈硬化症、癌の転移など。一方、細胞浸潤とは、細胞が細胞外マトリックスを介してある領域から別の領域に移動する能力を指します。細胞浸潤は、化学的および機械的刺激に対する正常細胞と癌細胞の反応です。細胞侵入は、創傷治癒、血管新生、炎症、腫瘍細胞の転移、組織への異常浸潤などの過程で頻繁に発生します。
3. Ceturegel™ 基底膜マトリックスの特徴は何ですか?
高い安全性:LDEV(乳酸脱水素酵素増加ウイルス)なし
濃度の多様性:濃度範囲は8〜20 mg/mlです
優れたバッチ安定性:バッチ間の安定したパフォーマンスを確保するための厳格な生産品質検査プロセス
低エンドトキシン:エンドトキシン含有量<8 EU/ml
汚染検出:マイコプラズマ、細菌、真菌の残留物は検出されませんでした
高い単一バッチ出力:単一バッチ出力は50Lレベル以上
互換性: あらゆるタイプの細胞培養培地と互換性があります
4. Ceturegel™基底膜マトリックスの人気の用途
4.1 遊走および侵入アッセイ
細胞の移動と浸潤の能力を検出する実験方法はトランスウェル実験であり、トランスウェルは穿孔実験とも呼ばれます。チャンバーには密な孔があるため、最初に細胞懸濁液をチャンバーに追加します。次に、チャンバーを24ウェルプレートに配置し、完全培地を加えます。細胞は変形してチャンバーの穴を通過し、より栄養豊富なチャンバーの外側に出て、外側に付着します。チャンバーの外側の細胞を染色して数えることで、細胞の移動と浸潤の能力を判断できます。トランスウェルの原理は、培養プレートに小さなチャンバーを配置することです。小さなチャンバーは上部チャンバーと呼ばれ、培養プレートは下部チャンバーと呼ばれます。培養液の上層と下層はポリカーボネート膜で分離され、培養液の上層は上部チャンバーに追加され、培養液の下層は下部チャンバーに追加されます。細胞は上部チャンバーにあり、膜の透過性により、下部培地の組成が上部チャンバーの細胞に影響を与えます。さらに、下層培地の成分が細胞の成長と運動に及ぼす影響を調査しました。
遊走および浸潤アッセイにおける Ceturegel™ 基底膜マトリックスの具体的な操作: 希釈した Ceturegel™ 基底膜マトリックスを Transwell の上部チャンバーに加え、細胞を播種して 37°C、5% CO2インキュベーターで 24 時間インキュベートし、4% パラホルムアルデヒドで固定し、0.1% クリスタル バイオレット染色液で染色しました。細胞は倒立位相差顕微鏡で観察および計数しました。
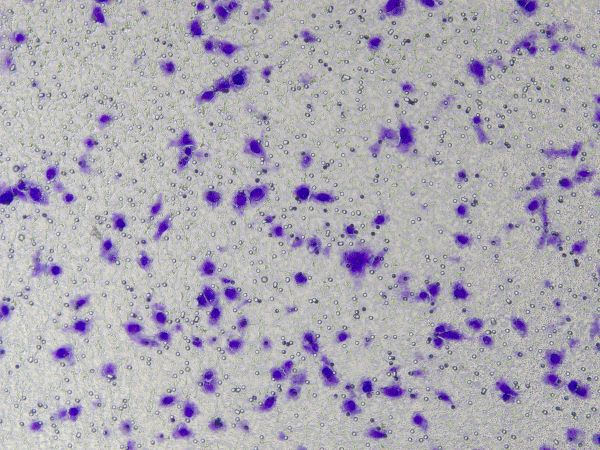
図3. 細胞侵入後のクリスタルバイオレット染色の結果
4.2 血管新生
1) 実験の 1 日前に、Ceturegel™ Matrigel を冷凍庫から取り出し、4°C の冷蔵庫に一晩置いて解凍し、使用済みの消耗品を予冷します。
2) 実験前には必ず Ceturegel™ Matrigel をアイスボックスに保管してください。血管新生スライドの滅菌包装を開封し、スライドを取り出します。
3) 各ウェルに Ceturegel™ Matrigel を 10 μl 加えます。Ceturegel™ Matrigel を加えるときは、Matrigel が上部の穴から流れ出て接着剤の残留物が残らないように、ピペットの先端が内側の穴の上部に対して垂直になるように注意してください。
4) まずスライドを覆い、10cmのペトリ皿を用意し、水に浸したペーパータオルを入れてウェットボックスを作ります。
5) スライドをペトリ皿に入れ、ペトリ皿に蓋をします。CO2インキュベーターに入れて30分ほど放置し、ゲルが凝固するのを待ち、同時に細胞懸濁液を調製します。
6) 消化した細胞を2*10 5細胞/mlの密度の細胞懸濁液に調製し、よく混ぜます。
7) ゲル状に固まった血管が入ったガラススライドを取り外し、ピペットの先端を上部のウェルの真上に置き、下部のウェルのゲルに触れないように注意しながら、各ウェルに細胞懸濁液を 50 μl ずつ加えます。
8) 細胞培養培地を加え、蓋を閉めて放置します。しばらくすると、すべての細胞がマトリゲルの表面に沈みます。
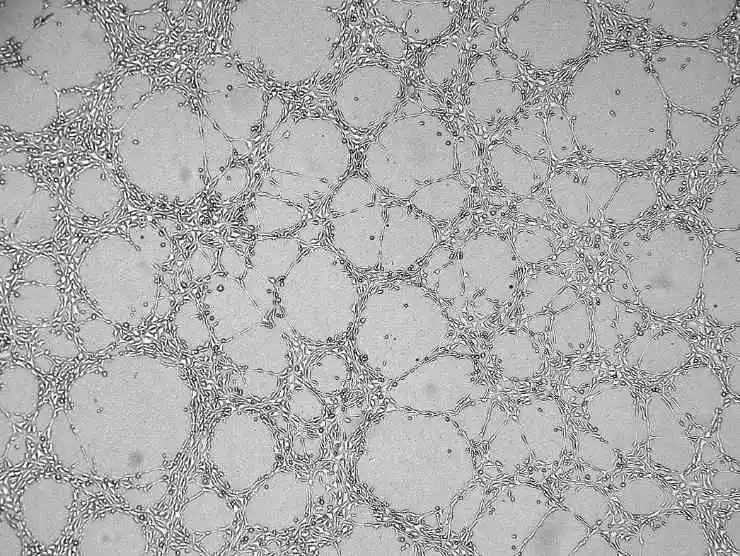
図4. 血管新生の結果グラフ
免疫蛍光染色
1) 接着剤や細胞ネットワークに触れないように注意しながら、ウェルから培地を取り除きます。カルセインを無血清培地で希釈し、最終濃度を 6~8 µg/ml にします。細胞染色溶液を加えて細胞を完全に浸し、暗所で室温で 30~40 分間インキュベートします。
2) PBSで3回洗浄します。細胞に影響を与えないように、PBSは上部のウェルにゆっくりと加える必要があります。Ex=485 nm、Em=529 nmの波長を使用した蛍光観察
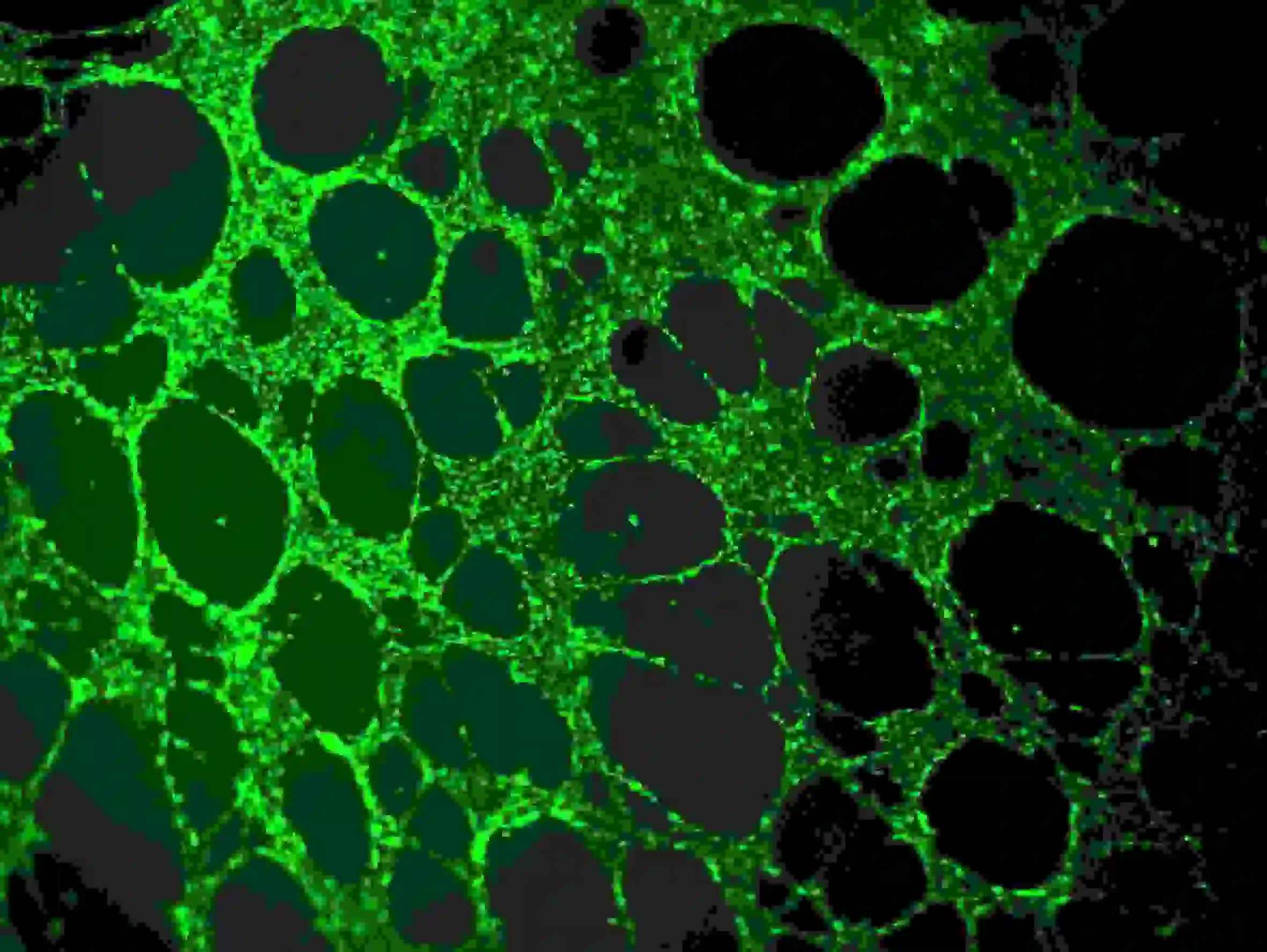
図5. 血管の免疫蛍光染色
4.3 3D細胞培養
従来の細胞培養とは異なり、3D 細胞培養は細胞の生体内環境を再現します。単純な球状モデルでも単層培養の欠点を補うことができます。これらの構造は酸素、栄養素、代謝物、可溶性シグナルの勾配を形成し、多様な細胞集団を形成します。3D 細胞培養技術は、細胞が生物内で生息する自然環境をより適切にシミュレートし、細胞間の相互作用や生化学的および生理学的反応をより現実的にします。3D 環境では、内因性および外因性の刺激に対する細胞の反応は、生体内の反応に非常に近くなります。
3D 細胞培養における Ceturegel™ 基底膜マトリックスの具体的な操作は次のとおりです。Ceturegel™ 基底膜マトリックスを、調整した濃度の単一細胞 HepG2 懸濁液と 1:1 で穏やかに混合し、上記で混合した単一細胞懸濁液 50 μl を、事前に冷却したピペット チップを使用して、事前に冷却した 24 ウェル プレートに加えて、アーチ型の細胞液滴を形成します。これを 37°C、5% CO2 インキュベーターで培養し、毎日観察して写真を撮影しました。
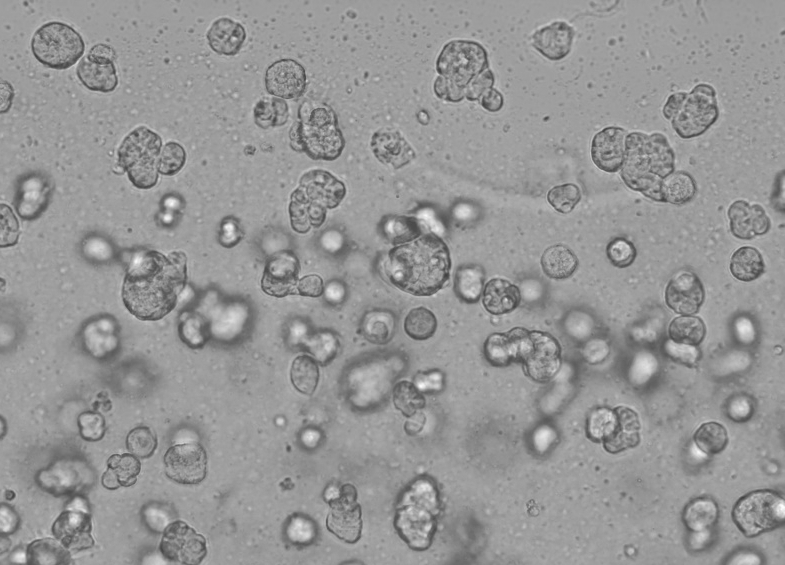
図6. 3D細胞培養の結果
表1. 3D細胞培養Ceturegel™基底膜マトリックスの使用参考:
| 培養皿(ディッシュ)タイプ | 細胞培養面積(cm2) | 使用量測定(濃度 ≥ 3 mg/mL)* |
|---|---|---|
| 6ウェルプレート | 9.6 | 200μL/ cm2 |
| 12ウェルプレート | 4.5 | 180μL/ cm2 |
| 24ウェルプレート | 2.0 | 180μL/ cm2 |
| 96ウェルプレート | 0.32 | 160μL/ cm2 |
| 35mm皿 | 11.78 | 200μL/ cm2 |
| 100mm皿 | 58.95 | 200μL/ cm2 |
注: Ceturegel™基底膜マトリックスの異なるバッチには一定の濃度の違いがあるため、推奨投与量は参考値です。
4.4 生体内での腫瘍形成実験
ヌードマウスのHepG2細胞の皮下腫瘍形成実験を例にとると、Ceturegel™基底膜マトリックスと細胞懸濁液を1:1希釈し、4〜5週齢のBALB/c-nu雌マウスの皮下接種を行いました。実験手順は以下のとおりです。
♦ 対数増殖および細胞密度約 80 ~ 90% の HepG2 細胞を準備し、細胞を採取する前夜に新鮮な培地を交換します。
♦ 細胞をトリプシンで分解し、細胞が丸くなり培養皿から出なくなったらトリプシンを除去し、無血清培地を加えて細胞懸濁液を作り、遠心分離して一度洗浄し、最終濃度を5×10 7 cells/mLにします。
♦ 細胞懸濁液とCeturegel™基底膜マトリックスを4℃で1:1の割合で希釈し、最終濃度5×10 7細胞/mLになるように調製します。
♦ 左手で固定したヌードマウスをつかみ、ヌードマウスの右肩の皮下に注射します。接種中は、注射後に針穴から細胞懸濁液が溢れるのを減らすために、針を皮下に少し深く(約 1cm の深さ)挿入します。
接種量は200μLです。(このプロセスは可能な限り30分以内に完了する必要があります。途中、細胞懸濁液を氷の上に置いて、細胞のアポトーシスを遅らせ、ゲル現象を防ぐ必要があります)。
♦ ヌードマウスをケージに戻して給餌を続けると、腫瘍は約 1 週間から 1 か月間観察されます。実験設計に従って、腫瘍の体積が要件を満たしたときにヌードマウスを安楽死させ、写真を撮ります。
注:対照群は培養培地と細胞の懸濁液であり、最終密度はマトリックス接着剤試験群と同じです。
4.5 オルガノイド培養
オルガノイドは、幹細胞から分化した 3D 多細胞微小組織です。臓器の一部の特性を再現できます。オルガノイドは多細胞であり、高度な自己組織化を示すため、従来の 2D 培養よりも複雑な生体内細胞応答および相互作用を示す能力が優れています。正常または病変組織の幹細胞および/または臓器前駆細胞は、Ceturegel™ 基底膜マトリックスまたはコラーゲンと混合できます。腎臓、甲状腺、肝臓、脳、肺、腸、前立腺、その他の微小臓器を形成します。たとえば、遺伝子スクリーニングを行う研究者は、Ceturegel™ 基底膜マトリックス基質をバイオインクとして使用して、3D バイオプリンティングで生きた細胞/オルガノイドを正確に位置特定および埋め込むことができます。
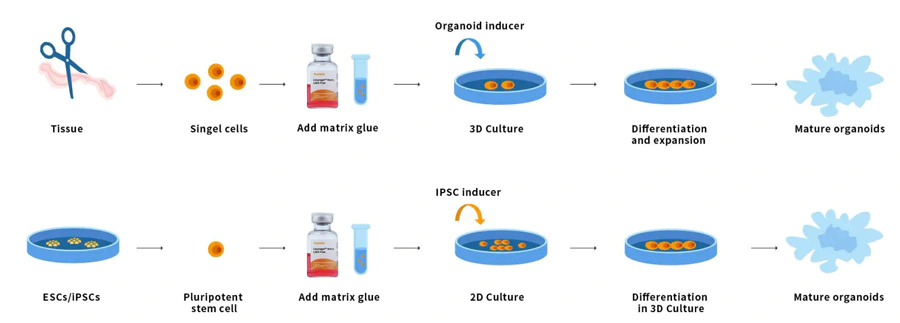
図7. オルガノイドの動作プロセス
マウス小腸オルガノイドの構築
サンプルの準備:マウスの首を切断して殺し、表面にアルコールを噴霧して殺菌します。滅菌環境下で胃端近くの腸組織を3〜15cm切り取り、ピンセットで腸管外の腸間膜と脂肪を慎重に取り除き、4℃に予冷した1%二重抗体を含むDPBS溶液に入れます。
サンプル洗浄:注射器を使用して腸管を2〜3回洗浄し、外科用ハサミを使用して腸管を腸腔を上に向けて慎重に切断し、外科用メスを使用して腸腔の表面にある腸絨毛をそっと削り取ります。腸絨毛が削り取られた後(透明な組織が見える)、腸組織をDPBSを含む新しい培養皿に2〜3回置きます。
サンプルの初期処理:洗浄した小腸組織を2mm幅の小片に切り、新しい50ml遠心管に移します。DPBSで3〜5回優しく洗浄し、腸絨毛細胞と浮遊脂肪組織を取り除きます。
サンプル消化:洗浄した小腸断片に、3~5mM EDTAを含む10~15mlの予冷DPBSを加えて消化し、4℃で約30分間インキュベートし、この間10分ごとに遠心管を軽く振ってください。
消化後、EDTA 消化溶液の上清を捨て、新しい DPBS 緩衝液で組織を 2 ~ 3 回軽くすすいで、残っている EDTA を除去します。
小腸組織片に0.1% BSAを含む10~15mlの予冷DPBSを加え、組織片を繰り返し吹き飛ばして再懸濁し、凹部を基底層から分離した後、少量の懸濁液を採取して顕微鏡検査します。凹部のような構造が多数見られるようになったら、吹き飛ばしを止め、吹き飛ばした組織懸濁液の70%μMフィルタースクリーンを使用して、フィルタースクリーンを通過した組織懸濁液を濾過して収集します。
手順5~6を2回繰り返し、1500rpm、4℃で3分間遠心分離します。
混合物の形成: Ceturegel™ マトリックス接着剤重懸濁液凹部組織沈殿、10 μL のマトリックス接着剤懸濁液ごとに 200 ~ 600 個の凹部が含まれます。再懸濁後、混合物を氷上に置き、マトリックス接着剤がゲルを形成するのを避けるためにできるだけ早く操作します。
注意: 培養プロセス中の Ceturegel™ のマトリックス接着構造の安定性を確保するために、マトリックス接着剤の希釈率は 50% 以上である必要があります。
混合懸濁液を24ウェルプレートの底の中央に、オリフィスプレートの側壁に懸濁液が接触しないように、ウェルの左右に30〜50μLずつ入れます。
培養した培養プレートを37℃の二酸化炭素恒温インキュベーターに入れ、マトリックスゲルが固まるまで約30分間インキュベートします。
Ceturegel™ マトリックス接着剤が完全に固まったら、準備した腸器官培養培地を壁に沿ってゆっくりと 800μL ずつ加えます。
24ウェルプレートを37℃の二酸化炭素インキュベーターに入れて培養します。3日ごとに新鮮な培地を交換し、器官様臓器の成長状況をモニタリングします。通常、マウスの小腸器官様臓器は5〜7日以内に形成されます。
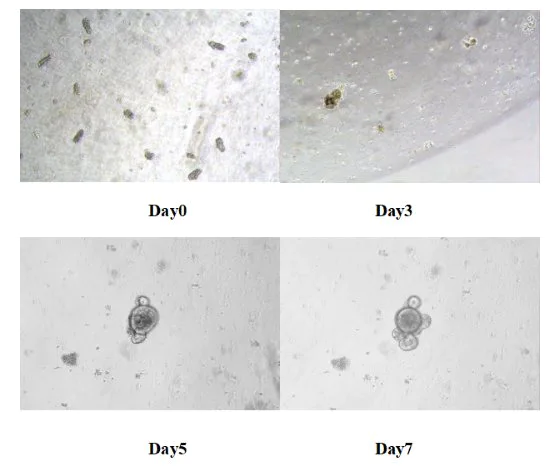
図8. マウス小腸様臓器のin vitro培養の結果
5. よくある質問
1. 得られた基質の色の違い(淡黄色から濃赤色)の原因は何ですか?
フェノールレッドを含むCeturegel™基底膜マトリックスの場合、これは主にフェノールレッドと炭酸水素塩がCO 2と相互作用することによって発生しますが、5% CO 2で平衡化した後は色の違いが減少します。凍結融解後、バイアルを軽く振って、Ceturegel™基底膜マトリックスを均一に分散させます。
2. Ceturegel™基底膜マトリックスの操作において注意すべき事項は何ですか?
すべての操作は滅菌環境で実行し、Ceturegel™ 基底膜マトリックスが均質化されるように事前に冷却したピペットを使用する必要があります。
3. Ceturegel™ 基底膜マトリックスを凍結して保存するにはどうすればいいですか?
凍結および解凍された Ceturegel™ マトリックス LDEV-Free Ceturegel™ 基底膜マトリックスは、複数の小さなチューブに分配できます。すべての分配は、事前に冷却されたクライオバイアルで行う必要があります。このバイアルは、複数回の凍結および解凍を避けるために、すばやく凍結して保管する必要があります。関係するすべてのアイテムは、使用前に事前に冷却する必要があります。Ceturegel™ 基底膜マトリックスを扱うには、事前に冷却されたピペット、チップ、および小さなチューブを使用してください。
6. Yeasen 社のCeturegel™基底膜マトリックスの選択ガイド
Ceturegel™ 基底膜マトリックスにはさまざまな種類があり、用途も異なります。標準濃度の Ceturegel™ 基底膜マトリックスは、上皮細胞などの極性細胞培養に使用できます。さまざまな細胞の分化を促進し、腫瘍細胞の移動や浸潤の実験に使用できます。高濃度の Ceturegel™ 基底膜マトリックスは、生体内で広く使用されており、尿細管形成実験に使用できます。低成長因子 (GFR) の主な機能は、実験における成長因子の干渉を排除することであり、基底膜の準備に対する要件が高い研究に適しています。フェノールレッドを含まない Ceturegel™ 基底膜マトリックスは、フェノールレッド指示薬の干渉を排除できるため、比色分析や蛍光検出などの色の開発実験に適しています。ヒト胚性幹細胞培養グレードの Ceturegel™ 基底膜マトリックスは、特にヒト胚性幹細胞培養、誘導多能性フィーダーフリー幹細胞培養に使用されます。
表2. Ceturegel™マトリックス選択ガイド
|
製品タイプ |
カタログNo. |
製品名 |
マトリゲル カタログ番号 |
応募方法 |
|
基本濃度(8~12 mg/ml) |
40183ES |
356234/ 354234 |
2Dおよび3D培養、浸潤、移動実験に適応し、生体内腫瘍形成実験にも使用できます。 |
|
|
40184ES |
356237 |
主に蛍光検出実験などの色検出に使用されます |
||
|
成長因子の減少 |
40185ES |
354230 |
主に成長因子による実験への干渉を排除します。成長因子、シグナル伝達経路などの関連研究に適用されます。 |
|
|
40186ES |
356231 |
|||
|
高濃度(≥18mg/ml) |
40187ES |
354248 |
血管新生、ゲル塞栓、生体内腫瘍形成などの実験に主に使用されます(血管新生の場合、Ceturegel™基底膜マトリックスの最終濃度は10mg/ml以上にすることが推奨されます) |
|
|
40189ES (問い合わせ) |
Ceturegel™マトリックス高濃度、GFR、LDEVフリー |
354263 |
||
|
40188ES |
354262 |
|||
|
幹細胞の場合 |
40190ES |
354277 |
主にhESC、iPSCなどの幹細胞培養に使用されます。 |
|
|
オルガノイド特有の |
40191ES (問い合わせ) |
Ceturegel™ オルガノイド培養用マトリックス、フェノールレッドフリー、LDEVフリー |
356255 |
オルガノイド培養用 Ceturegel™ 基底膜マトリックス |
