คำอธิบาย
ชุดอุปกรณ์นี้สามารถขยายพันธุ์เนื้อเยื่อของหนู (เช่น หางหนู หูหนู นิ้วเท้าหนู กล้ามเนื้อ ฯลฯ) ได้โดยตรงและรวดเร็ว และมีความเข้ากันได้กับตัวอย่างที่แข็งแกร่ง ชุดอุปกรณ์นี้ติดตั้งบัฟเฟอร์ไลซิสที่มีประสิทธิภาพ จึงสามารถไลซ์ตัวอย่างและปล่อยดีเอ็นเอจีโนมได้อย่างรวดเร็ว ไลเสทสามารถเติมลงในระบบปฏิกิริยา PCR ได้โดยตรงโดยไม่ต้องทำให้บริสุทธิ์ และใช้งานได้สะดวก นอกจากนี้ ชุดอุปกรณ์นี้ยังต้องการปริมาณตัวอย่างที่ป้อนเข้าน้อย และสามารถใช้เนื้อเยื่อของหนู 5 มก. หรือหางหนูขนาด 1-5 มม. สำหรับการทดลองได้
2× Mouse Direct PCR Mix ที่ชุดอุปกรณ์นี้จัดเตรียมไว้เป็นสารละลายปฏิกิริยา PCR แบบเริ่มต้นร้อนที่มีความเข้มข้น 2 เท่า ประกอบด้วยส่วนประกอบทั้งหมดที่ใช้ในการขยาย PCR ยกเว้นเทมเพลตและไพรเมอร์ ซึ่งช่วยลดความซับซ้อนของกระบวนการทำงานและลดโอกาสการปนเปื้อนลงอย่างมาก ชุดอุปกรณ์นี้ใช้สำหรับการระบุทรานส์ยีน การสร้างจีโนไทป์ของหนู เป็นต้น
คุณสมบัติ
- ตัวอย่างที่ต้องการน้อยลง: เนื้อเยื่อหนู 5 มก. หรือหางหนู 1-5 มม.
- การเตรียมเทมเพลตที่สะดวก: ไม่จำเป็นต้องบด ไม่จำเป็นต้องกลั่นและทำให้ DNA บริสุทธิ์ ฟลักซ์ที่สูงขึ้น ประหยัดเวลาและเงิน
- ระบบ PCR ที่ได้รับการปรับให้เหมาะสม: มีความจำเพาะที่สูงขึ้นและความทนทานต่อสารยับยั้งปฏิกิริยา PCR ที่แข็งแกร่งขึ้น
แอปพลิเคชั่น
- การระบุตัวตนของหนูทรานสเจนิก
- การกำหนดจีโนไทป์ของหนู
- การวิเคราะห์น็อกเอาต์ยีนของหนู
ข้อมูลจำเพาะ
| รายละเอียดสินค้า | ชุด |
| สตาร์ทร้อนแรง | ระบบ Hot Start ในตัว |
| เงื่อนไขการขนส่ง | ถุงน้ำแข็ง |
| ประเภทสินค้า | ชุด PCR แบบตรง |
| นำมาใช้ ถึง (แอปพลิเคชัน) | หางหนู หูหนู นิ้วเท้าหนู เครื่องใน ผิวหนัง ฯลฯ |
ส่วนประกอบ
| ส่วนประกอบ หมายเลข | ชื่อ | 10185ES50 | 10185ES70 |
| 10185-ก | บัฟเฟอร์ มล. | 5×1 มล. | 20×1 มล. |
| 10185-ข | บัฟเฟอร์ เอ็มที | 0.6 มล. | 2×1.25 มล. |
| 10185-ค | 2× เมาส์ไดเร็กต์ PCR มิกซ์ | 500 ไมโครลิตร | 2×1 มล. |
- ก) บัฟเฟอร์ ML เป็นบัฟเฟอร์ไลซิสที่มีโปรตีนที่ทำลายโครงสร้างอย่างรุนแรง โปรดสวมถุงมือ
- b) Buffer MT เป็นบัฟเฟอร์หยุดที่ใช้เพื่อหยุดฟังก์ชันไลซิสของ Buffer ML
- c) 2× Mouse Direct PCR Mix: ประกอบด้วย Taq DNA polymerase แบบ hot-start, dNTP mix, MgCl2, บัฟเฟอร์ปฏิกิริยา, ตัวเสริมปฏิกิริยา PCR, ตัวปรับแต่ง, ตัวทำให้คงตัว, สีย้อมตัวบ่งชี้อิเล็กโทรโฟเรซิส ฯลฯ
พื้นที่จัดเก็บ
- ส่วนประกอบ ก: ผลิตภัณฑ์ควร ควรเก็บไว้ที่อุณหภูมิ 2°C~8°C เป็นเวลา 1 ปี หากใช้หลายครั้งเป็นเวลานาน โปรดหลีกเลี่ยงการปนเปื้อนข้าม
- ส่วนประกอบ B/C: ผลิตภัณฑ์ ควรเก็บไว้ที่-25℃ ~ -15℃ เป็นเวลา 1 ปี โปรดหลีกเลี่ยงการแช่แข็งและละลายซ้ำๆ
ตัวเลข
1. ผลการขยายยีนเป้าหมาย (ภายใน 1 กิโลไบต์)
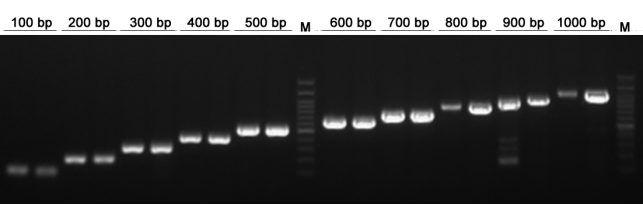
รูปที่ 1.เหมาะสำหรับการขยายยีนเป้าหมายภายใน 1 กิโลเบส
2. การสาธิตความเร็วการขยาย
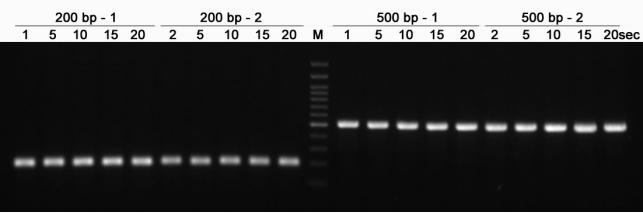
รูปที่ 2 ยีน 500bp ความเร็วในการขยายสามารถเร็วได้ถึง 1sec/kb
 อ้างจาก "TFPI เป็นตัวรับคริปต์ลำไส้ใหญ่สำหรับ TcdB จาก C. difficile ในกลุ่มที่ 2 ที่มีไวรัสรุนแรงมาก Cell . 2022 มี.ค. 17;185(6):980-994.e15. doi: 10.1016/j.cell.2022.02.010"
อ้างจาก "TFPI เป็นตัวรับคริปต์ลำไส้ใหญ่สำหรับ TcdB จาก C. difficile ในกลุ่มที่ 2 ที่มีไวรัสรุนแรงมาก Cell . 2022 มี.ค. 17;185(6):980-994.e15. doi: 10.1016/j.cell.2022.02.010"
[1] Luo J, Yang Q, Zhang X และคณะ TFPI คือตัวรับคริปต์ลำไส้ใหญ่สำหรับ TcdB จาก clade 2 C ที่มีไวรัสรุนแรงมาก difficile. เซลล์. 2022;185(6):980-994.e15. doi:10.1016/j.cell.2022.02.010(IF:41.584)
[2] Zhao J, Chen J, Li YY, Xia LL, Wu YG. เอนไซม์ไทโรซีนไคเนสของ Bruton ควบคุมการอักเสบที่เกิดจากแมคโครฟาจในไตของผู้ป่วยเบาหวานผ่านการกระตุ้นอินฟลัมโมโซม NLRP3 Int J Mol Med. 2021;48(3):177. doi:10.3892/ijmm.2021.5010(IF:4.101)
| ปัญหาทั่วไป | สาเหตุที่เป็นไปได้ | สารละลาย |
| ไม่มีแถบในตัวควบคุมเชิงบวกและตัวอย่างที่ต้องทดสอบ | ระบบปฏิกิริยา PCR หรือสภาวะปฏิกิริยาไม่เหมาะสม | ใช้ gradient PCR เพื่อสำรวจสภาวะปฏิกิริยาที่เหมาะสมที่สุดสำหรับ PCR |
| การจัดเก็บสารเคมี PCR ที่ไม่เหมาะสมทำให้สูญเสียกิจกรรม | ควรเก็บ 2× Mouse Direct PCR Mix ไว้ที่ -20°C และหลีกเลี่ยงการแช่แข็งและละลายซ้ำๆ ในระหว่างการใช้งาน หากใช้บ่อยครั้ง สามารถเก็บไว้ที่อุณหภูมิ 4°C ได้ในช่วงเวลาสั้นๆ | |
| ปัญหาการออกแบบไพรเมอร์ | ลองออกแบบไพรเมอร์ใหม่เพื่อตรวจสอบ | |
| การควบคุมเชิงบวกมีแถบที่น่าสนใจ และตัวอย่างที่ต้องการทดสอบไม่มีแถบหรือแถบที่อ่อน | การจัดเก็บที่ไม่เหมาะสมหรือการจัดเก็บเป็นเวลานานอาจทำให้สูญเสียการทำงานของรีเอเจนต์ได้ | ใช้สารเคมีสด |
| เติมเนื้อเยื่อไลเสทส่วนเกิน | เพิ่มระบบปฏิกิริยา หรือลดปริมาณไลเสท | |
| ส่วนผสมไลซิสตัวอย่างถูกเก็บไว้ไม่ถูกต้องหรือเก็บไว้เป็นเวลานานเกินไป และจีโนม DNA ถูกย่อยสลาย | สามารถเก็บส่วนผสมไลเสทได้ที่อุณหภูมิ 4°C เป็นเวลา 2-3 วันพยายามใช้ส่วนผสมไลเสทที่เตรียมสดใหม่สำหรับ PCR | |
| จำนวนเทมเพลตที่เพิ่มไม่เหมาะสม | ปริมาณเทมเพลตที่เพิ่มได้รับการปรับให้เหมาะสมภายในช่วง 1-10% ของระบบปฏิกิริยา | |
| จำนวนรอบ PCR ไม่เพียงพอ | เพิ่มจำนวนรอบการทำ PCR ควรเป็น 35-40 รอบ เนื่องจากเทมเพลตมีความซับซ้อน ปฏิกิริยา PCR ควรดำเนินการด้วยรอบที่มากกว่าเทมเพลต DNA ที่บริสุทธิ์ 5-10 รอบ | |
| การขยายสัญญาณแบบไม่จำเพาะ | อุณหภูมิการอบ PCR ต่ำเกินไป หมายเลขรอบ ความเข้มข้นของไพรเมอร์ หรือความเข้มข้นของเทมเพลตสูงเกินไป | เพิ่มอุณหภูมิการอบ PCR และลดจำนวนรอบ PCR ความเข้มข้นของไพรเมอร์หรือความเข้มข้นของเทมเพลต |
| ไพรเมอร์ PCR ไม่ตรงกัน | ออกแบบไพรเมอร์ PCR ใหม่ | |
| อุณหภูมิที่สูงเกินไปในการเตรียมระบบปฏิกิริยา PCR หรือเวลาหลังจากการเตรียมเสร็จสิ้นนานเกินไป | การเตรียมระบบปฏิกิริยา PCR จะดำเนินการที่อุณหภูมิต่ำ และปฏิกิริยาการขยาย PCR จะดำเนินการโดยเร็วที่สุดหลังจากการเตรียมเสร็จสิ้น | |
| แถบเป้าหมายปรากฏในการควบคุมเชิงลบ | การปนเปื้อนของเครื่องมือปฏิบัติการหรือสารเคมี | สารเคมีหรืออุปกรณ์ทั้งหมดในการทดลองควรผ่านการนึ่งฆ่าเชื้อด้วยไอน้ำ ควรระมัดระวังและนุ่มนวลเมื่อใช้งานเพื่อป้องกันไม่ให้ลำดับเป้าหมายถูกดูดเข้าไปในปืนเก็บตัวอย่างหรือหกออกจากท่อเหวี่ยง |
| การปนเปื้อนข้ามระหว่างตัวอย่าง | แต่ละตัวอย่างจะใช้กับตัวอย่างเพียง 1 ตัวอย่างเท่านั้น หรือหลังจากเก็บตัวอย่างไป 1 ตัวอย่างแล้ว ให้จุ่มขอบของตัวอย่างในสารละลายโซเดียมไฮโปคลอไรต์ 2% ล้างซ้ำหลายๆ ครั้ง แล้วจึงเช็ดส่วนที่เหลือให้แห้งด้วยกระดาษเช็ดมือที่สะอาด |
การชำระเงินและความปลอดภัย
ข้อมูลการชำระเงินของคุณได้รับการดำเนินการอย่างปลอดภัย เราไม่เก็บรายละเอียดบัตรเครดิตและไม่สามารถเข้าถึงข้อมูลบัตรเครดิตของคุณได้
การสอบถาม
คุณอาจชอบ
คำถามที่พบบ่อย
ผลิตภัณฑ์นี้มีวัตถุประสงค์เพื่อการวิจัยเท่านั้น และไม่ได้มีวัตถุประสงค์เพื่อใช้ในการรักษาหรือวินิจฉัยโรคในมนุษย์หรือสัตว์ ผลิตภัณฑ์และเนื้อหาได้รับการคุ้มครองโดยสิทธิบัตร เครื่องหมายการค้า และลิขสิทธิ์ที่เป็นของ
แอปพลิเคชั่นบางตัวอาจต้องใช้สิทธิ์ในทรัพย์สินทางปัญญาของบุคคลที่สามเพิ่มเติม