คำอธิบาย
ใช้ชุดตรวจจับไวรัสเลนติไวรัส (RCL) ที่สามารถจำลองแบบได้ เพื่อตรวจจับเลนติไวรัสที่จำลองแบบเชิงปริมาณ อาจเกิดขึ้นใน ผลิตภัณฑ์เซลล์ที่หลากหลายที่เกี่ยวข้องกับเลนติไวรัล เวกเตอร์ความเสี่ยงที่อาจเกิดขึ้น
ชุดนี้ออกแบบไพรเมอร์เฉพาะสำหรับ ลำดับยีน VSV-G ของโปรตีนเยื่อหุ้มเลนติไวรัส และได้นำเอาหลักการทักมันมาใช้ โพรบเรืองแสงและวิธีการปฏิกิริยาลูกโซ่โพลีเมอเรส (PCR) ซึ่งมีระดับขีดจำกัดการตรวจจับ 1 สำเนา/μL และ สามารถตรวจจับได้อย่างเฉพาะเจาะจงและรวดเร็ว ความเสี่ยงของไวรัสเลนติไวรัสที่สามารถจำลองแบบได้ ชุดอุปกรณ์ต้องมี ที่จะนำมาใช้ร่วมกับ ชุดเตรียมตัวอย่าง DNA ที่เหลือ (Cat# 18461ES)
ส่วนประกอบ
| ส่วนประกอบ หมายเลข | ชื่อ | 41311ES50 | 41311ES60 |
| 41311-ก | RCL qPCR มิกซ์ | 0.75 มล. | 1.5 มล. |
| 41311-ข | ไพรเมอร์และโพรบผสม RCL | 200 ไมโครลิตร | 400 ไมโครลิตร |
| 41311-ค | การเจือจางดีเอ็นเอ บัฟเฟอร์ | 2×1.8 มล. | 4×1.8 มล. |
| 41311-ง | การควบคุมดีเอ็นเอ RCL(5×10E8 สำเนา/μL)) | 25 ไมโครลิตร | 50 ไมโครลิตร |
| 41311-อี | ไอซี* | 50 ไมโครลิตร | 100 ไมโครลิตร |
- ไอซี: ภายใน ควบคุม.
พื้นที่จัดเก็บ
ควรเก็บผลิตภัณฑ์นี้ไว้ที่ -25~-15℃ สำหรับ 2 ปี.
ทั้ง 41311-A และ 41311-B ควรเก็บรักษาให้พ้นจากแสง
ใช้ได้ อุปกรณ์ แบบจำลอง
รวมถึงแต่ไม่จำกัดเพียง: Bio-Rad: โมดูลออปติก CFX96; Thermo Scientific: เอบีไอ 7500; ABI Quant Studio 5; ABI Step OnePlus
คำแนะนำ
- ดีเอ็นเอ RCL มาตรฐาน การเจือจาง และ มาตรฐาน เส้นโค้ง การตระเตรียม
RCL DNA Control ได้รับการเจือจางแบบไล่ระดับโดยใช้บัฟเฟอร์เจือจาง DNA ที่ให้มาในชุด* และการเจือจาง ความเข้มข้นคือ 5×10E7 สำเนา/μL, 5×10E6 สำเนา/μL, 5×10E5 สำเนา/μL, 5×10E4 สำเนา/μL, 5×10E3 สำเนา/μL, 5×10E2 สำเนา/μL, 5×10E1 สำเนา/μL
ดูคำแนะนำโดยละเอียดด้านล่าง:
1) ละลายบัฟเฟอร์ควบคุม DNA และเจือจาง DNA ของ RCL บนน้ำแข็ง หลังจากละลายหมดแล้ว กระแสน้ำวนอย่างอ่อนโยน ผสมและ ปั่นด้วยความเร็วต่ำเป็นเวลา 10 วินาที
2) นำหลอดทดลองขนาด 1.5 มล. ที่สะอาด 7 หลอด ซึ่งมีเครื่องหมายว่า Std0, Std1, Std2, Std3, Std4, Std5, Std6
3) เพิ่ม 90 μL ของบัฟเฟอร์เจือจาง DNA และ 10 μL ของตัวควบคุม DNA RCL ในหลอดไมโครฟิวจ์ขนาด 1.5 มล. ที่มีฉลาก Std0 กล่าวคือ เจือจางเป็น 5×10E7 สำเนา/μL ผสมและ จากนั้นปั่นเป็นเวลา 10 วินาที บรรจุมาตรฐาน DNA ที่เจือจางแล้วลงไป จากนั้นก็สามารถทำได้ เก็บรักษาในระยะสั้น (ไม่เกิน 3 เดือน) ที่อุณหภูมิ -25~-15℃** .โปรดหลีกเลี่ยงการแช่แข็งและละลายซ้ำๆ
4) เพิ่ม 90 μL ของบัฟเฟอร์เจือจาง DNA ลงในหลอดอื่น*** จากนั้นทำตามขั้นตอนต่อไปนี้ การเจือจางแบบอนุกรม**** -
| หลอด | อัตราส่วนการเจือจาง | ความเข้มข้นมาตรฐาน |
| ส.ด.1 | 10 μL Std0 + 90 μL เจือจาง DNA บัฟเฟอร์ | 5×10E6 สำเนา/μL |
| ส.ด.2 | 10 μL มาตรฐาน 1 + 90 การเจือจาง DNA µL บัฟเฟอร์ | 5×10E5 สำเนา/μL |
| ส.3 | 10 μL Std2 + 90 การเจือจาง DNA µL บัฟเฟอร์ | 5×10E4 สำเนา/μL |
| ส.4 | 10 μL Std3 + 90 μL เจือจาง DNA บัฟเฟอร์ | 5×10E3 สำเนา/μL |
| ส.5 | 10 μL Std4 + 90 การเจือจาง DNA µL บัฟเฟอร์ | 5×10E2 สำเนา/μL |
| ชั้น ม.6 | 10 μL Std5 + 90 ดีเอ็นเอ μL การเจือจาง บัฟเฟอร์ | 5×10E1 สำเนา/μL |
ตารางที่ 1 การเจือจางแบบไล่ระดับมาตรฐาน
*สาม จำลอง บ่อน้ำ เป็น ที่จำเป็น สำหรับ แต่ละ ความเข้มข้น การตรวจจับ พิสัย เป็น 5×10E1 สำเนา/μL~5×10E6 สำเนา/μL และ นี้ พิสัย สามารถ เป็น ขยายได้หากจำเป็น
** ถึง ลด เดอะ ตัวเลข ของ ทำซ้ำ การแช่แข็งและการละลาย และ หลีกเลี่ยง การปนเปื้อนมัน เป็น ที่แนะนำ ถึง เก็บ เดอะ ดีเอ็นเอ ควบคุม ใน ส่วนย่อย ที่ -25~-15℃ สำหรับ เดอะ อันดับแรก เวลา.
- ครั้งหนึ่ง ละลายแล้ว ดีเอ็นเอ การเจือจาง บัฟเฟอร์ สามารถ เป็น เก็บไว้ ที่ 2-8 องศาเซลเซียส สำหรับ 7 วัน ถ้า ไม่ ใช้แล้ว สำหรับ เอ ยาว เวลาโปรด เก็บ ที่ -25~-15℃ -
- ทำ แน่นอน เดอะ เทมเพลต เป็น อย่างสมบูรณ์ ผสมกันอย่างอ่อนโยน เขย่า เดอะ ส่วนผสม สำหรับ 15 วินาที ถึง 1 นาที สำหรับ แต่ละ การไล่ระดับ การเจือจาง
- การสกัดและการกู้คืน ควบคุม (อีอาร์ซี) การตระเตรียม
กำหนดความเข้มข้นของ RCL DNA ใน ERC ตามความต้องการ (ตัวอย่าง ERC เตรียมด้วย 5×10E4 คัดลอก RCL DNA เป็น ตัวอย่าง) ดังต่อไปนี้:
1) เพิ่ม 100 ใส่ตัวอย่างทดสอบ μL ลงในหลอด 1.5 มล. ที่สะอาด จากนั้นเติม 10 ไมโครลิตร 5×10E3 สำเนา/μL RCL DNA มาตรฐาน (Std4) และ ผสมให้เข้ากัน โดยมีเครื่องหมาย ERC กำกับไว้
2) ดำเนินการสกัด DNA จากตัวอย่าง ERC ร่วมกับตัวอย่างทดสอบเพื่อเตรียมตัวอย่าง ERC ที่บริสุทธิ์
- การควบคุมเชิงลบ สารละลาย (เอ็นซีเอส) การตระเตรียม
ตั้งค่าการควบคุมเชิงลบในการทดลอง ขั้นตอนการดำเนินการเฉพาะมีดังนี้:
1) เพิ่ม 100 เมทริกซ์ตัวอย่าง μL (หรือบัฟเฟอร์เจือจาง DNA) ลงในหลอด 1.5 มล. ที่สะอาด จากนั้นทำเครื่องหมายเป็น เอ็นซีเอส
2) ทำการสกัด DNA จาก NCS ตัวอย่างรวมกับตัวอย่างทดสอบเพื่อเตรียม NCS ที่บริสุทธิ์ ตัวอย่าง.
- ไม่มีเทมเพลต ควบคุม (กทช.) การตระเตรียม
ตั้งค่าการควบคุมแบบไม่มีเทมเพลตในการทดลอง ขั้นตอนการดำเนินการเฉพาะมีดังนี้:
1) NTC ไม่ต้องการการเตรียมตัวอย่างล่วงหน้า และสามารถกำหนดค่าได้ในขั้นตอนการตรวจจับ DNA ที่เหลือด้วย qPCR เนื้อหา.
2) ตัวอย่าง NTC ในแต่ละหลอดหรือหลุมคือ 20 µL ผสม (เช่น 15 µL RCL qPCR ผสม + 4 ไมโครลิตร อาร์ซีแอล ไพรเมอร์&หัววัด มิกซ์ +1 ไมโครลิตรไอซี) + 10 บัฟเฟอร์เจือจาง DNA ขนาด μL ขอแนะนำให้กำหนดค่าหลุมจำลองสามหลุม
- พีซีอาร์ ปฏิกิริยา ระบบ
| ส่วนประกอบ | ปริมาตร(μL) |
| RCL qPCR มิกซ์* | 15 |
| ไพรเมอร์และโพรบผสม RCL | 4 |
| ไอซี | 1 |
| เทมเพลต DNA | 10 |
| ทั้งหมด ปริมาณ** | 30 |
ตารางที่ 2 ระบบปฏิกิริยา
- คำนวณ เดอะ ทั้งหมด พีซีอาร์ ปฏิกิริยา ปริมาณ โดย เดอะ ตัวเลข ของ ปฏิกิริยา: qPCR ผสม =(ที่ ตัวเลข ของ ปฏิกิริยา+2) × (15+4+1) μL (รวม เดอะ การสูญเสียของ (หลุมปฏิกิริยาสองหลุม) แนะนำให้ทดลองทำซ้ำมากกว่าสามครั้งสำหรับแต่ละตัวอย่าง
- หลังจาก การปิดฝา เดอะ หลอด หรือ การปิดผนึก เดอะ จานเหวี่ยง เดอะ ปฏิกิริยา หลอด หรือ จาน ที่ ต่ำ ความเร็ว สำหรับ 10 วินาที หลังจากนั้น เพียงพอ การสั่น และ การผสม สำหรับ 5 วินาที ทำซ้ำ เครื่องเหวี่ยง ถึง เก็บรวบรวม เดอะ ของเหลว จาก เดอะ ฝา หรือ กำแพง ถึง เดอะ ด้านล่าง หลีกเลี่ยง ฟองอากาศ ในระหว่าง การดำเนินการ.
ดูตารางด้านล่างสำหรับการตั้งค่าแผ่นที่แนะนำ:
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| เอ | กทช. |
| ทีเอส 1 | ทีเอส 1 | ทีเอส 1 |
| สตด. 1 | สตด. 1 | สตด. 1 |
|
|
|
| บี | กทช. |
| ทีเอส 2 | ทีเอส 2 | ทีเอส 2 |
| สตด. 2 | สตด. 2 | สตด. 2 |
|
|
|
| ซี | กทช. |
| ทีเอส 3 | ทีเอส 3 | ทีเอส 3 |
| สตด. 3 | สตด. 3 | สตด. 3 |
|
|
|
| ดี |
|
|
|
|
|
| สตด. 4 | สตด. 4 | สตด. 4 |
|
|
|
| อี | เอ็นซีเอส |
| อีอาร์ซี 1 | อีอาร์ซี 1 | อีอาร์ซี 1 |
| สตด. 5 | สตด. 5 | สตด. 5 |
|
|
|
| เอฟ | เอ็นซีเอส |
| อีอาร์ซี 2 | อีอาร์ซี 2 | อีอาร์ซี 2 |
| สตด. 6 | สตด. 6 | สตด. 6 |
|
|
|
| จี | เอ็นซีเอส |
| อีอาร์ซี 3 | อีอาร์ซี 3 | อีอาร์ซี 3 |
|
|
|
|
|
|
|
| ชม |
|
|
|
|
|
|
|
|
|
|
|
|
ตารางที่ 3 คอมพิวเตอร์ออน อ้างอิง กระดาน
เค้าโครงแผ่นประกอบด้วย: 6 Std (เส้นโค้งมาตรฐานของความเข้มข้นมาตรฐาน 6 ค่า), 1 NTC (ไม่มีการควบคุมเทมเพลต), 1 NCS (สารละลายควบคุมเชิงลบ), 3 TS (ตัวอย่างทดสอบ), 3 ERC (การควบคุมการสกัดและการกู้คืน)สามบ่อน้ำจำลองสำหรับ แต่ละตัวอย่าง
- คำแนะนำในการตั้งค่า สำหรับ เอ พีซีอาร์ อุปกรณ์
คำแนะนำต่อไปนี้ใช้ได้เฉพาะกับ เทอร์โม เครื่องมือ ABI 7500 qPCR (ซอฟต์แวร์ เวอร์ชัน 2.0) หาก คุณใช้ เครื่องมือต่าง ๆ โปรดดูคำแนะนำเครื่องมือที่เกี่ยวข้องสำหรับคำแนะนำในการตั้งค่า
1) สร้างการทดลองใหม่ เลือกเทมเพลตการวัดเชิงปริมาณแบบสัมบูรณ์หรือ ผู้ใช้กำหนดได้
2) สร้างโพรบตรวจจับ 1 ตัว ชื่อ "RCL-DNA" เลือกฟลูออโรโฟร์รีพอร์เตอร์เป็น "FAM" และดับฟลูออโรโฟร์เป็น "ไม่มี"; สร้างโพรบตรวจจับเพิ่มอีก 1 ตัว ตั้งชื่อว่า "IC" และเลือกฟลูออโรโฟร์รีพอร์ตเตอร์เป็น "CY5" และการดับ ฟลูออเรสเซนต์เป็น "ไม่มี" ค่าฟลูออเรสเซนต์อ้างอิงคือ ROX" (ค่าฟลูออเรสเซนต์อ้างอิงอาจใช้พื้นฐานจาก แบบเครื่องมือ ฯลฯ เลือก ไม่ว่า คุณจะต้องเพิ่มมัน)
3) ใน บานหน้าต่าง 'ตัวอย่าง' เพิ่มข้อมูลตัวอย่างทั้งหมดตามลำดับ จากนั้นเลือกหลุม เลือกเป้าหมาย และ ตัวอย่างให้สอดคล้องกัน ตั้งค่า กำหนดให้มาตรฐาน RCL DNA เป็นมาตรฐาน และมอบหมายให้ ค่า 5000000, 500000, 50000, 5000, 500, 50 (หน่วยความเข้มข้นของ DNA ในแต่ละหลุมเป็นสำเนา/μL) ในคอลัมน์ปริมาณ และตั้งชื่อ บ่อน้ำ Std 1, Std 2, Std 3, Std 4, Std 5, Std 6 ตามลำดับ กำหนด หน้าที่ของ กทช. คือ กทช. กำหนด NCS, TS และ ERC เป็น ไม่ทราบแน่ชัด และมีชื่อเรียกตามรูปแบบแผ่นด้านบนตามลำดับ จากนั้นคลิกถัดไป
4) ตั้งค่าโปรแกรมการขยาย: ตั้งค่าปริมาตรปฏิกิริยาเป็น 30 μL
| ขั้นตอนการปั่นจักรยาน | อุณหภูมิ(℃) | เวลา | วงจร |
| ระบบย่อยอาหารปนเปื้อน | 37℃ | 5 นาที | 1 |
| การเปลี่ยนสภาพเบื้องต้น | 95℃ | 5 นาที | 1 |
| การเปลี่ยนแปลงสภาพธรรมชาติ | 95℃ | 15 วินาที |
45 |
| การอบ/ขยาย (การรวบรวมฟลูออเรสเซนต์) | 60℃ | 30 วินาที |
ตารางที่ 4 ขั้นตอนการขยายเสียง
- การวิเคราะห์ของ คิวพีซีอาร์ ผลลัพธ์
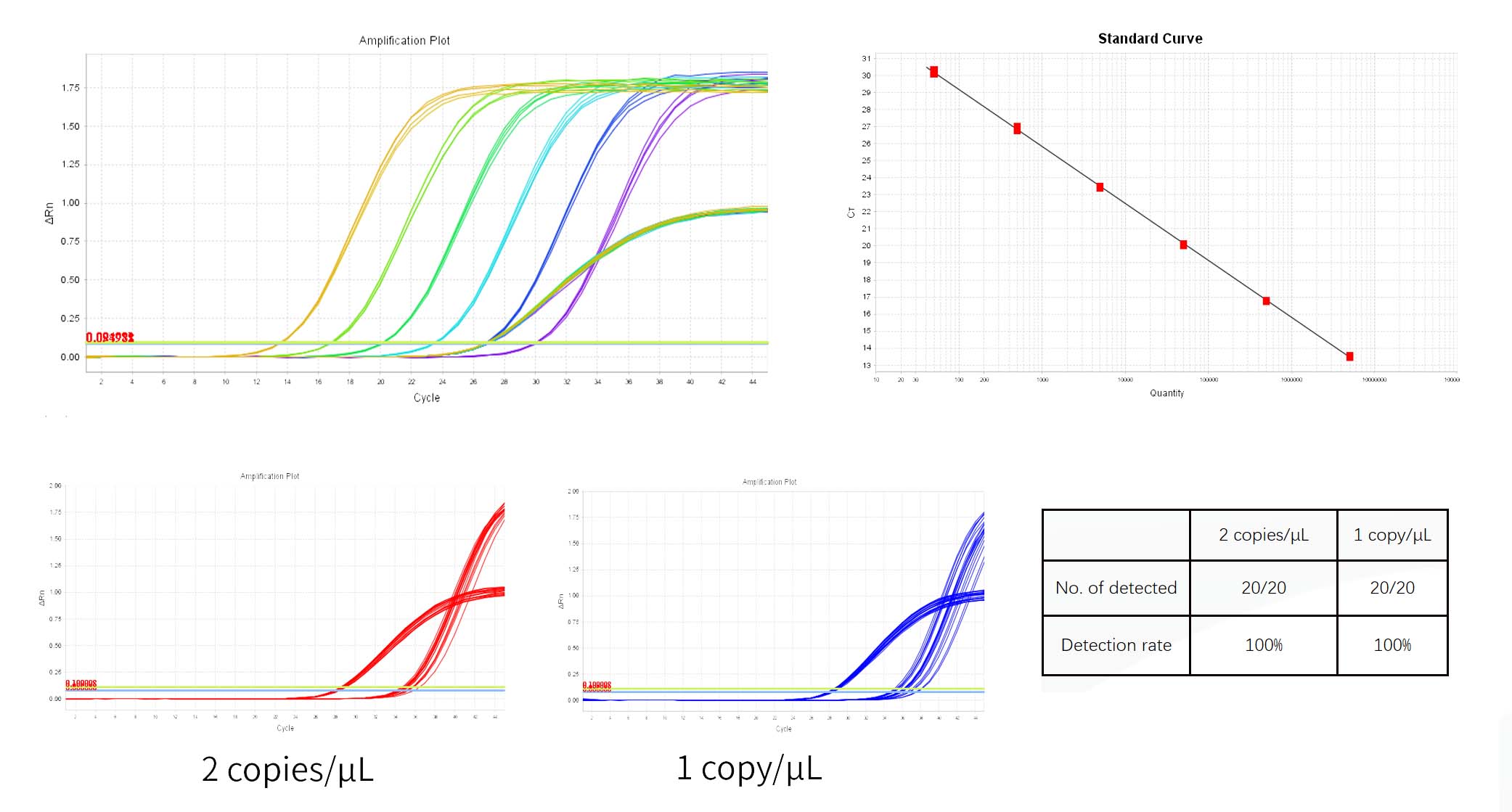
1) ระบบ จะให้ค่า Threshold โดยอัตโนมัติใน แผงพล็อตการขยายของ การวิเคราะห์. เกณฑ์ที่กำหนด โดยระบบจะอยู่ใกล้เส้นฐานเกินไปบางครั้ง ส่งผลให้มีความแตกต่างกันมาก ใน Ct ระหว่างหลุมจำลอง คุณสามารถปรับได้ด้วยตนเอง เกณฑ์ไปยังตำแหน่งที่เหมาะสมแล้วคลิก วิเคราะห์ แล้วจึงตรวจสอบเบื้องต้นได้ ว่าเส้นโค้งการขยายนั้นปกติหรือไม่ใน Multicomponent Plot
2) ในผลลัพธ์ แท็บการวิเคราะห์ ตรวจสอบกราฟเส้นโค้งมาตรฐาน ตรวจสอบความถูกต้อง ค่า R2, ประสิทธิภาพ, ความลาดชัน และ จุดตัดแกน Y สำหรับเส้นโค้งมาตรฐานปกติ R²>0.99, 90%≤Eff%≤110%, -3.6≤Slope≤-3.1
3) ใน 'ดู กระจกโต๊ะดีใน การวิเคราะห์ความเข้มข้นของแต่ละตัวอย่างจะแสดงเป็นปริมาณ หน่วย คือจำนวนสำเนาต่อμL หน่วยต่างๆ สามารถแปลงได้ในรายงานการทดสอบ
4) การตั้งค่าพารามิเตอร์ของ การวิเคราะห์ผลลัพธ์จะต้องอิงตามแบบจำลองและซอฟต์แวร์เฉพาะ เวอร์ชัน ใช้และสามารถตีความได้โดยอัตโนมัติโดยเครื่องมือโดยทั่วไป
5) คำนวณอัตราการฟื้นตัวของสไปค์จากผลการทดสอบของ ตัวอย่าง TS ที่จะวัดและสไปค์ตัวอย่าง การกู้คืน ERC อัตราการฟื้นตัวของ ต้องมีหนามแหลม ให้อยู่ระหว่าง 50%~150% สูตรมิเตอร์อัตราการฟื้นตัวแบบสไปค์:
อัตราการฟื้นตัว (%) = {Sample spiked assay (eg.copies/μL) - Sample assay (eg.copies/μL)} x ปริมาตรการชะออก (μL) - เชิงทฤษฎี ค่าของปริมาณการเติม DNA (เช่น สำเนา) x 100%。
6) ซีที มูลค่าของ การควบคุมเชิงลบ NCS ควรจะมากกว่าค่าเฉลี่ยของ ความเข้มข้น Ct ต่ำสุดของ เดอะ มาตรฐาน.
7) เทมเพลตควบคุมฟรี NTC ควรจะเป็น Undetermined หรือ Ct ค่า ≥38.
หมายเหตุ
- ผลิตภัณฑ์นี้ใช้เพื่อการวิจัยเท่านั้น
- โปรดปฏิบัติงานโดยสวมเสื้อคลุมแล็บและถุงมือแบบใช้แล้วทิ้งเพื่อความปลอดภัยของคุณ
3.โปรดอ่านคู่มือนี้อย่างละเอียดก่อนใช้งาน สารเคมีนี้และการทดลองควรจะได้มาตรฐานรวมทั้ง การจัดการตัวอย่าง การเตรียมระบบปฏิกิริยา และ ตัวอย่างการบวก
4. ตรวจสอบให้แน่ใจว่าส่วนประกอบแต่ละชิ้นถูกปั่นด้วยความเร็วต่ำและปั่นด้วยความเร็วต่ำก่อนใช้งาน
การชำระเงินและความปลอดภัย
ข้อมูลการชำระเงินของคุณได้รับการดำเนินการอย่างปลอดภัย เราไม่เก็บรายละเอียดบัตรเครดิตและไม่สามารถเข้าถึงข้อมูลบัตรเครดิตของคุณได้
การสอบถาม
คุณอาจชอบ
คำถามที่พบบ่อย
ผลิตภัณฑ์นี้มีวัตถุประสงค์เพื่อการวิจัยเท่านั้น และไม่ได้มีวัตถุประสงค์เพื่อใช้ในการรักษาหรือวินิจฉัยโรคในมนุษย์หรือสัตว์ ผลิตภัณฑ์และเนื้อหาได้รับการคุ้มครองโดยสิทธิบัตร เครื่องหมายการค้า และลิขสิทธิ์ที่เป็นของ
แอปพลิเคชั่นบางตัวอาจต้องใช้สิทธิ์ในทรัพย์สินทางปัญญาของบุคคลที่สามเพิ่มเติม