当 qPCR 结果异常时该怎么办?
qPCR实验有时看似简单,有时又很困难。引物设计完成后,像PCR一样一步步加入qPCR样品,即可在机上完成实验。下面介绍几种染料法qPCR实验中常见的问题,并给出可能的原因和解决方法,希望可以帮助大家解决qPCR实验中的烦恼。
1.什么是qPCR?
2. qPCR扩增曲线异常
3. qPCR熔解曲线异常
4. 订购信息
5.相关产品
6.关于阅读
1.什么是qPCR?
聚合酶链式反应技术(PCR)自发明以来,由于其简便、廉价、可靠、快速、灵敏度高等特点,PCR可能是分子生物学中应用最广泛的技术。qPCR是由PCR技术发展起来的一项技术,在DNA扩增过程中,用荧光染料检测每个PCR循环后产物总量的方法,不仅具有PCR的快速性和灵敏度,还具有特异性强、实时监测、可重复准确定量等优点。qPCR是在PCR过程中利用定量实时PCR扩增装置即qPCR仪实时监测核酸扩增产物的技术。qPCR通过对Ct值和标准曲线的分析,实现对起始模板的定量分析。1992年,日本人Higuchi首次提出了“实时荧光定量PCR技术”。 1996年美国生物公司推出全球第一台荧光定量PCR仪,该仪器由PCR扩增热循环系统、荧光检测光学系统以及计算机及应用软件组成,可通过荧光染料或荧光探针实时监测核酸扩增产物,通过数学函数关系,结合结果分析软件实现待测样本初始模板量的计算。因此实时荧光定量PCR技术得到了广泛的应用。qPCR的荧光标记方法分为基于SYBR Green I染料法的荧光染料镶嵌法、基于Taqman探针法(Cycling Probe、Molecular Bracon等)的荧光探针法、淬灭染料引物法。
qPCR实验有时感觉简单,有时又感觉困难。引物设计完成后,像PCR一样一步步加入qPCR样品,就可以上机完成实验了。但实验过程中需要注意很多小细节,比如管壁上不能挂液体,管内不能有气泡,尽量减少管壁、管盖等直接接触,以减少实验误差或者奇怪的实验结果。小毅整理了几种染料法qPCR实验中常见的问题,并给出了可能的原因和解决方法,希望可以帮助大家解决qPCR实验中的烦恼。
2. qPCR扩增曲线异常
2.1 扩增曲线对数图基线期异常
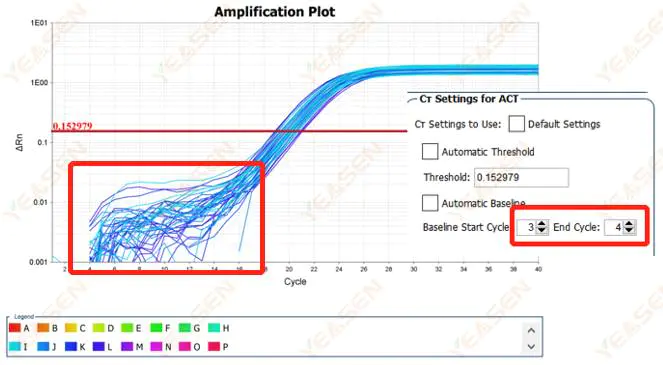
图 1. 扩增图
可能的原因:
基线设置不当。
解决方案:
建议增加基线的端点值。调整示例图如下。

图 2. 扩增图
2.2 扩增曲线对数图曲线分割
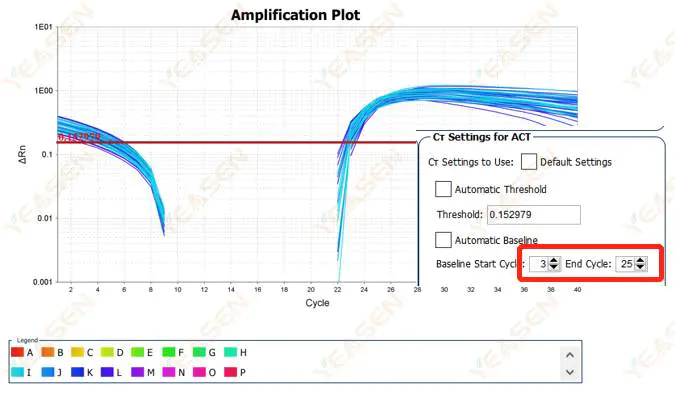
图 3. 扩增图
可能的原因:
基线设置得太高。
解决方案:
建议降低基线端点值,调整示例图如下。
2.3 扩增曲线线性图不光滑
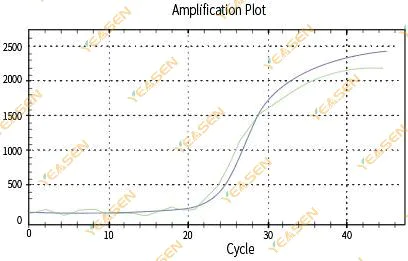
图 4. 扩增图
可能的原因:
1)PCR反应管盖不严,反应液泄漏。
2)带挂壁的PCR反应液。
3)仪器未经过校准(包括自动校准或者ROX校准)。
4)体系中抑制剂较多,导致荧光不稳定。
5)仪器过度使用导致荧光收集不稳定。
解决方案:
1)将管盖压紧。
2)充分混匀试剂,充分离心后小心地放入定量仪中。
3)校准仪器。
4)提高RNA纯度,选择合适的逆转录试剂。
2.4 放大曲线线性图在平台处呈锯齿状
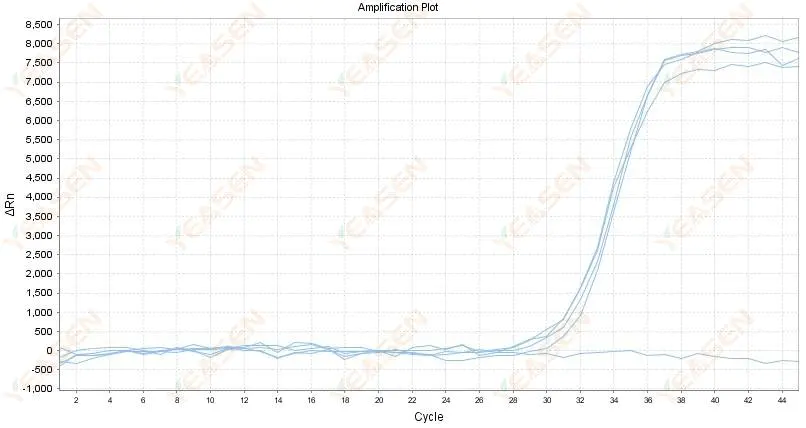
图 5. 扩增图
可能的原因:
1) RNA纯度差,杂质多。
2) 仪器使用时间过长。
解决方案:
1) 重新提取高质量RNA。
2) 稀释 RNA 模板以降低杂质的浓度。
3) 校准仪器。
2.5 扩增曲线的线性图未能达到平台期
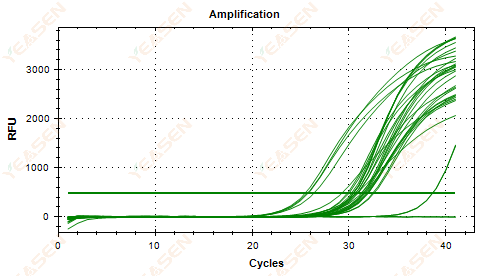
图 6. 扩增图
可能的原因:
1) 模板浓度低(Ct值约为35)。
2) 扩增循环数太少。
3) 试剂扩增效率低(Ct值小,但也无法达到平台期)。
解决方案:
1) 增加模板的浓度。
2) 增加循环次数。
3) 增加镁2+ 专注。
2.6 扩增曲线线性图平台下垂
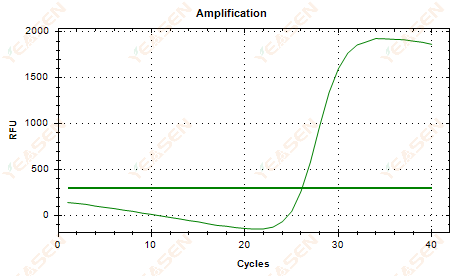
图 7. 扩增图
可能的原因:
1) 存在降解(扩增产物降解、SYBR 降解)。
2) 管盖未盖好,试剂挥发。
3) cDNA浓度过高(Ct值太小,荧光阈值被拉高,下垂比较严重)。
4) 管内有气泡,然后它们消失。
解决方案:
1) 提高系统纯度。
2) 减少 cDNA 量(稀释模板)。
3) 降低基线的端点值。
2.7 扩增曲线中Ct值过大
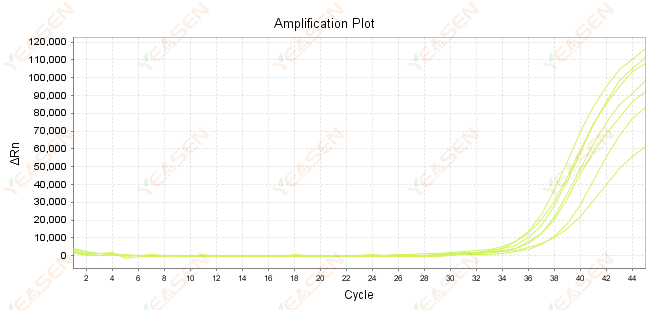
图 8. 扩增图
可能的原因:
1) 模板数量少。
2) 扩增效率低。
3) PCR 片段太长。
4) 反应体系中存在抑制剂。
解决方案:
1) 尽量减少稀释倍数或增加模板量,使Ct值落在15~30之间。
2) 优化反应条件,尝试三步扩增程序,或重新设计引物。
3) PCR产物长度设计在100-150bp内,不建议超过300bp。
4) 复制更高纯度的模板。
2.8 扩增曲线重复性差
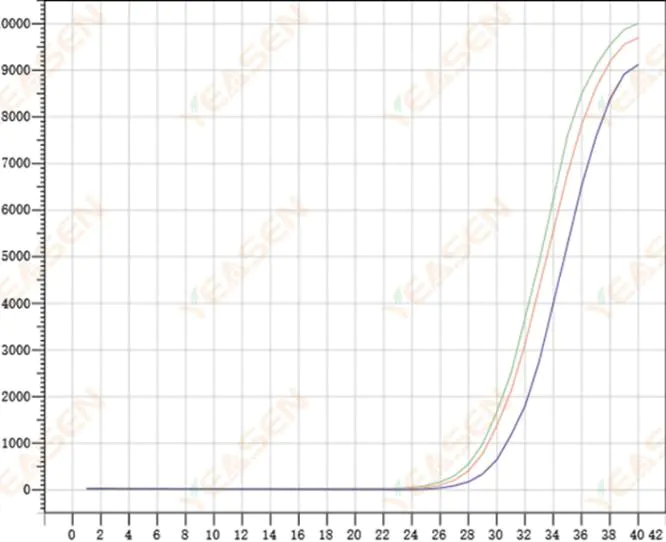
图 9. 扩增图
可能的原因:
1) 较大的尖峰误差。
2) 试剂和系统未充分混合。
3) cDNA 拷贝数低。
4) 没有使用 Rox 校准。
解决方案:
1) 校准移液器。
2) 充分混合反应体系。
3) 模板浓度低,重复性差,4-6个化合物孔,1-2个偏差较大的值可以适当丢弃。
4) 最好使用Rox校准,如果所用的试剂不含Rox,则参考染料需要选择为None。
2.9 随机扩增曲线
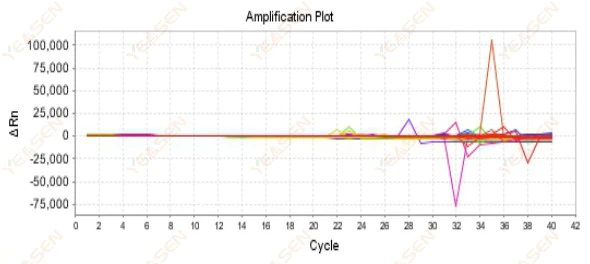
图 10. 扩增图
可能的原因:
Rox浓度与模型不匹配。
解决方案:
将仪器上的参考染料设置从ROX改为NONE,观察扩增曲线是否恢复正常。
2.10 NTC 峰值
2.10.1 Ct>35,熔化曲线Tm值<80℃
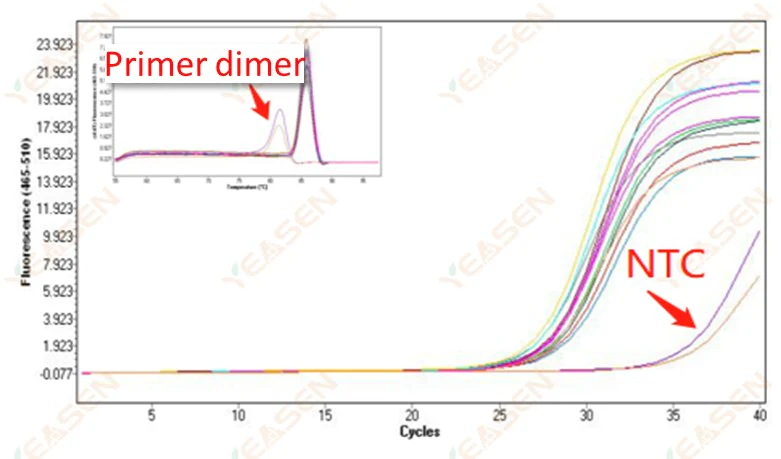
图 11. 扩增图
可能的原因:
引物二聚化结果。
解决方案:
优化引物。
2.10.2 Ct值<35,NTC熔解曲线与基因熔解曲线峰形重叠
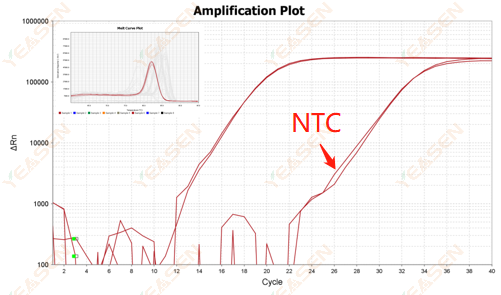
图 12. 扩增图
可能的原因:
反应体系污染。
解决方案:
逐一检查污染源。
3. qPCR熔解曲线异常
3.1 熔解曲线单峰但不尖锐
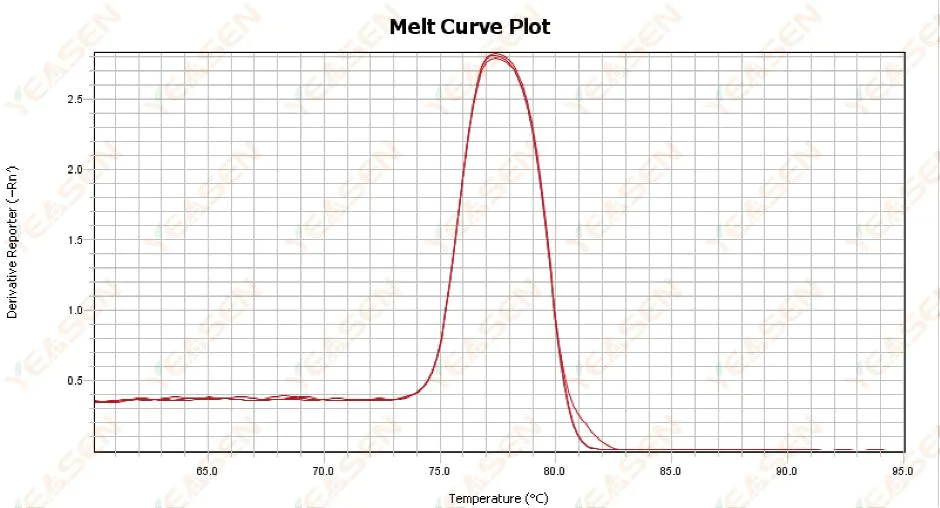
图 13. 熔解曲线图
可能的原因:
1) 与试剂成分、仪器型号有关。
2) 存在类似大小的片段的非特异性扩增。
解决方案:
1) 从峰开始到峰结束的温度跨度不高于 7°C。结果被认为是可用的,即单峰。
2) 采用高浓度琼脂糖电泳(如3%琼脂糖)辅助测定。
3.2 熔解曲线呈双峰状,下峰Tm在80℃之前
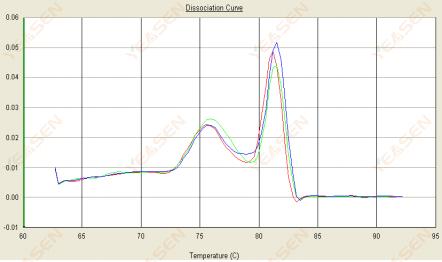
图 14. 解离曲线
可能的原因:
存在引物二聚体。
解决方案:
增加退火温度、降低引物浓度或重新设计引物。
3.3 熔解曲线呈双峰状,下峰Tm在80℃后
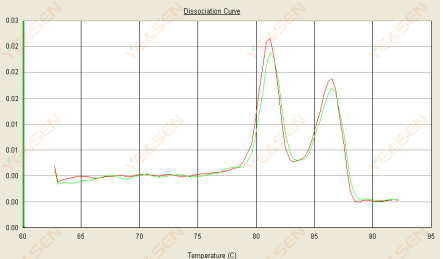
图 15. 解离曲线
可能的原因:
1) 引物特异性差导致非特异性产物的扩增。
2) gDNA 污染。
解决方案:
1) 检查引物的特异性,如果较差则重新设计。
2) 经NRC阴性对照确认,如有,需重新制备模板。
3.4 熔解曲线峰杂乱
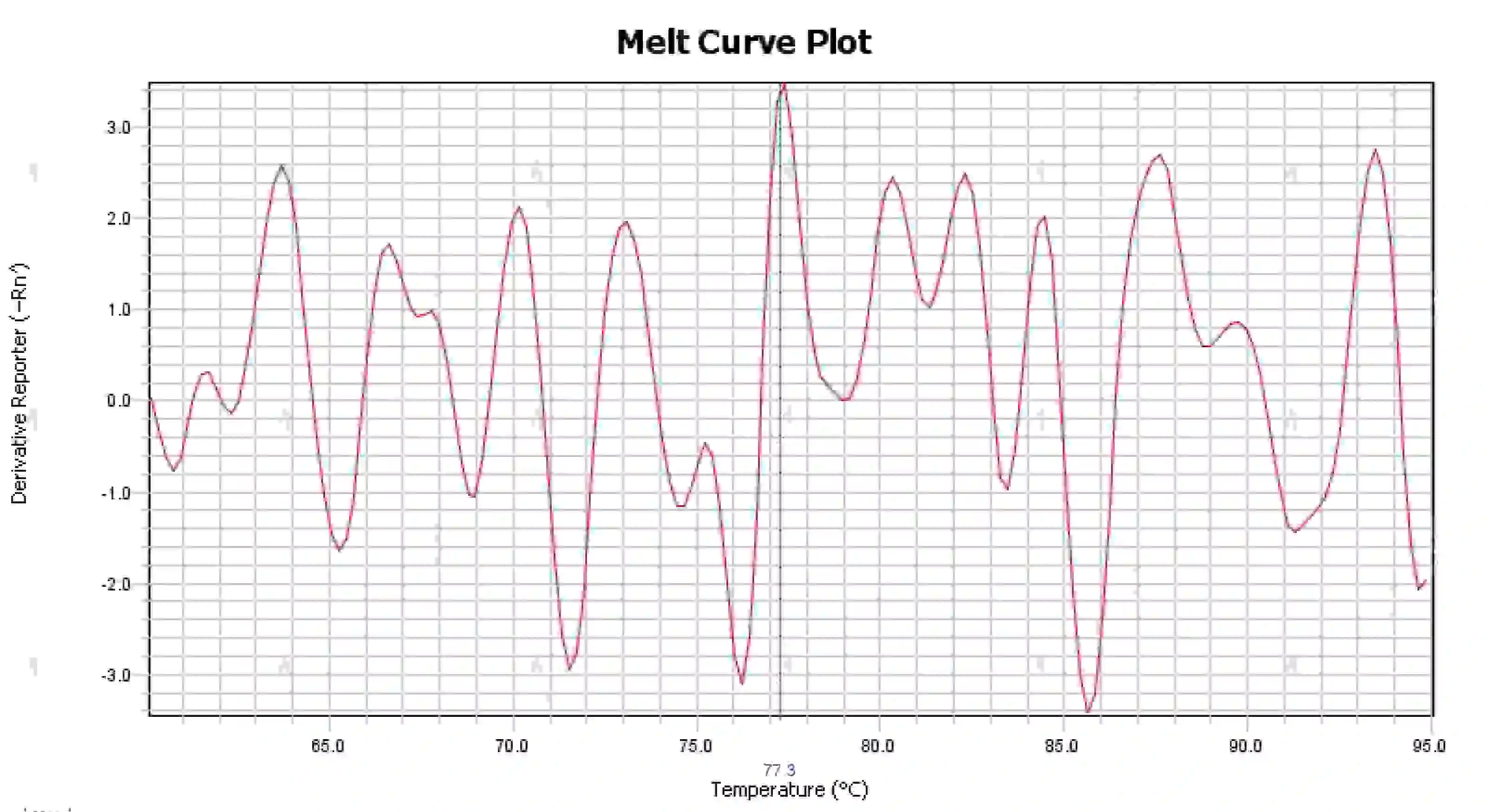
图 16. 熔解曲线图
可能的原因:
1) 反应体系受到污染。
2) 试剂暴露在强光或高温下会导致试剂失效。
3) 仪器长时间未校准。
4) 耗材与仪器不匹配。
解决方案:
1) 结合NTC和NRC结果来确认污染,建议逐一排除水、引物、酶和环境的污染。
2) 建议与新试剂做对比实验。
3) 建议定期进行仪器校准维护。
4) 确认相应仪器对耗材的要求。
3.5 熔化曲线前端的假峰
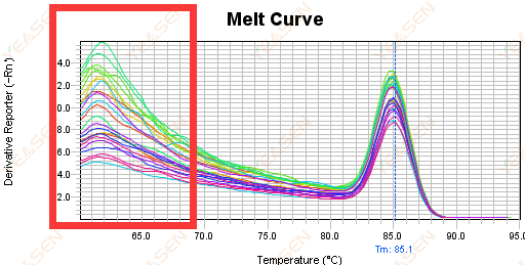
图 17. 熔解曲线图
可能的原因:
Rox 浓度与模型不匹配。
解决方案:
建议取消Rox校正,看看熔解曲线是否正常。
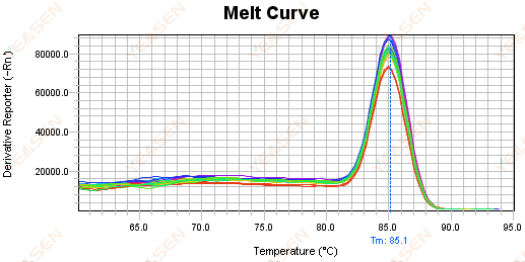
图 18. 熔解曲线图
4. 订购信息
表 1. 订购信息
| 产品名称 | 产品代码 | 规格 |
| Hieff Unicon™ Universal Blue qPCR Master Mix(染料基) | 11184ES03 | 1 毫升 |
| 11184ES08 | 5×1 毫升 | |
| 11184ES50 | 50×1毫升 | |
| 11184ES60 | 100×1毫升 |
5.相关产品
提供的产品
表 2. 相关产品
| 产品定位 | 产品名称 | 产品代码 |
| 一步法 gDNA 去除和逆转录 | Hifair™V 一步法 RT-gDNA 消化 SuperMix 用于 qPCR(询问) | 11142ES |
| 高灵敏度预混液(带 gDNA 去除步骤) | Hifair™ III 1st Strand cDNA 合成 SuperMix 用于 qPCR(gDNA digester plus) | 11141ES |
| 高灵敏度试剂盒(带 gDNA 去除步骤) | Hifair™ III 第一链 cDNA 合成试剂盒 (gDNA digester plus) (询问) | 11139ES |
| 普通定量Master Mix(探针法) | Hieff™ qPCR TaqMan 探针预混液 (询问) | 11205ES |
6.关于阅读
逆转录酶选择指南
