Ceturegel™ Basement Membrane Matrix- Dit førstevalg
Med fremskridtene inden for stamcelleterapi og organoid-baseret lægemiddeludvikling spiller basalmembranmatrix en central rolle som næringsstof og støttebærer for stamcellekulturer og organoider, 3D-cellekulturer og andre applikationer, herunder angiogenese, in vivo tumorgenese-eksperimenter osv. Ceturegel™ basalmembranekstrakter er ekstraheret fra Engelbreth-tumorrige ekstrakter (EHSwarm) i ekstracellulære matrixproteiner, herunder laminin, type IV collagen, nestin osv. IGF, FGF og andre vækstfaktorer. Ved stuetemperatur polymeriserer Ceturegel™ basalmembranmatrixen for at danne en biologisk aktiv tredimensionel matrix. Det kan simulere strukturen, sammensætningen, fysiske egenskaber og funktioner af cellebasalmembranen in vivo, hvilket er gavnligt for dyrkning og differentiering af celler in vitro og er et godt matrigel-alternativ.
1. Hvad er Ceturegel™ basalmembranmatrix?
2. Hvilken rolle spiller Ceturegel™ basalmembranmatrix?
3. Hvad er egenskaberne ved Ceturegel™ basalmembranmatrix?
4. Den populære anvendelse af Ceturegel™ basalmembranmatrix
5. Ofte stillede spørgsmål
6. Valgvejledningen til Ceturegel™ basalmembranmatrix fra Yeasen
1. Hvad er Ceturegel™ basalmembranmatrix?
Matrixen, der støder op til endotelceller, epitelceller, muskel- og neuronceller, danner en kontinuerlig, lagdelt ekstracellulær matrix kaldet basalmembranen. Basalmembranen degenererer og regenererer under udvikling og sårheling. Det understøtter ikke kun celler og cellelag, men spiller også en vigtig rolle i dannelsen af væv ved at påvirke celleadhæsion, migration, proliferation og differentiering, som er funktioner i basalmembranen. Derfor kan det siges, at basalmembranen er hovedbarrieren for invasionen af metastatiske tumorceller.
Figur 1. Ceturegel™ basalmembranmatrix
Ceturegel™ basalmembranmatrixen udviklet og produceret af YEASEN indeholder ikke LDEV (Lactate Dehydrogenase Enhancing Virus) og har et ultralavt endotoksinindhold. Og efter mycoplasma-detektion for at sikre ingen mycoplasma-kontamination, herunder forskellige typer såsom basiskoncentration, høj koncentration og lav vækstfaktor.
2. Hvilken rolle spiller Ceturegel™ basalmembranmatrix?
Ceturegel™ basalmembranmatrix kan bruges til at fremstille basalmembranmatricer med forskellige krav. Det kan bruges til cellesignalundersøgelser, såsom studiet af vækstfaktorers rolle i dannelsen af nyretubuli af musenyrestamceller, genekspressionsundersøgelsen af muse brystepitelstamceller og tumorinvasivitetseksperimentet i Transwell. Samtidig kan den bruges til studiet af cellemorfologi, biokemisk funktion, migration, infektion og genekspression. Ceturegel™ basalmembranmatrix kan effektivt hjælpe med vedhæftning og differentiering af epitelceller og andre typer celler, herunder nerveceller, stamceller, pattedyrsepitelceller, melanomceller, vaskulære endotelceller, skjoldbruskkirtelceller og hårfollikelceller. Samtidig påvirker Ceturegel™ basalmembranmatrix også proteinekspressionsniveauet af murine brystepitelceller og understøtter perifer nerveregenerering.

Figur 2.De vigtigste anvendelsesanvisninger for Ceturegel™ basalmembranmatrix
Cellemigration og -invasion i detaljer: Cellemigration, også kendt som cellegennemgang, bevægelse eller bevægelse, refererer til bevægelse af celler, efter at de modtager et migrationssignal eller føler en gradient af visse stoffer. Cellemigration er en alternerende proces med forlængelse af pseudopodia i cellehovedet, etablering af nye adhæsioner og tilbagetrækning af halen af cellelegemet. Cellemigration er en af de grundlæggende funktioner i normale celler, og det er også en fysiologisk proces med normal vækst og udvikling af kroppen. Som en allestedsnærværende form for bevægelse af levende celler kan den deltage i en række kollektive fysiologiske og patologiske processer. Såsom embryonal udvikling, angiogenese, sårheling, immunrespons, inflammatorisk respons, åreforkalkning, cancermetastaser osv. Hvorimod celleinvasion refererer til cellers evne til at migrere fra et område til et andet gennem den ekstracellulære matrix. Celleinvasion er reaktionen fra normale celler og kræftceller på kemiske og mekaniske stimuli. Celleinvasion forekommer ofte i processer med sårheling, angiogenese, inflammation, tumorcellemetastase og unormal infiltration af væv.
3. Hvad er egenskaberne ved Ceturegel™ basalmembranmatrix?
Høj sikkerhed: ingen LDEV (laktat dehydrogenase øget virus)
Koncentrationsdiversitet: koncentrationsområdet er mellem 8~20 mg/ml
God batchstabilitet: streng produktionskvalitetsinspektionsproces for at sikre stabil ydeevne mellem batch
Lavt endotoksin: endotoksinindhold <8 EU/ml
Påvisning af kontaminering: der er ikke påvist rester af mycoplasma, bakterier og svampe
Høj enkelt batch output: enkelt batch output er over 50L niveauet
Kompatibilitet: Kompatibel med enhver type cellekulturmedium
4. Den populære anvendelse af Ceturegel™ basalmembranmatrix
4.1 Migrations- og invasionsassay
Den eksperimentelle metode til at påvise evnen til cellemigration og -invasion er Transwell-eksperimentet, og Transwell kaldes også perforeringseksperimentet. Cellesuspensionen tilsættes først til kammeret, fordi kammeret har tætte porer. Kamrene blev derefter anbragt i en 24-brønds plade, hvortil et komplet medium blev tilsat. Celler deformerede og passerede gennem huller i kammeret til ydersiden af det mere næringsrige kammer, hvor de klæbede til ydersiden. Ved at farve og tælle cellerne uden for kammeret kan cellernes migrations- og invasionsevne bedømmes. Princippet i Transwell er at sætte det lille kammer i dyrkningspladen, det lille kammer kaldes det øvre kammer, og dyrkningspladen kaldes det nedre kammer. De øvre og nedre lag af dyrkningsvæske er adskilt af en polycarbonatmembran, det øverste lag af dyrkningsvæske tilsættes til det øvre kammer, og det nederste lag af dyrkningsvæske tilføjes til det nedre kammer. Cellerne er i det øvre kammer, og sammensætningen af det nederste medium vil påvirke cellerne i det øvre kammer på grund af membranens permeabilitet. Endvidere blev virkningerne af komponenterne i det nederste medium på cellevækst og bevægelse undersøgt.
Specifikke operationer af Ceturegel™ basalmembranmatrix i migrations- og invasionsassays: Den fortyndede Ceturegel™ basalmembranmatrix blev tilsat til det øvre kammer i Transwell, og cellerne blev udpladet og inkuberet i en 37°C, 5% CO2.2 inkubator i 24 timer, fikseret i 4% paraformaldehyd og farvet med 0,1% krystalviolet farveopløsning. Celler blev observeret og talt under et inverteret fase kontrastmikroskop.
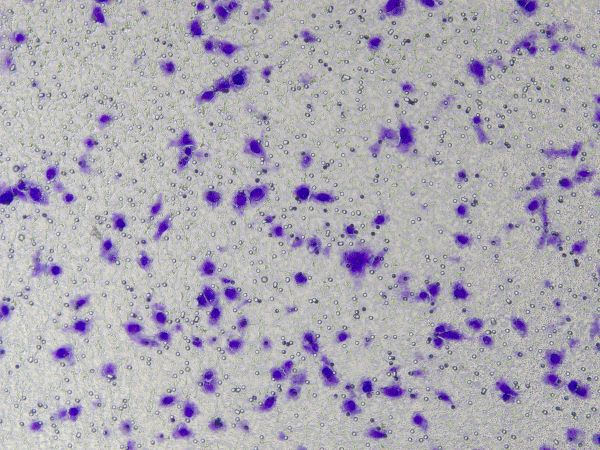
Figur 3. Resultater af krystalviolet farvning efter celleinvasion
4.2 Angiogenese
1) En dag før eksperimentet tages Ceturegel™ ud Matrigel fra fryseren og anbring den i et 4°C køleskab natten over for at tø op, mens de brugte forbrugsstoffer forkøles.
2) Opbevar altid Ceturegel™ Matrigel i en isboks før eksperimentet. Åbn den sterile emballage af angiogene objektglas og fjern objektglassene.
3) Tilsæt 10 μl Ceturegel™ Matrigel til hver brønd. Bemærk, at pipettespidsen skal være vinkelret på toppen af det indre hul, når der tilføjes Ceturegel™ Matrigel for at forhindre, at Matrigelen flyder gennem det øverste hul og efterlader en limrester.
4) Dæk først objektglasset til, klargør en 10 cm petriskål, og læg papirhåndklæder gennemvædet i vand for at lave en våd boks.
5) Læg objektglassene i petriskålen og dæk petriskålen. Læg det i en CO2 inkubator, lad den stå i ca. 30 minutter, vent på, at gelen koagulerer, og klargør samtidig cellesuspensionen.
6) Forbered de fordøjede celler til en cellesuspension med en densitet på 2*105 celler/ml og bland grundigt.
7) Fjern objektglasset, der indeholder blodkarret, der er størknet til en gel. Tilsæt 50 μl af cellesuspensionen til hver brønd, og sørg for at holde pipettespidsen lodret over den øvre brønd og ikke røre gelen i den nederste brønd.
8) Tilsæt cellekulturmediet, luk låget, og lad det stå. Efter nogen tid vil alle celler synke til overfladen af Matrigel.
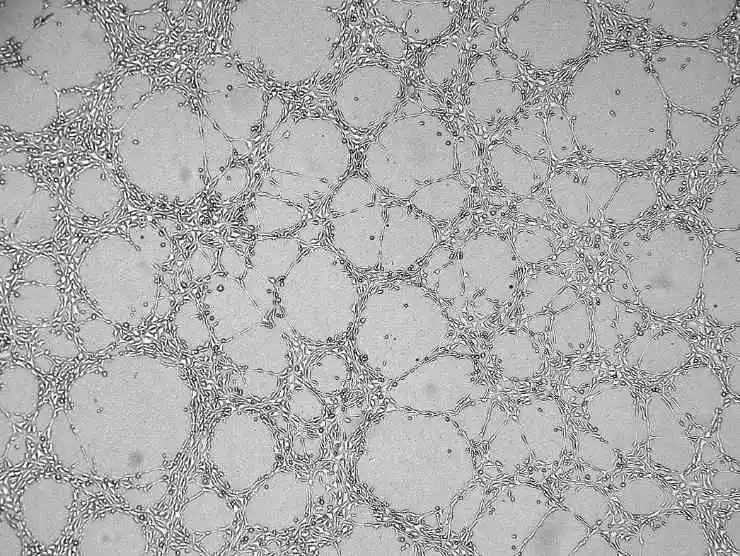
Figur 4. Angiogeneseresultatgraf
Immunfluorescensfarvning
1) Fjern forsigtigt mediet fra brøndene uden at røre limen eller cellenetværket. Fortynd calcein i serumfrit medium til en slutkoncentration på 6-8 µg/ml. Tilsæt cellefarvningsopløsning for at nedsænke cellerne fuldstændigt, og inkuber ved stuetemperatur i 30-40 minutter i mørke.
2) Vask tre gange med PBS. Bemærk, at PBS langsomt skal tilsættes til de øvre brønde for at undgå at påvirke cellerne. Fluorescensobservation ved hjælp af Ex=485 nm, Em=529 nm bølgelængde
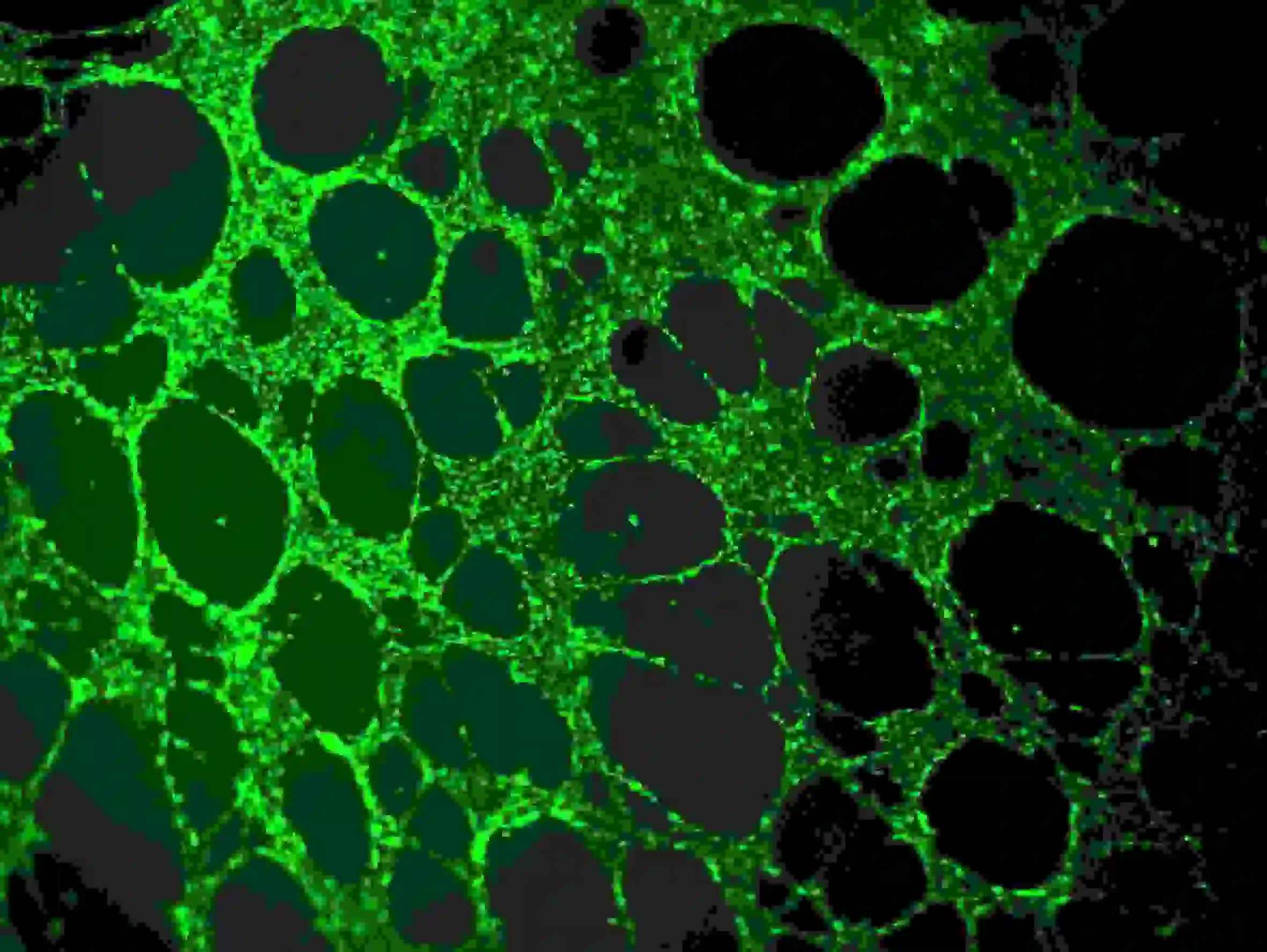
Figur 5. Immunfluorescensfarvning af blodkar
4.3 3D cellekultur
I modsætning til traditionel cellekultur reproducerer 3D-cellekultur in vivo-miljøet af celler. Selv simple sfæroidmodeller kan kompensere for manglerne ved monolagskulturer. Disse strukturer kan danne gradienter af ilt, næringsstoffer, metabolitter og opløselige signaler, som igen danner forskellige cellepopulationer. 3D-cellekulturteknologi kan bedre simulere det naturlige miljø, hvori celler lever i organismer, hvilket gør interaktionen mellem celler og biokemiske og fysiologiske reaktioner mere realistiske. I et 3D-miljø ligner cellernes reaktioner på endogene og eksogene stimuli mere deres in vivo-responser.
Den specifikke funktion af Ceturegel™ basalmembranmatrix i 3D-cellekultur er som følger: Bland forsigtigt Ceturegel™ basalmembranmatrixen med den justerede koncentration af enkeltcellet HepG2-suspension 1:1, og tilsæt 50 μl af den ovenfor blandede enkeltcellesuspension til den forafkølede 24-brønds plade med 24-brønds dråbeformede, forkølede cellespidser. dyrket i en 37°C, 5% CO2 inkubator, observeret og fotograferet hver dag.
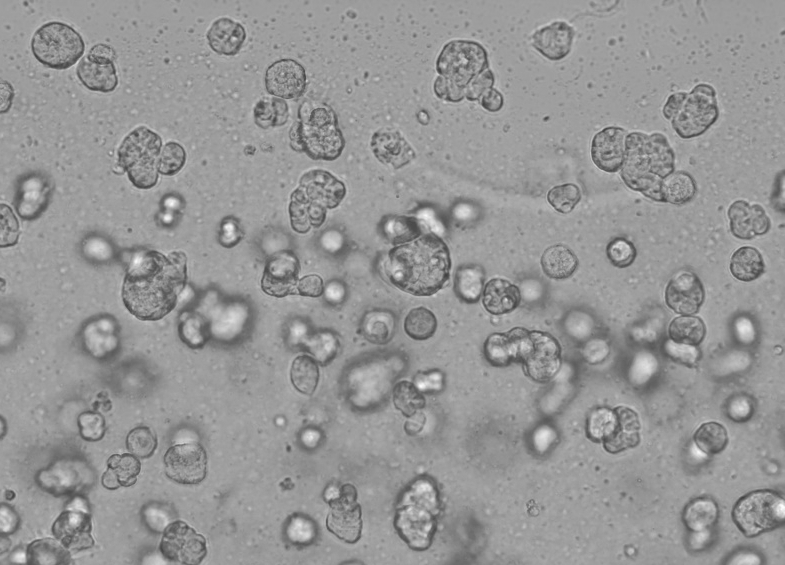
Figur 6. 3D-cellekulturresultater
Tabel 1. 3D-cellekultur Ceturegel™ basalmembranmatrix Anvendelsesreference:
| Kulturplade (fad) type | Cellekulturareal (cm2) | Brugsmåling (koncentration ≥ 3 mg/ml)* |
|---|---|---|
| 6-brønds plade | 9.6 | 200 μL/cm2 |
| 12-brønds plade | 4.5 | 180 μL/cm2 |
| 24-brønds plade | 2.0 | 180 μL/cm2 |
| 96-brønds plade | 0,32 | 160 μL/cm2 |
| 35 mm fad | 11,78 | 200 μL/cm2 |
| 100 mm fad | 58,95 | 200 μL/cm2 |
Bemærk: Forskellige partier af Ceturegel™ basalmembranmatrix har en vis koncentrationsforskel, den anbefalede dosis er kun til reference
4.4 Tumordannelseseksperiment in vivo
Ved at tage det subkutane tumorgenese-eksperiment af HepG2-celler i nøgne mus som eksempel, blev Ceturegel™ basalmembranmatrix og cellesuspension anvendt til 1:1 fortynding, og BALB/c-nu hunmus i alderen 4-5 uger blev podet subkutant. Den eksperimentelle proces er som følger:
♦ Forbered HepG2-celler med logaritmisk vækst og celletæthed på omkring 80-90%, og skift det friske medium natten før opsamling af celler.
♦ Cellerne fordøjes af trypsin. Når cellerne bliver runde og ikke forlader dyrkningsskålen, fjernes trypsinet, det serumfrie medium tilsættes for at fremstille cellesuspensionen, centrifugeres og renses én gang, og slutkoncentrationen er 5 × 107 celler/ml.
♦ Fortynd cellesuspensionen og Ceturegel™ basalmembranmatrix i forholdet 1:1 ved 4 ℃ for at fremstille en slutkoncentration på 5 × 107 celler/ml.
♦ Grib en fast nøgen mus med venstre hånd, og injicer den subkutant ved højre skulder af nøgen mus. Under podningen indsættes nålen subkutant lidt dybere, ca. 1 cm dyb, for at mindske overløbet af cellesuspension fra nåleøjet efter injektionen.
Podningsvolumenet er 200 μ L。 (Denne proces skal så vidt muligt afsluttes inden for en halv time. Undervejs skal cellesuspension placeres på is for at bremse celleapoptose og forhindre gelfænomen).
♦ Sæt de nøgne mus tilbage i buret for at fortsætte med at fodre, og tumoren kan ses i omkring 1 uge til 1 måned.Ifølge det eksperimentelle design aflives de nøgne mus, når tumorvolumenet opfylder kravene, og tag billeder.
Bemærk: Kontrolgruppen er suspensionen af dyrkningsmediet og cellerne, og den endelige tæthed er den samme som for matrixlimtestgruppen.
4.5 Organoid kultur
Organoider er 3D flercellede små væv, der er differentieret fra stamceller. Nogle egenskaber ved organer kan reproduceres. Organoider er multicellulære og udviser en høj grad af selvsamling og er derfor bedre i stand til at udvise komplekse in vivo cellulære responser og interaktioner end traditionelle 2D kulturer. Stamceller og/eller organprogenitorceller fra normalt eller sygt væv kan blandes med Ceturegel™ basalmembranmatrix eller kollagen. Danner nyre, skjoldbruskkirtel, lever, hjerne, lunge, tarm, prostata og andre mikroorganer. For forskere, der udfører genetiske screeninger, kan Ceturegel™ basalmembranmatrixsubstrater for eksempel bruges som bioblæk for at muliggøre præcis lokalisering og indlejring af levende celler/organoider i 3D-bioprint.
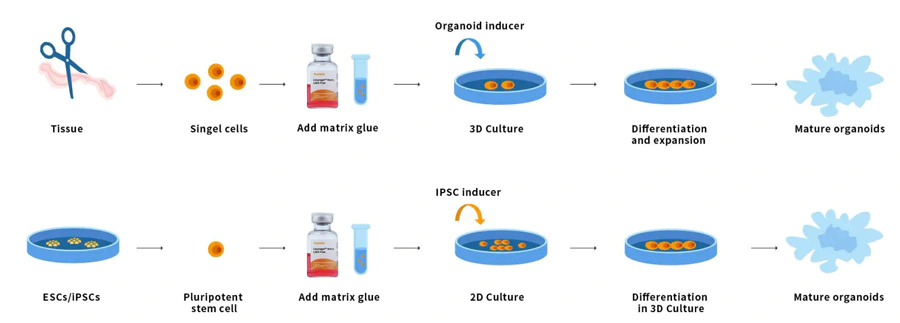
Figur 7. Organoid operationsproces
Mus tyndtarms organoid konstruktion
Prøveforberedelse: Musene blev dræbt ved at skære deres hals over, og overfladen blev sprøjtet med alkohol til sterilisering. Skær tarmvævet ud 3 ~ 15 cm nær maveenden under det sterile miljø, fjern forsigtigt mesenteriet og fedtet uden for tarmkanalen med en pincet, og læg det i DPBS-opløsningen indeholdende 1% dobbelt antistof forkølet ved 4 ℃.
Prøverensning: Brug en sprøjte til at skylle tarmkanalen 2-3 gange, brug en kirurgisk saks til forsigtigt at klippe tarmkanalen med tarmhulen opad, og brug en kirurgisk klinge til forsigtigt at skrabe tarmvilli af på overfladen af tarmhulen, og efter at det gennemsigtige tarmvæv er skraptet af, placeres tarmvævet i et nyt tarmvæv. fad indeholdende DPBS i 2-3 gange.
Indledende behandling af prøver: Skær det vaskede tyndtarmsvæv i 2 mm brede små stykker, og overfør dem derefter til et nyt 50 ml centrifugerør. Vask dem forsigtigt 3-5 gange med DPBS for at fjerne tarmvillusceller og flydende fedtvæv.
Prøvefordøjelse: tilsæt 10-15 ml forafkølet DPBS indeholdende 3-5 mM EDTA til de rensede tyndtarmsfragmenter til fordøjelse, inkuber ved 4 ℃ i ca. 30 minutter, og ryst forsigtigt centrifugerøret hver 10. minut i denne periode.
Efter fordøjelsen skal du kassere supernatanten af EDTA-fordøjelsesopløsningen og forsigtigt skylle vævene med ny DPBS-bufferopløsning 2-3 gange for at fjerne den resterende EDTA.
Tilsæt 10-15 ml forafkølet DPBS indeholdende 0,1 % BSA i tyndtarmsvævsfragmenterne, blæs og resuspender vævsfragmenterne gentagne gange for at adskille fordybningen fra basallaget, og tag derefter en lille suspension til mikroskopisk undersøgelse. Når et stort antal fordybningslignende strukturer ses, skal du stoppe med at blæse og bruge 70 % til den blæste vævssuspension μM filterskærm til at filtrere og opsamle vævssuspensionen, der passerer gennem filterskærmen.
Gentag trin 5-6 to gange og centrifuger ved 1500 rpm og 4 ℃ i 3 min.
Dannelse af blanding: Ceturegel™ Matrix lim tung suspension fordybning vævsudfældning, hver 10 μL matrix lim suspension indeholder 200~600 fordybninger. Efter resuspension anbringes blandingen på is og betjenes så hurtigt som muligt for at undgå, at matrixlimen danner gel.
Bemærk: Fortyndingsforhold af matrixlim ≥ 50% for at sikre Ceturegel™ i dyrkningsprocessen stabiliteten af matrixklæbende struktur.
Plant den blandede suspension i midten af bunden af 24-brøndspladen, 30~50μL pr. brønd til venstre og højre for at undgå, at suspensionen kommer i kontakt med åbningspladens sidevæg.
Anbring den dyrkede kulturplade i en 37 ℃ kuldioxid-konstant temperatur-inkubator, og inkuber den i ca. 30 minutter, indtil matrixgelen størkner.
Vent på Ceturegel™ Når matrixlimen er fuldstændig størknet, tilsættes langsomt det forberedte tarmorgankulturmedium langs væggen, 800μL pr. brønd.
Sæt 24-brøndspladen i 37 ℃ kuldioxidinkubatoren til dyrkning. Udskift det friske medium hver 3. dag og overvåg vækststatus for et organ som organer. Generelt dannes tyndtarmens organlignende organer hos mus inden for 5-7 dage.
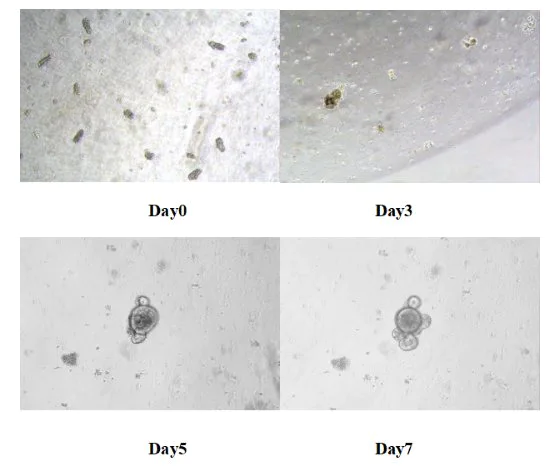
Figur 8. Resultater af in vitro dyrkning af muse tyndtarmslignende organer
5. Ofte stillede spørgsmål
1. Hvad er årsagen til farveforskellen (lysegul til mørkerød) på det opnåede substrat?
For Ceturegel™ basalmembranmatrix, der indeholder phenolrød, er den hovedsageligt forårsaget af interaktionen mellem phenolrød og bicarbonat med CO2, men farveforskellen vil blive reduceret efter ækvilibrering med 5 % CO2. Efter frysning og optøning, ryst hætteglasset forsigtigt for at sprede Ceturegel™ basalmembranmatrixen jævnt.
2. Hvilke ting skal man være opmærksom på ved betjeningen af Ceturegel™ basalmembranmatrix?
Alle operationer skal udføres i et sterilt miljø, og der skal bruges en forafkølet pipette for at sikre, at Ceturegel™ basalmembranmatrixen er homogeniseret.
3. Hvordan man fryser og opbevarer Ceturegel™ basalmembranmatrix til brug?
Den frosne og optøede Ceturegel™ Matrix LDEV-Free Ceturegel™ basalmembranmatrix kan fordeles i flere små rør. Alle distributioner skal være i forkølede kryoglas, som hurtigt skal fryses og opbevares for at undgå flere frysninger og optøning. Alle involverede genstande skal forkøles før brug. Brug forafkølede pipetter, spidser og små rør til at håndtere Ceturegel™ basalmembranmatrix.
6. Valgvejledningen til Ceturegel™ basalmembranmatrix fra Yeasen
Forskellige typer af Ceturegel™ basalmembranmatrix har forskellige anvendelser. Standardkoncentrationer af Ceturegel™ basalmembranmatrix kan bruges til polære cellekulturer, såsom epitelceller. Det kan fremme differentieringen af forskellige celler og bruges til tumorcellemigration og invasionseksperimenter. Høje koncentrationer af Ceturegel™ basalmembranmatrix anvendes i vid udstrækning in vivo og kan bruges til tubulidannelseseksperimenter. Lav vækstfaktors (GFR) hovedfunktion er at eliminere interferensen af vækstfaktorer i forsøget, og den er velegnet til undersøgelser med høje krav til præparation af basalmembran. Ceturegel™ basalmembranmatrix uden phenolrød kan eliminere interferensen af phenolrød indikator og er velegnet til farveudviklingseksperimenter, såsom kolorimetri og fluorescensdetektion. Human embryonal stamcellekultur grade Ceturegel™ basalmembranmatrix bruges specielt til human embryonal stamcellekultur, induceret pluripotent feeder-fri stamcellekultur. Yeasen leverer mange typer af Ceturegel™ basalmembranmatrix, du kan vælge dem baseret på dine eksperimenter.
Tabel 2. Ceturegel™ Matrix Valgvejledning
| Produkttype | Kat nr. | Produktnavn | Matrigel kat nr. | Ansøgningsretning |
| Basiskoncentration (8-12 mg/ml) | 40183ES | 356234/ 354234 | Tilpas til 2D- og 3D-kultur-, invasion- og migrationseksperimenter og kan også bruges til in vivo tumorogene eksperimenter | |
| 40184ES | 356237 | Anvendes hovedsageligt til farvedetektering såsom fluorescensdetektionsforsøg osv | ||
| Vækstfaktorreduktion
| 40185ES | 354230 | Hovedsageligt for at udelukke interferens af vækstfaktorer på eksperimentet. Anvendt på relateret forskning om vækstfaktorer, signalveje mv. | |
| 40186ES | 356231 | |||
| Høj koncentration (≥18mg/ml) | 40187ES | 354248 | Anvendes hovedsageligt i eksperimenter såsom angiogenese, gelembolisering og in vivo tumordannelse (til angiogenese anbefales det, at den endelige koncentration af Ceturegel™ basalmembranmatrix skal være ≥10mg/ml) | |
| 40189ES | Ceturegel™ Matrix høj koncentration, GFR, LDEV-fri | 354263 | ||
| 40188ES | Ceturegel™ Matrix høj koncentration, phenol rød-fri, LDEV-fri | 354262 | ||
| Til stamceller | 40190ES | 354277 | Anvendes hovedsageligt til stamcellekultur såsom hESC, iPSC osv. | |
| Organoid-specifik | 40191ES | Ceturegel™ Matrix til Organoid kultur, Fenol rød-fri, LDEV-fri | 356255 | Ceturegel™ basalmembranmatrix til Organoid Culture |
