Matriz de membrana basal Ceturegel™: su primera opción
Con el avance de la terapia con células madre y el desarrollo de fármacos basados en organoides, la matriz de la membrana basal desempeña un papel fundamental como nutriente y portador de soporte para cultivos de células madre y organoides, cultivos de células 3D y otras aplicaciones que incluyen angiogénesis, experimentos de tumorogénesis in vivo, etc. Los extractos de membrana basal Ceturegel™ se extraen de tumores de ratón Engelbreth-Holm-Swarm (EHS) ricos en proteínas de la matriz extracelular que incluyen laminina, colágeno tipo IV, nestina, etc. IGF, FGF y otros factores de crecimiento. A temperatura ambiente, la matriz de membrana basal Ceturegel™ se polimeriza para formar una matriz tridimensional biológicamente activa. Puede simular la estructura, composición, propiedades físicas y funciones de la membrana basal celular in vivo, lo que es beneficioso para el cultivo y la diferenciación de células in vitro y es una buena alternativa al matrigel.
1. ¿Qué es la matriz de membrana basal Ceturegel™?
2. ¿Cuál es la función de la matriz de membrana basal Ceturegel™?
3. ¿Cuáles son las características de la matriz de membrana basal Ceturegel™?
4. La aplicación popular de la matriz de membrana basal Ceturegel™
5. Preguntas frecuentes
6. Guía de selección de la matriz de membrana basal Ceturegel™ de Yeasen
1. ¿Qué es la matriz de membrana basal Ceturegel™?
La matriz adyacente a las células endoteliales, epiteliales, musculares y neuronales forma una matriz extracelular continua y estratificada llamada membrana basal. La membrana basal se degenera y regenera durante el desarrollo y la cicatrización de heridas. No solo sirve de soporte a las células y a las capas celulares, sino que también desempeña un papel importante en la formación de tejidos al afectar la adhesión, migración, proliferación y diferenciación celular, que son funciones de la membrana basal. Por lo tanto, se puede decir que la membrana basal es la principal barrera para la invasión de células tumorales metastásicas.
Figura 1. Matriz de membrana basal Ceturegel™
La matriz de membrana basal Ceturegel™ desarrollada y producida por YEASEN no contiene LDEV (virus potenciador de la lactato deshidrogenasa) y tiene un contenido de endotoxinas ultrabajo. Y después de la detección de micoplasma para garantizar que no haya contaminación por micoplasma, incluidos diferentes tipos como concentración básica, alta concentración y bajo factor de crecimiento.
2. ¿Cuál es la función de la matriz de membrana basal Ceturegel™?
La matriz de membrana basal Ceturegel™ se puede utilizar para preparar matrices de membrana basal de diversos requisitos. Se puede utilizar para estudios de señalización celular, como el estudio del papel de los factores de crecimiento en la formación de túbulos renales por células madre de riñón de ratón, el estudio de expresión génica de células madre epiteliales mamarias de ratón y el experimento de invasividad tumoral de Transwell. Al mismo tiempo, se puede utilizar para el estudio de la morfología celular, la función bioquímica, la migración, la infección y la expresión génica. La matriz de membrana basal Ceturegel™ puede ayudar de manera efectiva a la unión y diferenciación de células epiteliales y otros tipos de células, incluidas las células nerviosas, las células madre, las células epiteliales de mamíferos, las células de melanoma, las células endoteliales vasculares, las células tiroideas y las células del folículo piloso. Al mismo tiempo, la matriz de membrana basal Ceturegel™ también afecta el nivel de expresión proteica de las células epiteliales mamarias murinas y apoya la regeneración de los nervios periféricos.

Figura 2.Las principales direcciones de aplicación de la matriz de membrana basal Ceturegel™
Migración e invasión celular en detalle: La migración celular, también conocida como gateo, movimiento o desplazamiento celular, se refiere al movimiento de las células después de recibir una señal de migración o sentir un gradiente de ciertas sustancias. La migración celular es un proceso alterno de extensión de pseudópodos en la cabeza celular, establecimiento de nuevas adherencias y retracción de la cola del cuerpo celular. La migración celular es una de las funciones básicas de las células normales, y también es un proceso fisiológico del crecimiento y desarrollo normal del cuerpo. Como forma ubicua de movimiento de las células vivas, puede participar en una variedad de procesos fisiológicos y patológicos colectivos. Como el desarrollo embrionario, la angiogénesis, la cicatrización de heridas, la respuesta inmune, la respuesta inflamatoria, la aterosclerosis, la metástasis del cáncer, etc. Mientras que la invasión celular se refiere a la capacidad de las células para migrar de un área a otra a través de la matriz extracelular. La invasión celular es la respuesta de las células normales y las células cancerosas a estímulos químicos y mecánicos. La invasión celular ocurre a menudo en los procesos de cicatrización de heridas, angiogénesis, inflamación, metástasis de células tumorales e infiltración anormal de tejidos.
3. ¿Cuáles son las características de la matriz de membrana basal Ceturegel™?
Alta seguridad: sin LDEV (virus con aumento de la lactato deshidrogenasa)
Diversidad de concentración:El rango de concentración está entre 8~20 mg/ml.
Buena estabilidad del lote:Estricto proceso de inspección de calidad de producción para garantizar un rendimiento estable entre lotes.
Bajo contenido de endotoxinas: contenido de endotoxinas <8 EU/ml
Detección de contaminación:No se han detectado residuos de micoplasma, bacterias y hongos.
Alta producción de lotes únicos:La producción de un solo lote supera el nivel de 50 L.
Compatibilidad: Compatible con cualquier tipo de medio de cultivo celular.
4. La aplicación popular de la matriz de membrana basal Ceturegel™
4.1 Ensayo de migración e invasión
El método experimental para detectar la capacidad de migración e invasión celular es el experimento Transwell, y Transwell también se llama experimento de perforación. La suspensión celular se agrega primero a la cámara porque la cámara tiene poros densos. Luego, las cámaras se colocaron en una placa de 24 pocillos a la que se agregó un medio completo. Las células se deformaron y pasaron a través de los orificios de la cámara hacia el exterior de la cámara más rica en nutrientes, donde se adhirieron al exterior. Al teñir y contar las células fuera de la cámara, se puede juzgar la capacidad de migración e invasión de las células. El principio de Transwell es colocar la cámara pequeña en la placa de cultivo, la cámara pequeña se llama cámara superior y la placa de cultivo se llama cámara inferior. Las capas superior e inferior del líquido de cultivo están separadas por una membrana de policarbonato, la capa superior del líquido de cultivo se agrega a la cámara superior y la capa inferior del líquido de cultivo se agrega a la cámara inferior. Las células están en la cámara superior y la composición del medio inferior afectará a las células en la cámara superior debido a la permeabilidad de la membrana. Además, se investigaron los efectos de los componentes del medio inferior sobre el crecimiento y el movimiento celular.
Operaciones específicas de la matriz de membrana basal Ceturegel™ en ensayos de migración e invasión: La matriz de membrana basal Ceturegel™ diluida se agregó a la cámara superior del Transwell y las células se sembraron e incubaron a 37 °C, 5 % de CO2 incubadora durante 24 horas, fijada en paraformaldehído al 4% y teñida con solución de tinción de violeta cristal al 0,1%. Las células se observaron y contaron bajo un microscopio de contraste de fases invertido.
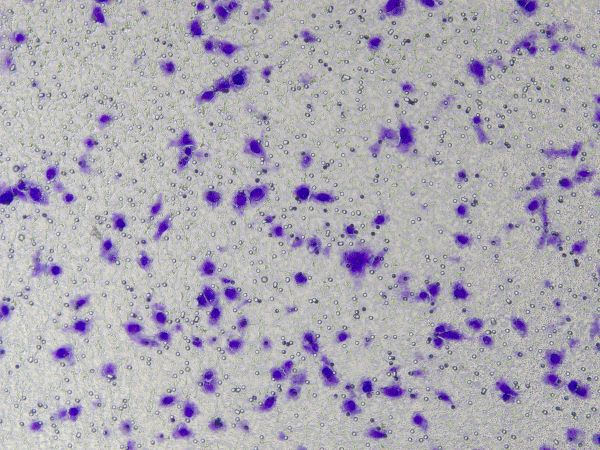
Figura 3. Resultados de la tinción con violeta de cristal después de la invasión celular.
4.2 Angiogénesis
1) Un día antes del experimento, extraiga el Ceturegel™ Saque Matrigel del congelador y colóquelo en un refrigerador a 4 °C durante la noche para descongelarlo mientras se enfrían previamente los consumibles usados.
2) Siempre mantenga Ceturegel™ Matrigel en una hielera antes del experimento. Abra el envase estéril de los portaobjetos angiogénicos y retire los portaobjetos.
3) Agregue 10 μl de Ceturegel™ Matrigel a cada pocillo. Tenga en cuenta que la punta de la pipeta debe estar perpendicular a la parte superior del orificio interior al agregar Ceturegel™ Matrigel para evitar que el Matrigel fluya a través del orificio superior y deje un residuo de pegamento.
4) Primero cubra el portaobjetos, prepare una placa Petri de 10 cm y coloque toallas de papel empapadas en agua para hacer una caja húmeda.
5) Coloque los portaobjetos en la placa de Petri y cubra la placa de Petri. Colóquela en un recipiente con CO2 incubadora, dejar reposar unos 30 minutos, esperar a que el gel coagule y preparar al mismo tiempo la suspensión celular.
6) Preparar las células digeridas en una suspensión celular con una densidad de 2*105 células/ml y mezclar bien.
7) Retire el portaobjetos de vidrio que contiene el vaso sanguíneo que se ha solidificado en un gel. Agregue 50 μl de la suspensión celular a cada pocillo, teniendo cuidado de mantener la punta de la pipeta verticalmente sobre el pocillo superior y de no tocar el gel en el pocillo inferior.
8) Añade el medio de cultivo celular, cierra la tapa y deja reposar. Después de un tiempo, todas las células se hundirán en la superficie del Matrigel.
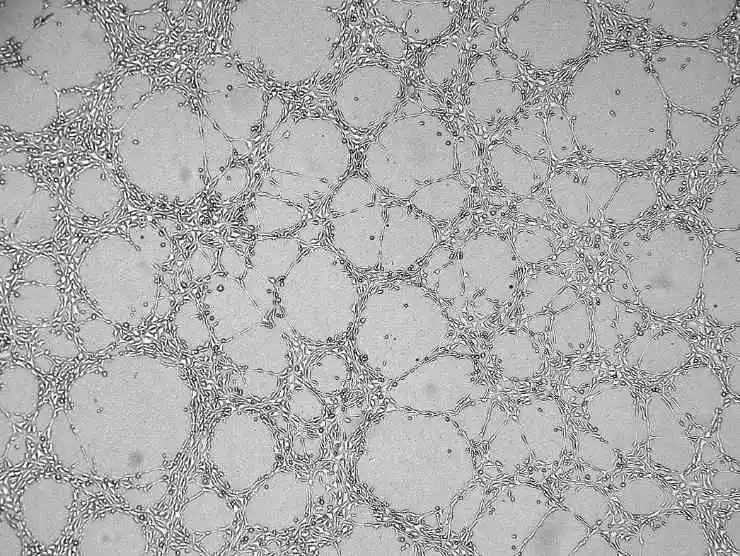
Figura 4. Gráfica de resultados de angiogénesis
Tinción de inmunofluorescencia
1) Retire con cuidado el medio de los pocillos sin tocar el pegamento ni la red celular. Diluya la calceína en un medio sin suero hasta una concentración final de 6–8 µg/ml. Agregue la solución de tinción celular para sumergir completamente las células e incube a temperatura ambiente durante 30–40 minutos en la oscuridad.
2) Lavar tres veces con PBS. Téngase en cuenta que el PBS debe agregarse lentamente a los pocillos superiores para evitar que afecte a las células. Observación de fluorescencia utilizando longitud de onda Ex=485 nm, Em=529 nm
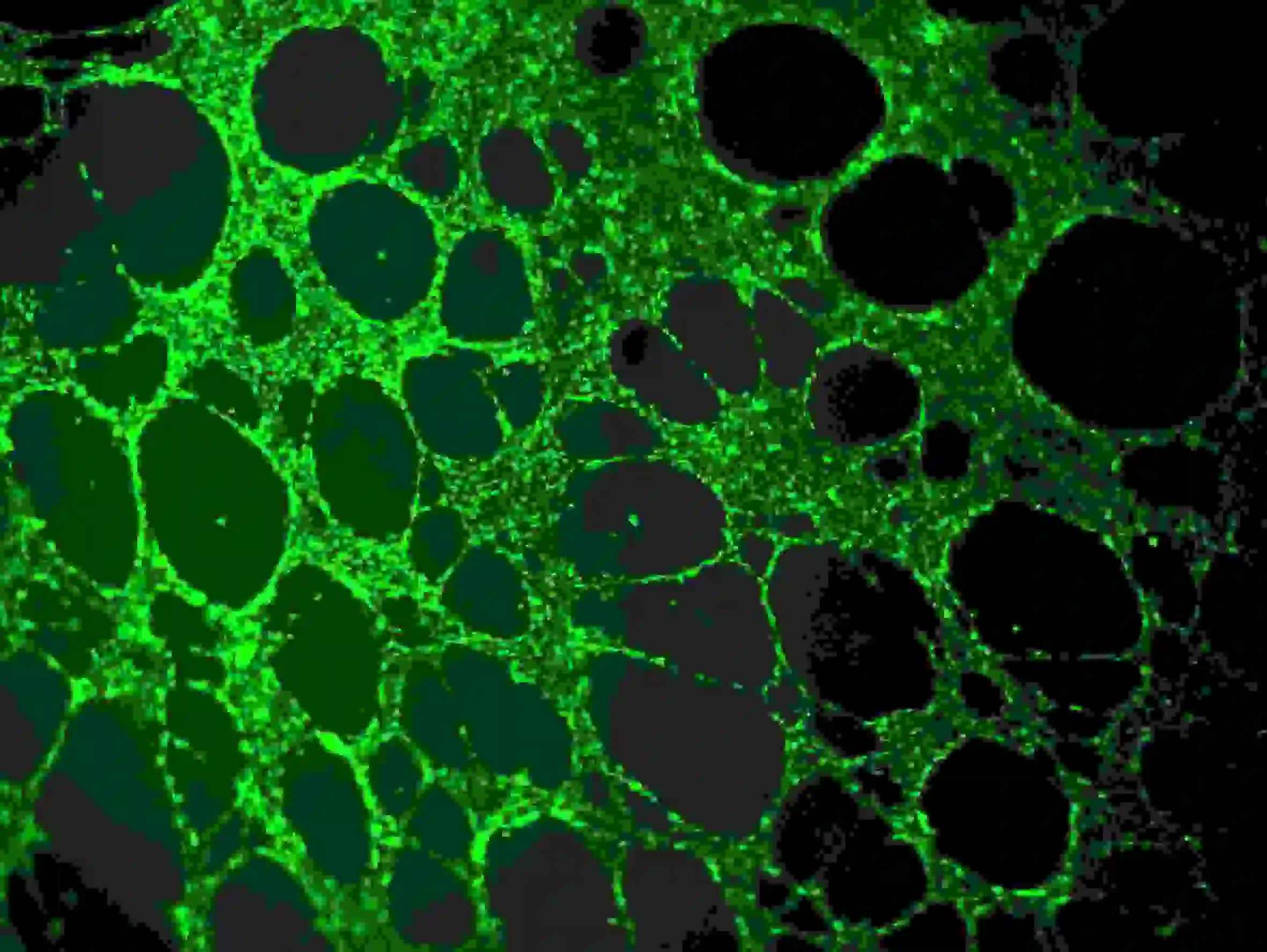
Figura 5. Tinción de inmunofluorescencia de vasos sanguíneos.
4.3 Cultivo celular 3D
A diferencia del cultivo celular tradicional, el cultivo celular en 3D reproduce el entorno in vivo de las células. Incluso los modelos esferoides simples pueden compensar las deficiencias de los cultivos en monocapa. Estas estructuras pueden formar gradientes de oxígeno, nutrientes, metabolitos y señales solubles, que a su vez forman poblaciones celulares diversas. La tecnología de cultivo celular en 3D puede simular mejor el entorno natural en el que viven las células en los organismos, lo que hace que las interacciones entre las células y las respuestas bioquímicas y fisiológicas sean más realistas. En un entorno 3D, las respuestas de las células a los estímulos endógenos y exógenos se parecen más a sus respuestas in vivo.
El funcionamiento específico de la matriz de membrana basal Ceturegel™ en el cultivo celular 3D es el siguiente: Mezcle suavemente la matriz de membrana basal Ceturegel™ con la concentración ajustada de suspensión de células individuales HepG2 1:1 y agregue 50 μl de la suspensión de células individuales mezclada anteriormente a la placa de 24 pocillos preenfriada con una punta de pipeta preenfriada para formar gotitas de células en forma de arco que se cultivaron en una incubadora a 37 °C, 5 % de CO2, se observaron y fotografiaron todos los días.
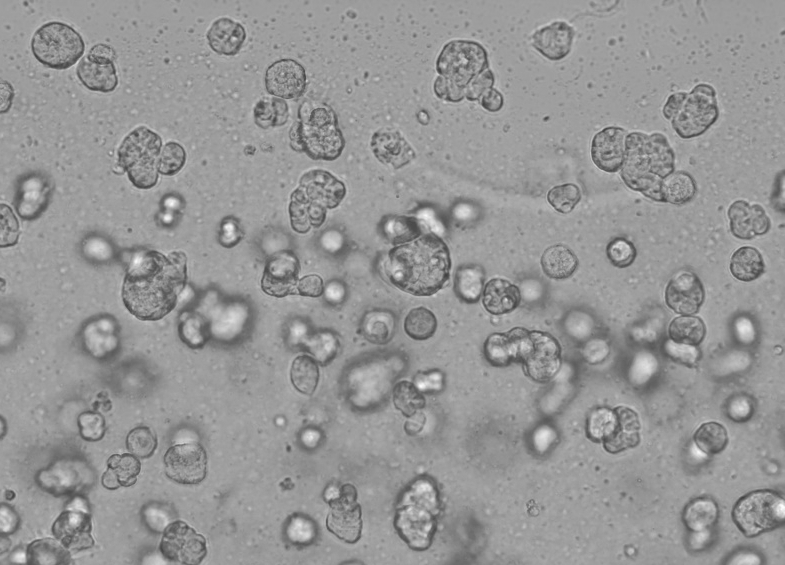
Figura 6. Resultados del cultivo celular en 3D
Tabla 1. Matriz de membrana basal Ceturegel™ para cultivo celular en 3D Referencia de uso:
| Tipo de placa de cultivo | Área de cultivo celular (cm2) | Medición de uso (concentración ≥ 3 mg/mL)* |
|---|---|---|
| Placa de 6 pocillos | 9.6 | 200 μL/cm2 |
| Placa de 12 pocillos | 4.5 | 180 μL/cm2 |
| Placa de 24 pocillos | 2.0 | 180 μL/cm2 |
| Placa de 96 pocillos | 0,32 | 160 μL/cm2 |
| 35 mm plato | 11,78 | 200 μL/cm2 |
| 100 mm plato | 58,95 | 200 μL/cm2 |
Nota: Los diferentes lotes de matriz de membrana basal Ceturegel™ tienen una cierta diferencia de concentración, la dosis recomendada es solo de referencia.
4.4 Experimento de formación de tumores in vivo
Tomando como ejemplo el experimento de tumorigénesis subcutánea de células HepG2 en ratones desnudos, se utilizó la matriz de membrana basal Ceturegel™ y la suspensión celular para una dilución 1:1, y se inocularon ratones hembra BALB/c-nu de 4-5 semanas de edad por vía subcutánea. El proceso experimental es el siguiente:
♦ Prepare células HepG2 con crecimiento logarítmico y densidad celular de aproximadamente 80-90% y cambie el medio fresco la noche anterior a la recolección de células.
♦ Las células son digeridas por tripsina. Cuando las células se vuelven redondas y no salen de la placa de cultivo, se elimina la tripsina, se agrega el medio sin suero para hacer la suspensión celular, se centrifuga y se limpia una vez, y la concentración final es 5 × 107 células/mL.
♦ Diluir la suspensión celular y la matriz de membrana basal Ceturegel™ en una proporción de 1:1 a 4 ℃ para preparar una concentración final de 5 × 107 células/mL.
♦ Con la mano izquierda se coge un ratón desnudo inmovilizado y se inyecta por vía subcutánea en el hombro derecho del ratón desnudo. Durante la inoculación, la aguja se inserta por vía subcutánea un poco más profundamente, aproximadamente 1 cm de profundidad, para reducir el desbordamiento de la suspensión celular del ojo de la aguja después de la inyección.
El volumen de inoculación es de 200 μL. (Este proceso debe completarse en media hora en la medida de lo posible. En el camino, la suspensión celular debe colocarse en hielo para ralentizar la apoptosis celular y evitar el fenómeno de gelificación).
♦ Coloque nuevamente a los ratones desnudos en la jaula para que continúen alimentándose y el tumor podrá verse durante aproximadamente 1 semana a 1 mes.De acuerdo con el diseño experimental, sacrificar a los ratones desnudos cuando el volumen del tumor cumpla con los requisitos y tomar fotografías.
Nota: El grupo de control es la suspensión del medio de cultivo y las células, y la densidad final es la misma que la del grupo de prueba de pegamento de matriz.
4.5 Cultivo de organoides
Los organoides son pequeños tejidos multicelulares tridimensionales diferenciados a partir de células madre. Algunas propiedades de los órganos se pueden reproducir. Los organoides son multicelulares y presentan un alto grado de autoensamblaje, por lo que son más capaces de mostrar respuestas e interacciones celulares in vivo complejas que los cultivos 2D tradicionales. Las células madre o las células progenitoras de órganos de tejido normal o enfermo se pueden mezclar con la matriz de membrana basal Ceturegel™ o colágeno. Forman riñones, tiroides, hígado, cerebro, pulmón, intestino, próstata y otros microorganismos. Por ejemplo, para los investigadores que realizan pruebas genéticas, los sustratos de la matriz de membrana basal Ceturegel™ se pueden utilizar como biotintas para permitir la localización y la incorporación precisas de células vivas/organoides en la bioimpresión 3D.
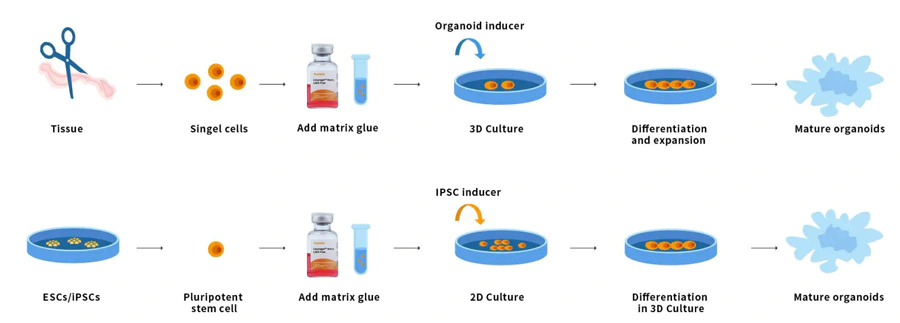
Figura 7. Proceso de funcionamiento del organide
Construcción de organoides del intestino delgado del ratón
Preparación de la muestra: Se sacrificó a los ratones cortándoles el cuello y se roció la superficie con alcohol para esterilizarlos. Se cortó el tejido intestinal de 3 a 15 cm cerca del extremo gástrico bajo un ambiente estéril, se retiró con cuidado el mesenterio y la grasa fuera del tracto intestinal con pinzas y se colocó en la solución DPBS que contenía un 1 % de anticuerpo doble preenfriado a 4 ℃.
Limpieza de la muestra: use una jeringa para enjuagar el tracto intestinal 2-3 veces, use tijeras quirúrgicas para cortar cuidadosamente el tracto intestinal con la cavidad intestinal hacia arriba y use una cuchilla quirúrgica para raspar suavemente las vellosidades intestinales en la superficie de la cavidad intestinal, y después de raspar las vellosidades intestinales (mostrando tejido transparente), coloque el tejido intestinal en una nueva placa de cultivo que contenga DPBS 2-3 veces.
Tratamiento inicial de las muestras: cortar el tejido del intestino delgado lavado en trozos pequeños de 2 mm de ancho y luego transferirlos a un nuevo tubo de centrífuga de 50 ml. Lavarlos suavemente 3-5 veces con DPBS para eliminar las células de las vellosidades intestinales y el tejido graso flotante.
Digestión de la muestra: agregue 10-15 ml de DPBS preenfriado que contenga 3-5 mM de EDTA a los fragmentos limpios del intestino delgado para la digestión, incube a 4 ℃ durante aproximadamente 30 minutos y agite suavemente el tubo de centrífuga cada 10 minutos durante este período.
Después de la digestión, deseche el sobrenadante de la solución de digestión con EDTA y enjuague suavemente los tejidos con nueva solución tampón DPBS 2-3 veces para eliminar el EDTA restante.
Agregue 10-15 ml de DPBS preenfriado que contenga 0,1 % de BSA a los fragmentos de tejido del intestino delgado, sople y resuspenda los fragmentos de tejido repetidamente para separar el receso de la capa basal, luego tome un poco de suspensión para examen microscópico. Cuando se observe una gran cantidad de estructuras similares a recesos, deje de soplar y use un filtro de μM al 70 % para la suspensión de tejido soplada para filtrar y recolectar la suspensión de tejido que pasa a través del filtro.
Repita los pasos 5 y 6 dos veces y centrifugue a 1500 rpm y 4 ℃ durante 3 minutos.
Formación de la mezcla: Suspensión pesada de pegamento matricial Ceturegel™ que precipita el tejido de las hendiduras; cada 10 μL de suspensión de pegamento matricial contiene entre 200 y 600 hendiduras. Después de la resuspensión, la mezcla se coloca en hielo y se utiliza lo antes posible para evitar que el pegamento matricial forme un gel.
Nota: la relación de dilución del pegamento de matriz ≥ 50% para garantizar que Ceturegel™ en el proceso de cultivo sea estable y tenga una buena estructura adhesiva.
Coloque la suspensión mezclada en el centro del fondo de la placa de 24 pocillos, 30~50 μL por pocillo a la izquierda y a la derecha para evitar que la suspensión entre en contacto con la pared lateral de la placa de orificio.
Coloque la placa de cultivo cultivada en la incubadora de temperatura constante de dióxido de carbono a 37 ℃ e incúbela durante aproximadamente 30 minutos hasta que el gel matriz se solidifique.
Espere a que Ceturegel™ se solidifique por completo. Una vez que el pegamento de la matriz se haya solidificado por completo, agregue lentamente el medio de cultivo de órganos intestinales preparado a lo largo de la pared, 800 μL por pocillo.
Coloque la placa de 24 pocillos en la incubadora de dióxido de carbono a 37 ℃ para el cultivo. Reemplace el medio nuevo cada 3 días y controle el estado de crecimiento de los órganos similares a órganos. Por lo general, los órganos similares a órganos del intestino delgado de los ratones se forman en un plazo de 5 a 7 días.
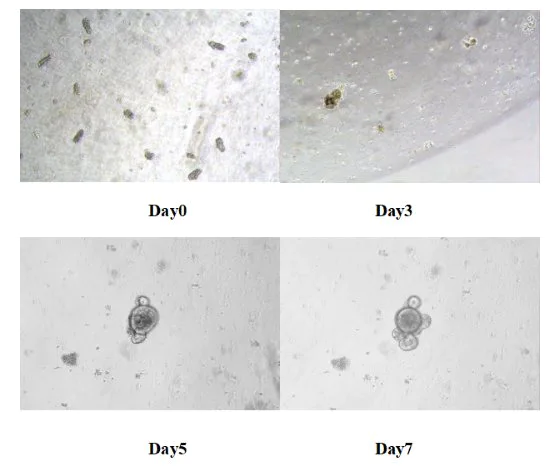
Figura 8. Resultados del cultivo in vitro de órganos similares al intestino delgado de ratón
5. Preguntas frecuentes
1. ¿Cuál es el motivo de la diferencia de color (amarillo claro a rojo oscuro) del sustrato obtenido?
En el caso de la matriz de membrana basal Ceturegel™ que contiene rojo fenol, esto se debe principalmente a la interacción del rojo fenol y el bicarbonato con CO.2, pero la diferencia de color se reducirá después del equilibrio con 5% de CO2Después de congelar y descongelar, agite el vial suavemente para dispersar uniformemente la matriz de membrana basal Ceturegel™.
2. ¿A qué aspectos se debe prestar atención durante el funcionamiento de la matriz de membrana basal Ceturegel™?
Todas las operaciones deben realizarse en un entorno estéril y debe utilizarse una pipeta previamente enfriada para garantizar que la matriz de la membrana basal Ceturegel™ esté homogeneizada.
3. ¿Cómo congelar y almacenar la matriz de membrana basal Ceturegel™ para su uso?
La matriz de membrana basal Ceturegel™ Matrix LDEV-Free congelada y descongelada se puede distribuir en varios tubos pequeños. Todas las distribuciones deben realizarse en crioviales preenfriados, que se deben congelar y almacenar rápidamente para evitar congelaciones y descongelaciones múltiples. Todos los elementos involucrados deben enfriarse previamente antes de su uso. Utilice pipetas, puntas y tubos pequeños preenfriados para manipular la matriz de membrana basal Ceturegel™.
6. Guía de selección de la matriz de membrana basal Ceturegel™ de Yeasen
Diferentes tipos de matriz de membrana basal Ceturegel™ tienen diferentes aplicaciones. Las concentraciones estándar de matriz de membrana basal Ceturegel™ se pueden utilizar para cultivos de células polares, como células epiteliales. Puede promover la diferenciación de varias células y usarse para experimentos de migración e invasión de células tumorales. Las altas concentraciones de matriz de membrana basal Ceturegel™ se utilizan ampliamente in vivo y se pueden usar para experimentos de formación de túbulos. La función principal del factor de crecimiento bajo (GFR) es eliminar la interferencia de los factores de crecimiento en el experimento, y es adecuado para estudios con altos requisitos para la preparación de la membrana basal. La matriz de membrana basal Ceturegel™ sin rojo fenol puede eliminar la interferencia del indicador rojo fenol y es adecuada para experimentos de desarrollo de color, como colorimetría y detección de fluorescencia. La matriz de membrana basal Ceturegel™ de grado de cultivo de células madre embrionarias humanas se utiliza especialmente para el cultivo de células madre embrionarias humanas, el cultivo de células madre pluripotentes inducidas sin alimentador. Yeasen ofrece muchos tipos de matrices de membrana basal Ceturegel™; puede elegirlas según sus experimentos.
Tabla 2. Guía de selección de matrices Ceturegel™
| Tipo de producto | Gato Nro. | Nombre del producto | Matrigel Cat No. | Dirección de aplicación |
| Concentración básica (8-12 mg/ml) | 40183ES | 356234/ 354234 | Se adapta a experimentos de cultivo, invasión y migración en 2D y 3D, y también se puede utilizar para experimentos tumorigénicos in vivo. | |
| 40184ES | 356237 | Se utiliza principalmente para la detección de color, como experimentos de detección de fluorescencia, etc. | ||
| Reducción del factor de crecimiento
| 40185ES | 354230 | Principalmente para excluir la interferencia de factores de crecimiento en el experimento. Se aplica a investigaciones relacionadas con factores de crecimiento, vías de señalización, etc. | |
| 40186ES | 356231 | |||
| Alta concentración (≥18 mg/ml) | 40187ES | 354248 | Se utiliza principalmente en experimentos como angiogénesis, embolización en gel y formación de tumores in vivo (para la angiogénesis, se recomienda que la concentración final de la matriz de membrana basal Ceturegel™ sea ≥10 mg/ml) | |
| 40189ES (consulta) | Matriz Ceturegel™ de alta concentración, GFR, libre de LDEV | 354263 | ||
| 40188ES | Matriz Ceturegel™ de alta concentración, libre de rojo fenol y libre de LDEV | 354262 | ||
| Para células madre | 40190ES | 354277 | Se utiliza principalmente para el cultivo de células madre como hESC, iPSC, etc. | |
| Específico de organoides | 40191ES (consulta) | Matriz Ceturegel™ para cultivo de organoides, libre de rojo fenol y libre de LDEV | 356255 | Matriz de membrana basal Ceturegel™ para cultivo de organoides |
