وقتی نتایج qPCR عجیب و غریب است چه باید کرد؟
آزمایش qPCR می تواند آسان و گاهی اوقات دشوار باشد. پس از تکمیل طراحی پرایمر، نمونه های qPCR گام به گام مانند PCR اضافه می شوند و آزمایش را می توان روی دستگاه کامل کرد. چندین مشکل رایج در آزمایش qPCR به روش رنگ وجود دارد که با توجه به علل و راه حل های احتمالی، امیدواریم بتوانید از آنها برای رفع مشکلات آزمایش qPCR استفاده کنید.
1. qPCR چیست؟
2. منحنی تقویت غیر طبیعی qPCR
3. منحنی ذوب غیر طبیعی qPCR
4. اطلاعات سفارش
5. محصولات مرتبط
6. در مورد خواندن
1. qPCR چیست؟
از آنجایی که تکنیک واکنش زنجیره ای پلیمراز (PCR) اختراع شد، PCR به دلیل سادگی، ارزان بودن، قابلیت اطمینان، سرعت و حساسیت بالا احتمالاً پرکاربردترین روش در زیست شناسی مولکولی است. qPCR یک فناوری است که توسط فناوری PCR توسعه یافته است. در طی فرآیند تکثیر DNA، روش تشخیص مقدار کل محصولات پس از هر چرخه PCR با رنگ های فلورسنت نه تنها از سرعت و حساسیت PCR برخوردار است، بلکه دارای ویژگی بیشتر و نظارت بالا، زمان واقعی، کمی سازی قابل تکرار و دقیق و مزایای دیگر است. qPCR یک فناوری است که از یک دستگاه تقویت کمی Real Time PCR، یعنی یک ابزار qPCR، برای نظارت بر محصولات تقویت اسید نوکلئیک در زمان واقعی در طول فرآیند PCR استفاده میکند. qPCR تجزیه و تحلیل کمی الگوی شروع را از طریق تجزیه و تحلیل مقدار Ct و منحنی استاندارد انجام می دهد. در سال 1992، هیگوچی ژاپنی برای اولین بار "فناوری فلورسنت کمی PCR در زمان واقعی" را پیشنهاد کرد. در سال 1996، شرکت بیولوژیکی آمریکا اولین ابزار PCR کمی فلورسنت را راهاندازی کرد که از یک سیستم چرخه حرارتی تقویتکننده PCR، سیستم نوری تشخیص فلورسانس، و کامپیوتر و نرمافزار کاربردی تشکیل شده است. این می تواند محصولات تقویت اسید نوکلئیک را در زمان واقعی از طریق رنگ های فلورسنت یا پروب های فلورسنت نظارت کند. ، از طریق رابطه تابع ریاضی، همراه با نرم افزار برای تجزیه و تحلیل نتایج، محاسبه مقدار الگوی اولیه نمونه مورد آزمایش محقق می شود. بنابراین، فناوری PCR کمی فلورسنت بلادرنگ به طور گسترده مورد استفاده قرار گرفته است. روش های برچسب گذاری فلورسنت برای qPCR به روش موزاییک رنگ فلورسنت بر اساس روش رنگ سبز SYBR، روش پروب فلورسنت بر اساس روش پروب Taqman (پروب چرخه، مولکولی براکون و غیره)، روش پرایمر رنگ خاموش کننده تقسیم می شوند.
آزمایش qPCR می تواند آسان و گاهی اوقات دشوار باشد. پس از تکمیل طراحی پرایمر، نمونه های qPCR گام به گام مانند PCR اضافه می شوند و آزمایش را می توان روی دستگاه کامل کرد. با این حال، بسیاری از جزئیات کوچک نیاز به توجه دارند، مانند عدم آویزان شدن مایع روی دیواره لوله، عدم وجود حباب در لوله، و نیاز به حداقل رساندن تماس مستقیم بین دیواره لوله، پوشش لوله و غیره برای کاهش خطاهای آزمایشی یا نتایج آزمایشی عجیب. Xiaoyi چندین مشکل رایج در آزمایشات qPCR را با روش رنگ گردآوری کرده و دلایل و راه حل های احتمالی را ارائه کرده است که امیدواریم بتوانید از آنها برای حل مشکلات آزمایش qPCR استفاده کنید.
2. منحنی تقویت غیر طبیعی qPCR
2.1 ناهنجاری در فاز خط پایه نمودار لگاریتمی منحنی تقویت
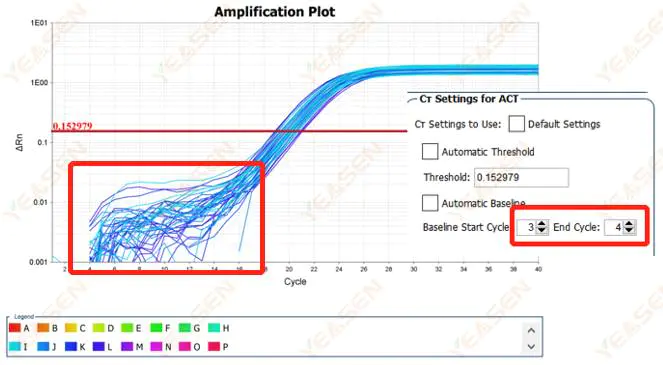
شکل 1. نمودار تقویت
علل احتمالی:
تنظیم خط پایه نامناسب
راه حل ها:
توصیه می شود مقدار نقطه پایانی خط مبنا را افزایش دهید.نمودار مثال تنظیم به شرح زیر است.

شکل 2. نمودار تقویت
2.2 تقسیم بندی منحنی رسم نمودار منحنی تقویت
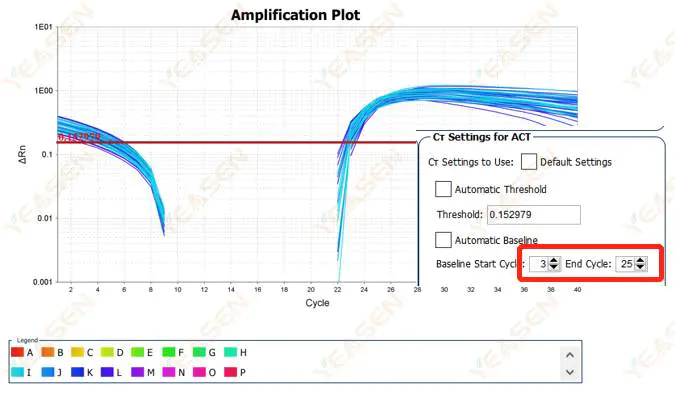
شکل 3. نمودار تقویت
علل احتمالی:
خط مبنا خیلی بالا تنظیم شده است.
راه حل ها:
توصیه می شود که مقدار نقطه پایانی خط مبنا را کاهش دهید. نمودار مثال تنظیم به شرح زیر است.
2.3 نمودار خطی منحنی تقویت غیرهموار
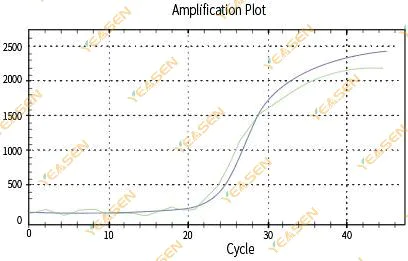
شکل 4. نمودار تقویت
علل احتمالی:
1) لوله واکنش PCR محکم بسته نشد و محلول واکنش نشت کرد.
2) محلول واکنش PCR با دیوار آویزان.
3) ابزار کالیبره نشده است (از جمله کالیبراسیون خودکار یا کالیبراسیون ROX).
4) سیستم دارای بازدارنده های زیادی است که منجر به فلورسانس ناپایدار می شود.
5) استفاده بیش از حد از ابزار منجر به جمع آوری فلورسانس ناپایدار می شود.
راه حل ها:
1) پوشش لوله را محکم فشار دهید.
2) معرف را کاملاً مخلوط کنید و پس از سانتریفیوژ کامل آن را با دقت در دستگاه کمی قرار دهید.
3) ابزار را کالیبره کنید.
4) خلوص RNA را بهبود بخشید و معرف های رونویسی معکوس مناسب را انتخاب کنید.
2.4 نمودار خطی منحنی تقویت شده زیگزاگ در یک فلات
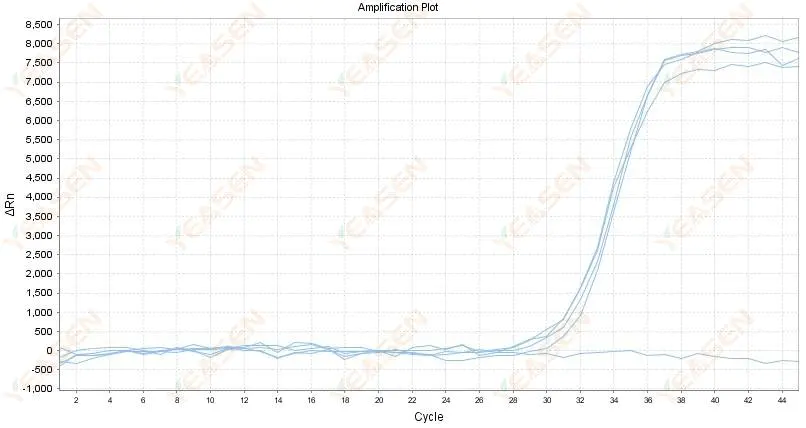
شکل 5. نمودار تقویت
علل احتمالی:
1) خلوص RNA ضعیف است و ناخالصی های زیادی وجود دارد.
2) این ساز برای مدت طولانی استفاده می شود.
راه حل ها:
1) دوباره RNA با کیفیت بالا استخراج کنید.
2) الگوی RNA را رقیق کنید تا غلظت ناخالصی ها کاهش یابد.
3) ابزار را کالیبره کنید.
2.5 نمودار خطی منحنی تقویت نمی تواند به یک فلات برسد
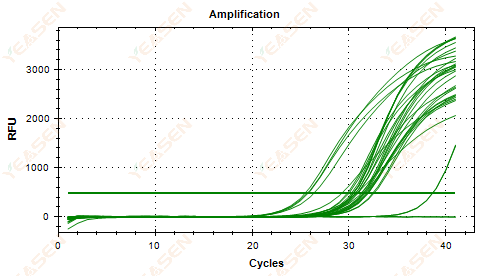
شکل 6. نمودار تقویت
علل احتمالی:
1) غلظت پایین الگو (مقدار Ct در حدود 35).
2) چرخه های تقویت خیلی کم
3) راندمان کم تقویت معرف (Ct کوچک، اما همچنین قادر به رسیدن به فلات نیست).
راه حل ها:
1) غلظت قالب را افزایش دهید.
2) تعداد چرخه ها را افزایش دهید.
3) افزایش منیزیم2+ تمرکز
2.6 منحنی تقویت خطی منحنی پلاتو افتادگی
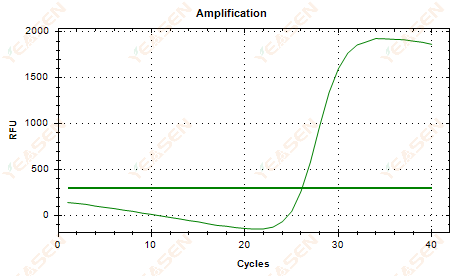
شکل 7. نمودار تقویت
علل احتمالی:
1) وجود تخریب (تخریب محصول تقویتی، تخریب SYBR).
2) درپوش لوله به درستی پوشانده نشده است و معرف تبخیر شده است.
3) غلظت cDNA خیلی زیاد است (اگر مقدار Ct خیلی کوچک باشد، آستانه فلورسانس بالا کشیده می شود و افتادگی شدیدتر است).
4) حباب های هوا در لوله، سپس آنها ناپدید می شوند.
راه حل ها:
1) بهبود خلوص سیستم
2) مقدار cDNA را کاهش دهید (الگوی رقیق).
3) مقدار نقطه پایانی خط مبنا را کاهش دهید.
2.7 مقدار زیاد Ct در منحنی تقویت
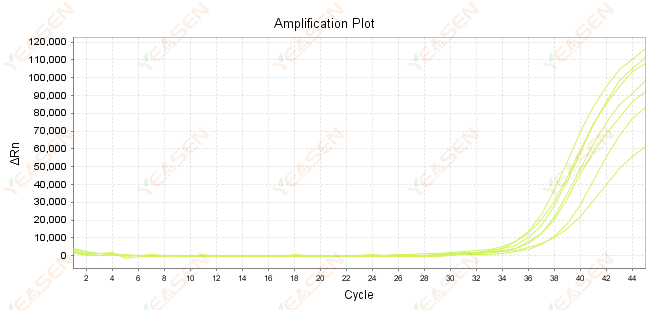
شکل 8. نمودار تقویت
علل احتمالی:
1) تعداد کم قالب
2) راندمان تقویت پایین
3) قطعه PCR خیلی طولانی است.
4) وجود بازدارنده در سیستم واکنش.
راه حل ها:
1) زمان رقت را کاهش دهید یا مقدار قالب را افزایش دهید تا مقدار Ct تا حد امکان بین 15 تا 30 کاهش یابد.
2) شرایط واکنش را بهینه کنید، روش تقویت سه مرحلهای را امتحان کنید یا پرایمرها را دوباره طراحی کنید.
3) طول محصول PCR به گونه ای طراحی شده است که بین 100-150 جفت باز باشد، توصیه نمی شود بیش از 300 جفت باز باشد.
4) تولید مثل الگوهای خلوص بالاتر.
2.8 تکرارپذیری ضعیف منحنی های تقویت
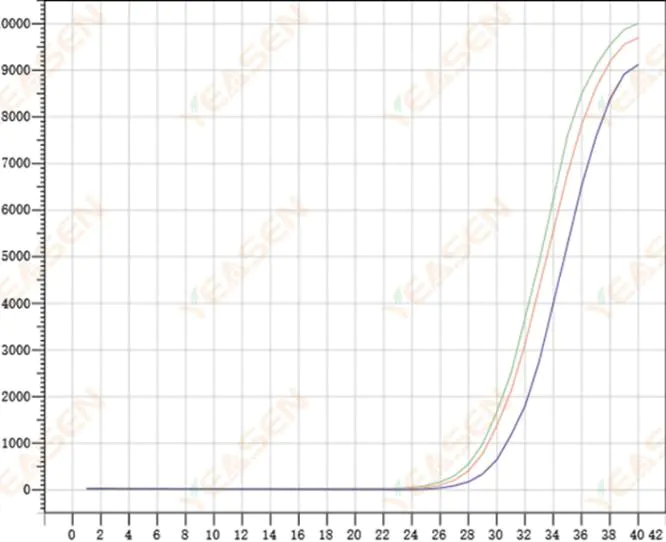
شکل 9. نمودار تقویت
علل احتمالی:
1) خطاهای اسپکینگ بزرگ
2) معرف ها و سیستم ها به خوبی مخلوط نشده اند.
3) تعداد کم کپی cDNA
4) هیچ کالیبراسیون Rox استفاده نشد.
راه حل ها:
1) کالیبره کردن پیپت ها
2) اختلاط کامل سیستم واکنش.
3) غلظت کم الگو، تکرارپذیری ضعیف، 4-6 سوراخ مرکب، و 1-2 انحراف از مقادیر بزرگتر را می توان به طور مناسب دور انداخت.
4) بهتر است از کالیبراسیون Rox استفاده کنید. اگر معرف مورد استفاده حاوی Rox نباشد، رنگ مرجع باید به عنوان None انتخاب شود.
2.9 منحنی های تقویت تصادفی
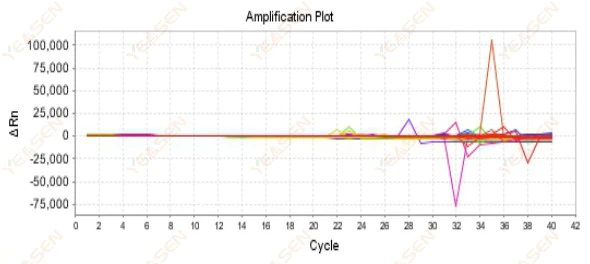
شکل 10. نمودار تقویت
علل احتمالی:
عدم تطابق بین غلظت Rox و مدل.
راه حل ها:
تنظیم رنگ مرجع روی دستگاه را از ROX به NONE تغییر دهید و ببینید آیا منحنی تقویت به حالت عادی باز می گردد یا خیر.
2.10 NTC پیکینگ
2.10.1 Ct> 35، منحنی ذوب Tm مقدار <80℃
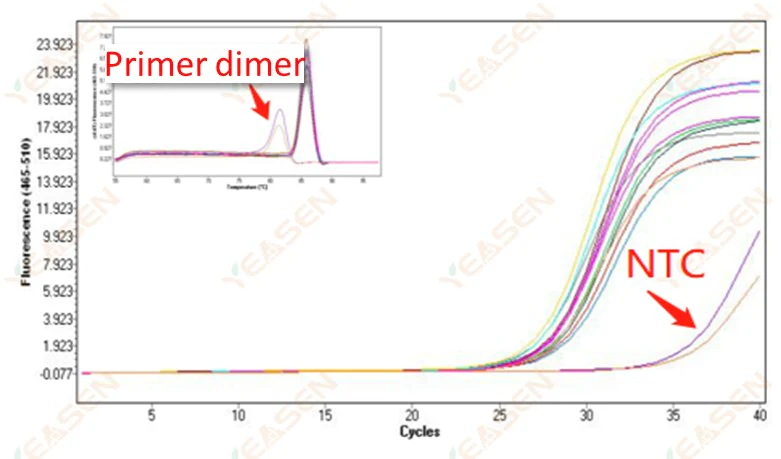
شکل 11. نمودار تقویت
علل احتمالی:
نتایج دیمریزاسیون پرایمر
راه حل ها:
پرایمرهای بهینه شده
2.10.2 مقدار Ct <35، منحنی ذوب NTC و شکل قله منحنی ذوب ژن همپوشانی دارند
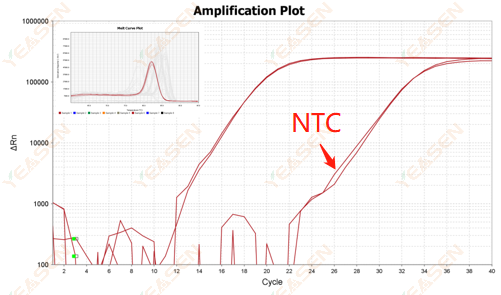
شکل 12. نمودار تقویت
علل احتمالی:
آلودگی سیستم واکنش
راه حل ها:
منابع آلودگی را یکی یکی بررسی کنید.
3. منحنی ذوب غیر طبیعی qPCR
3.1 منحنی ذوب تک پیک اما تیز نیست
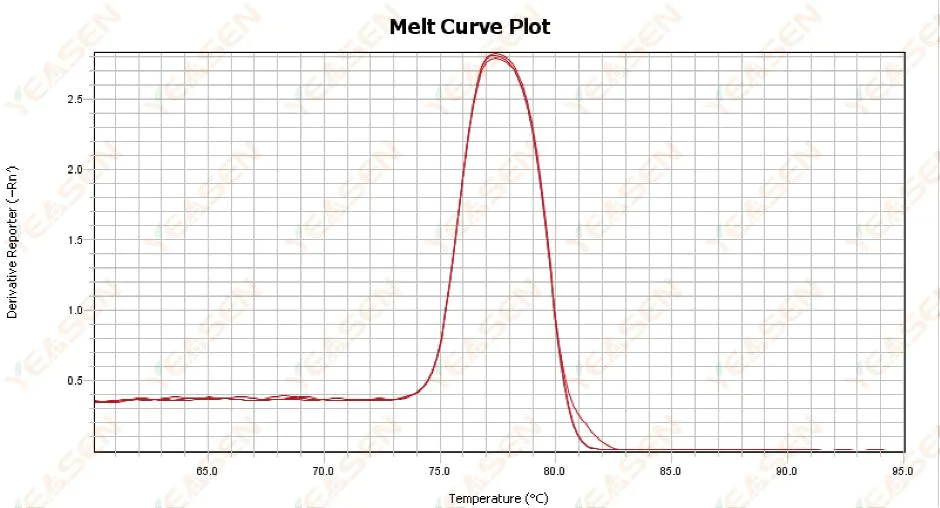
شکل 13. نمودار منحنی مذاب
علل احتمالی:
1) این به ترکیب معرف و مدل ابزار مربوط می شود.
2) وجود تکثیر غیر اختصاصی قطعات با اندازه مشابه.
راه حل ها:
1) فاصله دما از شروع اوج تا اوج خاموش شدن بیش از 7 درجه سانتیگراد نیست. نتایج قابل استفاده، یعنی تک پیک در نظر گرفته می شوند.
2) الکتروفورز آگارز با غلظت بالا (به عنوان مثال آگارز 3٪) برای کمک به تعیین انجام شد.
3.2 منحنی ذوب دو قله است و اوج پایین تر Tm قبل از 80 درجه سانتیگراد است.
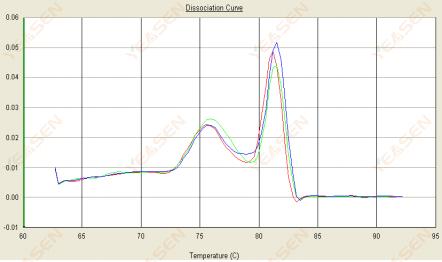
شکل 14. منحنی تفکیک
علل احتمالی:
وجود دایمرهای آغازگر.
راه حل ها:
دمای بازپخت را افزایش دهید، غلظت پرایمر را کاهش دهید یا پرایمرها را دوباره طراحی کنید.
3.3 منحنی ذوب دو قله است و اوج پایین تر Tm بعد از 80 درجه سانتیگراد است.
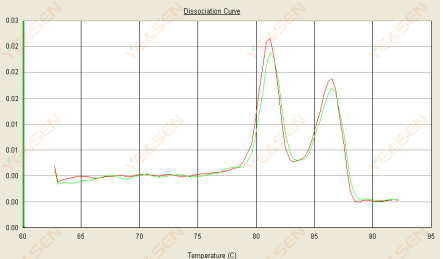
شکل 15. منحنی تفکیک
علل احتمالی:
1) ویژگی ضعیف پرایمر منجر به تقویت محصولات غیر اختصاصی می شود.
2) آلودگی gDNA
راه حل ها:
1) ویژگی پرایمر انفجاری را بررسی کنید، اگر ضعیف بود، دوباره طراحی کنید.
2) تأیید توسط کنترل منفی NRC، در صورت وجود، نیاز به آماده سازی مجدد الگو دارد.
3.4 قله های منحنی ذوب کثیف
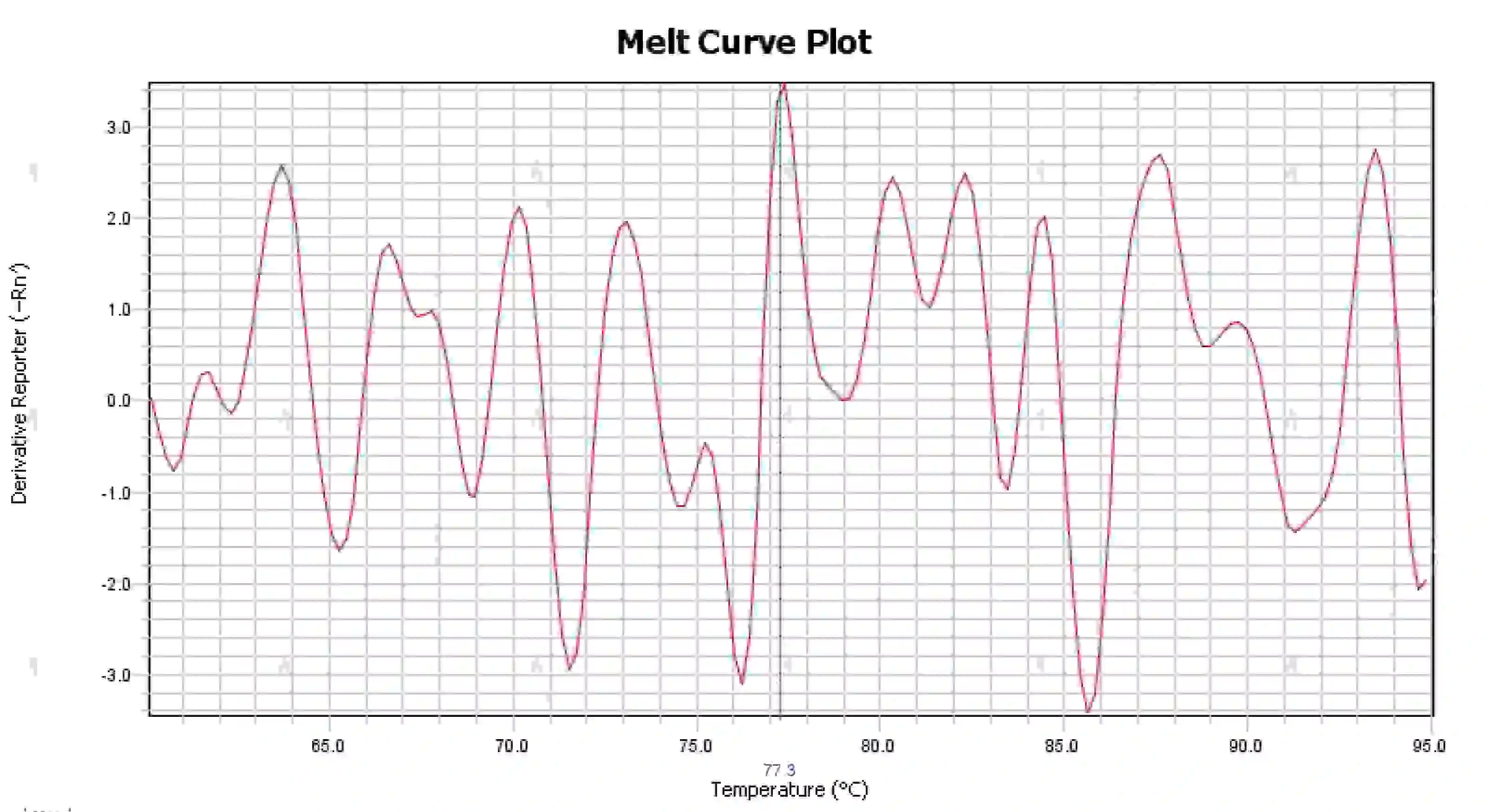
شکل 16. نمودار منحنی مذاب
علل احتمالی:
1) آلودگی سیستم واکنش
2) قرار گرفتن معرف ها در معرض نور شدید یا دمای بالا منجر به خرابی معرف می شود.
3) ابزار برای مدت طولانی کالیبره نشده است.
4) عدم تطابق بین مواد مصرفی و ابزار.
راه حل ها:
1) با ترکیب نتایج NTC و NRC برای تایید آلودگی، توصیه می شود آلودگی آب، پرایمرها، آنزیم ها و محیط زیست را یکی یکی حذف کنید.
2) انجام آزمایش های مقایسه با معرف های جدید توصیه می شود.
3) نگهداری منظم کالیبراسیون ابزار توصیه می شود.
4) الزامات ابزار مربوطه را برای مواد مصرفی تأیید کنید.
3.5 قله های کاذب در انتهای جلوی منحنی ذوب
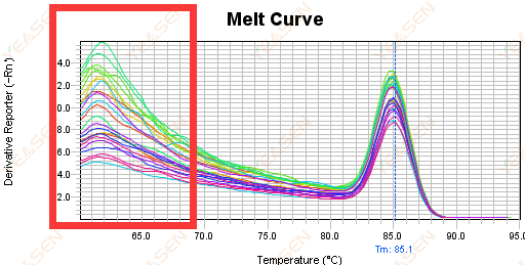
شکل 17. نمودار منحنی مذاب
علل احتمالی:
غلظت Rox با مدل مطابقت ندارد.
راه حل ها:
توصیه می شود اصلاح Rox را لغو کنید تا ببینید آیا منحنی ذوب طبیعی است یا خیر.
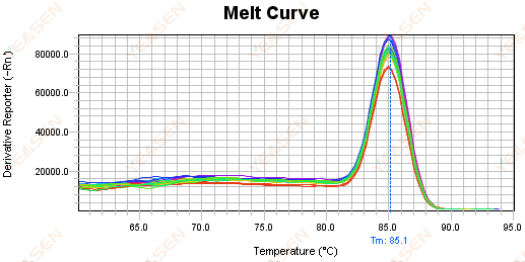
شکل 18. نمودار منحنی مذاب
4. اطلاعات سفارش
جدول 1. اطلاعات سفارش
| نام محصول | کد محصول | مشخصات |
| Hieff Unicon™ Universal Blue qPCR Master Mix (بر اساس رنگ) | 11184ES03 | 1 میلی لیتر |
| 11184ES08 | 5×1 میلی لیتر | |
| 11184ES50 | 50×1 میلی لیتر | |
| 11184ES60 | 100×1 میلی لیتر |
5. محصولات مرتبط
محصولات ارائه شده توسط Yeasen به شرح زیر می باشد.
جدول 2. محصولات مرتبط
| موقعیت یابی محصول | نام محصول | کد محصول |
| حذف یک مرحله ای gDNA و رونویسی معکوس | Hifair™V یک مرحله ای RT-gDNA هضم SuperMix برای qPCR (پرس و جو) | 11142ES |
| Master Mix با حساسیت بالا (با مرحله حذف gDNA) | Hifair™ III 1st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus) | 11141ES |
| کیت حساسیت بالا (با مرحله حذف gDNA) | کیت سنتز cDNA رشته اول Hifair™ III (gDNA digester plus) (پرس و جو) | 11139ES |
| ترکیب اصلی کمی معمولی (روش پروب) | Hieff™ qPCR TaqMan Probe Master Mix (پرس و جو) | 11205ES |
6. در مورد خواندن
DNase I و کاربردهای آنها در زیست پزشکی
راهنمای انتخاب ترانس کریپتاز معکوس
