Apa yang harus dilakukan bila hasil qPCR aneh?
Percobaan qPCR dapat terasa mudah dan terkadang sulit. Setelah desain primer selesai, sampel qPCR ditambahkan langkah demi langkah seperti PCR, dan percobaan dapat diselesaikan pada mesin. Ada beberapa masalah umum dalam percobaan qPCR dengan metode pewarna dan mengingat kemungkinan penyebab dan solusinya, kami harap Anda dapat menggunakannya untuk memecahkan masalah dalam percobaan qPCR.
1. Apa itu qPCR?
2. Kurva amplifikasi qPCR abnormal
3. Kurva pelelehan qPCR abnormal
4. Informasi Pemesanan
5. Produk Terkait
6. Mengenai membaca
1. Apa itu qPCR?
Sejak teknik reaksi berantai polimerase (PCR) ditemukan, PCR mungkin merupakan teknik yang paling banyak digunakan dalam biologi molekuler karena kesederhanaannya, murahnya, keandalannya, kecepatannya, dan sensitivitasnya yang tinggi. qPCR merupakan teknologi yang dikembangkan oleh teknologi PCR. Selama proses amplifikasi DNA, metode pendeteksian jumlah total produk setelah setiap siklus PCR dengan pewarna fluoresen tidak hanya memiliki kecepatan dan sensitivitas PCR tetapi juga memiliki spesifisitas yang lebih tinggi dan pemantauan waktu nyata yang tinggi, kuantifikasi yang dapat diulang dan akurat, dan keunggulan lainnya. qPCR merupakan teknologi yang menggunakan perangkat amplifikasi PCR kuantitatif waktu nyata, yaitu instrumen qPCR, untuk memantau produk amplifikasi asam nukleat secara waktu nyata selama proses PCR. qPCR mewujudkan analisis kuantitatif templat awal melalui analisis nilai Ct dan kurva standar. Pada tahun 1992, Higuchi dari Jepang pertama kali mengusulkan "teknologi PCR kuantitatif fluoresen waktu nyata". Pada tahun 1996, American Biological Company meluncurkan instrumen PCR kuantitatif fluoresensi pertama di dunia, yang terdiri dari sistem siklus termal amplifikasi PCR, sistem optik deteksi fluoresensi, dan perangkat lunak komputer dan aplikasi. Ini dapat memantau produk amplifikasi asam nukleat secara real time melalui pewarna fluoresensi atau probe fluoresensi. , melalui hubungan fungsi matematika, dikombinasikan dengan perangkat lunak untuk analisis hasil, perhitungan jumlah templat awal sampel yang akan diuji terwujud. Oleh karena itu, teknologi PCR kuantitatif fluoresensi waktu nyata telah digunakan secara luas. Metode pelabelan fluoresensi untuk qPCR dibagi menjadi metode mosaik pewarna fluoresensi berdasarkan metode pewarna SYBR Green I, metode probe fluoresensi berdasarkan metode probe Taqman (Cycling Probe, Molecular Bracon, dll.), metode primer pewarna quencher.
Percobaan qPCR dapat terasa mudah dan terkadang sulit. Setelah desain primer selesai, sampel qPCR ditambahkan langkah demi langkah seperti PCR, dan percobaan dapat diselesaikan pada mesin. Namun, banyak detail kecil yang perlu diperhatikan, seperti tidak ada cairan yang menggantung di dinding pipa, tidak ada gelembung di dalam pipa, dan perlunya meminimalkan kontak langsung antara dinding pipa, penutup pipa, dll., untuk mengurangi kesalahan percobaan atau hasil percobaan yang aneh. Xiaoyi telah menyusun beberapa masalah umum dalam percobaan qPCR dengan metode pewarna dan memberikan kemungkinan penyebab dan solusinya, yang kami harap dapat Anda gunakan untuk memecahkan masalah dalam percobaan qPCR.
2. Kurva amplifikasi qPCR abnormal
2.1 Kelainan pada fase dasar plot logaritmik kurva amplifikasi
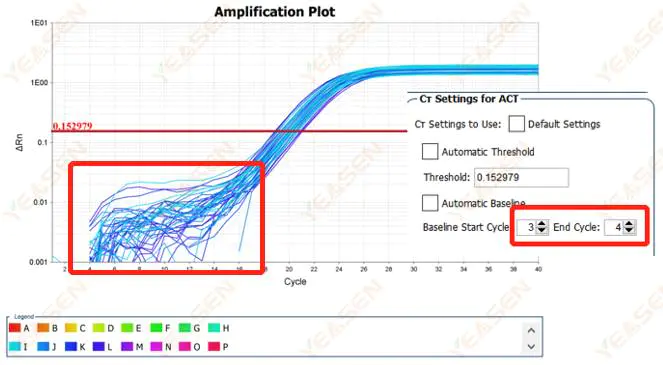
Gambar 1. Plot Amplifikasi
Kemungkinan penyebabnya:
Pengaturan dasar yang tidak tepat.
Solusi:
Disarankan untuk meningkatkan nilai titik akhir dari garis dasar.Diagram contoh penyesuaiannya adalah sebagai berikut.

Gambar 2. Plot Amplifikasi
2.2 Segmentasi kurva plot log kurva amplifikasi
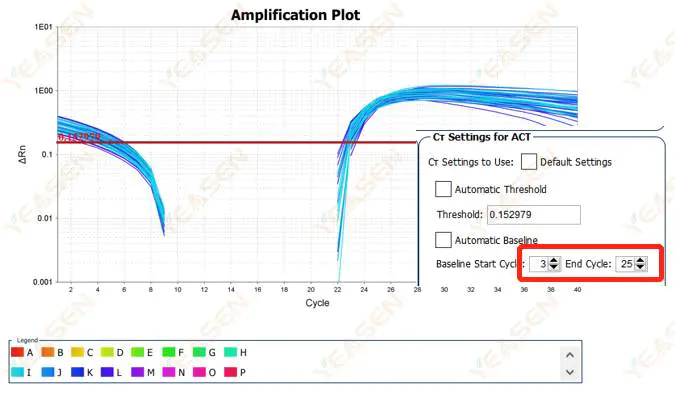
Gambar 3. Plot Amplifikasi
Kemungkinan penyebabnya:
Garis dasar ditetapkan terlalu tinggi.
Solusi:
Disarankan untuk mengurangi nilai titik akhir dari garis dasar. Diagram contoh penyesuaiannya adalah sebagai berikut.
2.3 Plot linearitas kurva amplifikasi tidak mulus
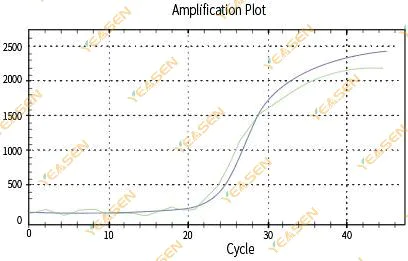
Gambar 4. Plot Amplifikasi
Kemungkinan penyebabnya:
1) Tabung reaksi PCR tidak ditutup rapat dan larutan reaksi bocor.
2) Solusi reaksi PCR dengan dinding gantung.
3) Instrumen tidak dikalibrasi (termasuk kalibrasi otomatis atau kalibrasi ROX).
4) Sistem ini memiliki banyak penghambat, yang menyebabkan fluoresensi tidak stabil.
5) Penggunaan instrumen yang berlebihan mengakibatkan pengumpulan fluoresensi tidak stabil.
Solusi:
1)Tekan penutup pipa dengan kuat.
2) Campur reagen secara menyeluruh, dan masukkan dengan hati-hati ke dalam instrumen kuantitatif setelah sentrifugasi penuh.
3)Kalibrasi instrumen.
4) Meningkatkan kemurnian RNA dan memilih reagen transkripsi balik yang tepat.
2.4 Grafik linier kurva amplifikasi zigzag di dataran tinggi
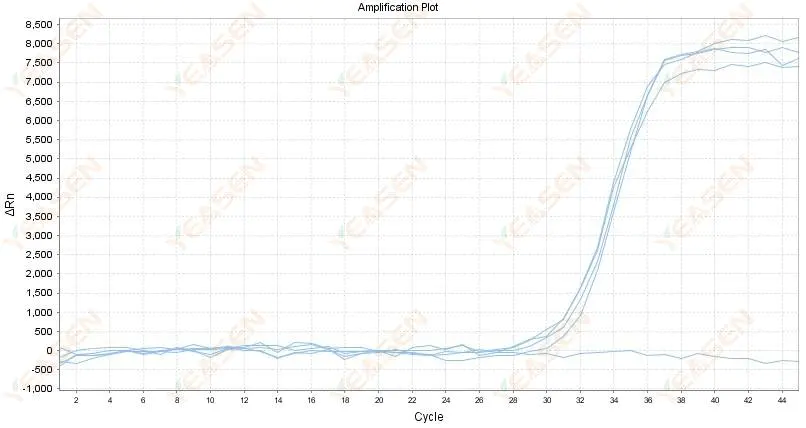
Gambar 5. Plot Amplifikasi
Kemungkinan penyebabnya:
1) Kemurnian RNA buruk dan banyak mengandung kotoran.
2) Instrumen tersebut digunakan terlalu lama.
Solusi:
1) Ekstraksi ulang RNA berkualitas tinggi.
2) Encerkan cetakan RNA untuk mengurangi konsentrasi pengotor.
3) Kalibrasi instrumennya.
2.5 Plot linier kurva amplifikasi gagal mencapai titik puncak
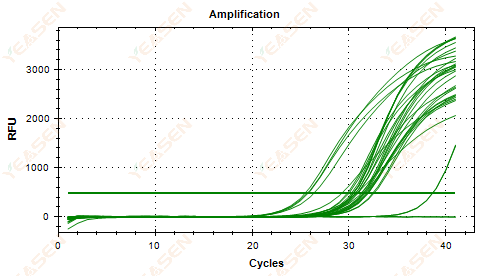
Gambar 6. Plot Amplifikasi
Kemungkinan penyebabnya:
1) Konsentrasi templat rendah (nilai Ct sekitar 35).
2) Terlalu sedikit siklus amplifikasi.
3) Efisiensi amplifikasi reagen rendah (Ct kecil, tetapi juga tidak dapat mencapai plateau).
Solusi:
1) Tingkatkan konsentrasi templat.
2) Meningkatkan jumlah siklus.
3) Meningkatkan Mg2+ konsentrasi.
2.6 Plot linier kurva amplifikasi dataran tinggi kendur
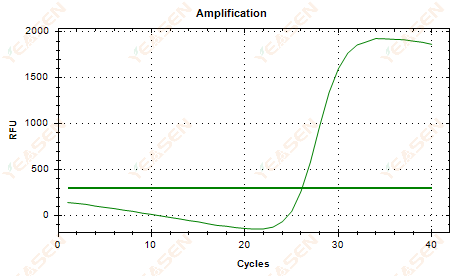
Gambar 7. Plot Amplifikasi
Kemungkinan penyebabnya:
1) Kehadiran degradasi (degradasi produk amplifikasi, degradasi SYBR).
2) Tutup tabung tidak tertutup dengan benar dan reagen menguap.
3) Konsentrasi cDNA terlalu tinggi (jika nilai Ct terlalu kecil, ambang fluoresensi menjadi tinggi, dan penurunan lebih parah).
4) Gelembung udara dalam tabung, lalu menghilang.
Solusi:
1) Meningkatkan kemurnian sistem.
2) Kurangi jumlah cDNA (encerkan templat).
3) Kurangi nilai titik akhir garis dasar.
2.7 Nilai Ct yang besar pada kurva amplifikasi
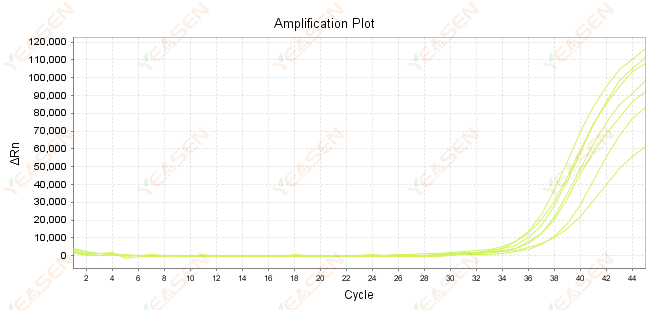
Gambar 8. Plot Amplifikasi
Kemungkinan penyebabnya:
1) Jumlah templat sedikit.
2) Efisiensi amplifikasi rendah.
3) Fragmen PCR terlalu panjang.
4) Kehadiran inhibitor dalam sistem reaksi.
Solusi:
1) Kurangi waktu pengenceran atau tingkatkan jumlah templat sehingga nilai Ct berada di antara 15 dan 30 semaksimal mungkin.
2) Optimalkan kondisi reaksi, coba prosedur amplifikasi tiga langkah, atau rancang ulang primer.
3) Panjang produk PCR dirancang antara 100-150 bp, tidak disarankan melebihi 300 bp.
4) Reproduksi templat dengan kemurnian lebih tinggi.
2.8 Pengulangan kurva amplifikasi yang buruk
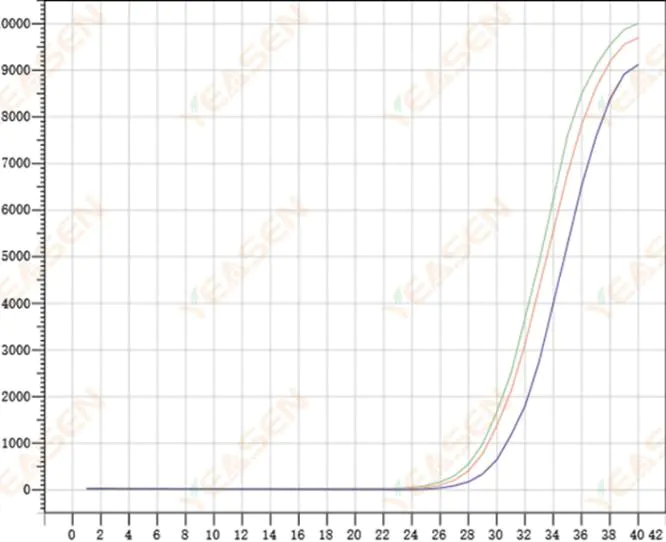
Gambar 9. Plot Amplifikasi
Kemungkinan penyebabnya:
1) Kesalahan spiking yang besar.
2) Reagen dan sistem tidak tercampur dengan baik.
3) Jumlah salinan cDNA rendah.
4) Tidak ada kalibrasi Rox yang digunakan.
Solusi:
1) Kalibrasi pipet.
2) Pencampuran sistem reaksi secara menyeluruh.
3) Konsentrasi templat rendah, pengulangan buruk, 4-6 lubang majemuk, dan 1-2 deviasi dari nilai yang lebih besar dapat dibuang dengan tepat.
4) Sebaiknya gunakan kalibrasi Rox. Jika reagen yang digunakan tidak mengandung Rox, pewarna referensi harus dipilih sebagai None.
2.9 Kurva amplifikasi acak
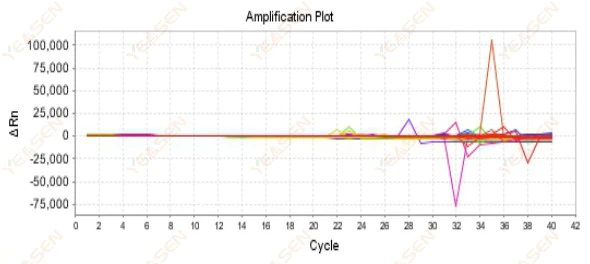
Gambar 10. Plot Amplifikasi
Kemungkinan penyebabnya:
Ketidakcocokan antara konsentrasi Rox dan model.
Solusi:
Ubah pengaturan pewarna referensi pada instrumen dari ROX ke NONE dan lihat apakah kurva amplifikasi kembali normal.
2.10 Puncak NTC
2.10.1 Ct>35, nilai kurva leleh Tm <80℃
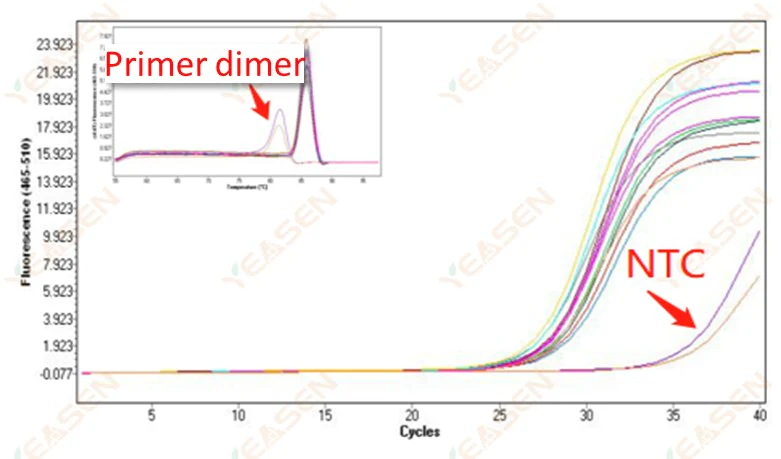
Gambar 11. Plot Amplifikasi
Kemungkinan penyebabnya:
Hasil dimerisasi primer.
Solusi:
Primer yang dioptimalkan.
Angka 2.10.2 Nilai Ct <35, bentuk puncak kurva leleh NTC dan kurva leleh gen saling tumpang tindih
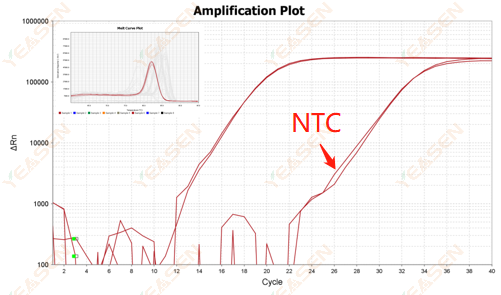
Gambar 12. Plot Amplifikasi
Kemungkinan penyebabnya:
Kontaminasi sistem reaksi.
Solusi:
Periksa sumber polusi satu per satu.
3. Kurva pelelehan qPCR abnormal
3.1 Kurva leleh puncak tunggal tetapi tidak tajam
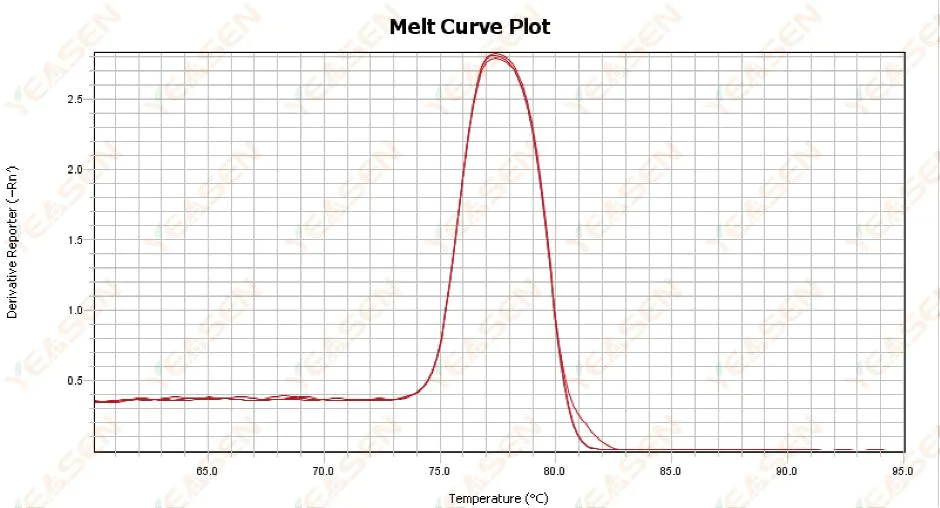
Gambar 13. Plot Kurva Lelehan
Kemungkinan penyebabnya:
1) Hal ini terkait dengan komposisi reagen dan model instrumen.
2) Adanya amplifikasi non-spesifik dari fragmen berukuran sama.
Solusi:
1) Rentang suhu dari awal hingga akhir puncak tidak lebih tinggi dari 7°C. Hasilnya dianggap dapat digunakan, yaitu puncak tunggal.
2) Elektroforesis agarosa konsentrasi tinggi (misalnya agarosa 3%) dilakukan untuk membantu penentuan.
3.2 Kurva leleh memiliki dua puncak dan puncak bawah Tm berada sebelum 80°C
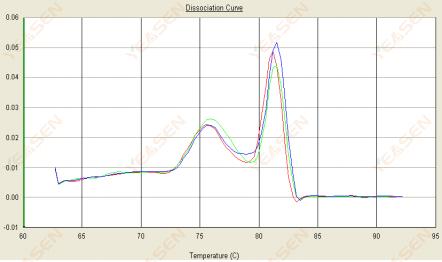
Gambar 14. Kurva Disosiasi
Kemungkinan penyebabnya:
Kehadiran dimer primer.
Solusi:
Meningkatkan suhu annealing, mengurangi konsentrasi primer, atau mendesain ulang primer.
3.3 Kurva leleh memiliki dua puncak dan puncak bawah Tm setelah 80°C
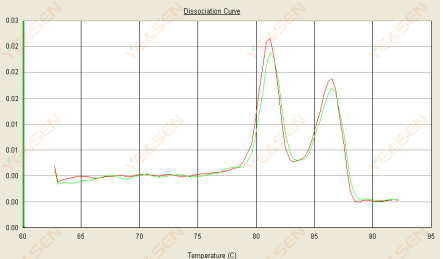
Gambar 15. Kurva Disosiasi
Kemungkinan penyebabnya:
1) Spesifisitas primer yang buruk menyebabkan amplifikasi produk yang tidak spesifik.
2) Kontaminasi gDNA.
Solusi:
1) Spesifisitas primer pemeriksaan ledakan, desain ulang jika buruk.
2) Konfirmasi oleh kontrol negatif NRC, jika ada, perlu menyiapkan ulang templat.
3.4 Puncak kurva leleh yang berantakan
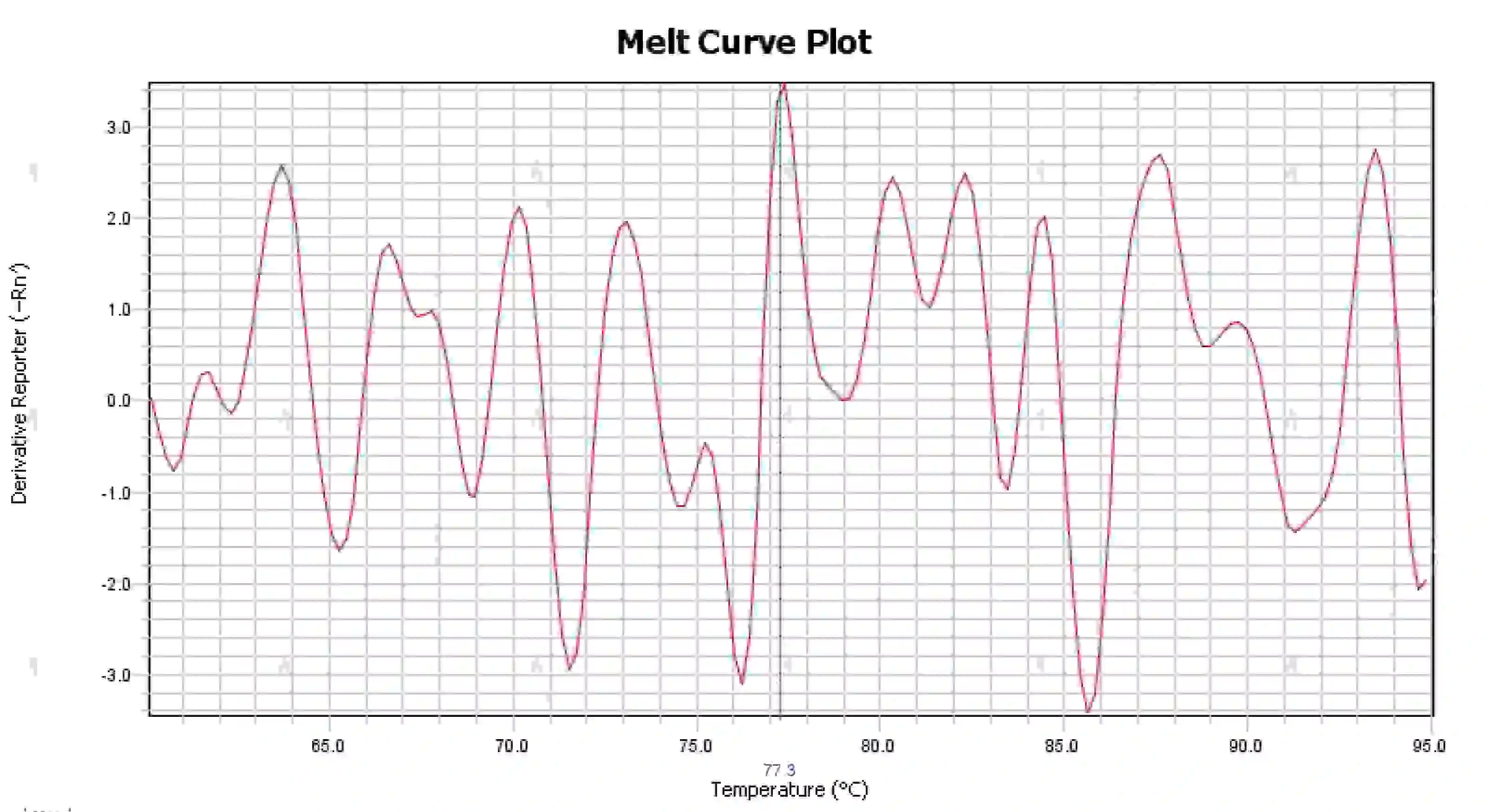
Gambar 16. Plot Kurva Lelehan
Kemungkinan penyebabnya:
1) Kontaminasi sistem reaksi.
2) Pemaparan reagen terhadap cahaya terang atau suhu tinggi menyebabkan kegagalan reagen.
3) Instrumen tersebut belum dikalibrasi selama waktu yang lama.
4) Ketidaksesuaian antara bahan habis pakai dan instrumen.
Solusi:
1) Menggabungkan hasil NTC dan NRC untuk mengonfirmasi kontaminasi, direkomendasikan untuk mengecualikan kontaminasi dari air, primer, enzim, dan lingkungan satu per satu.
2) Disarankan untuk melakukan percobaan perbandingan dengan reagen baru.
3) Disarankan untuk melakukan pemeliharaan kalibrasi instrumen secara teratur.
4) Konfirmasikan persyaratan instrumen terkait untuk bahan habis pakai.
3.5 Puncak palsu di ujung depan kurva leleh
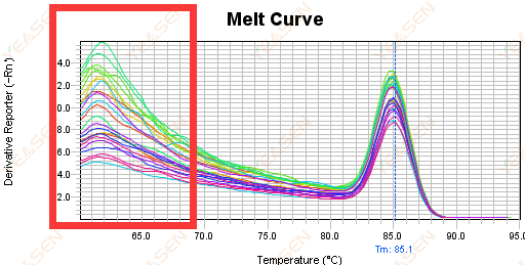
Gambar 17. Plot Kurva Lelehan
Kemungkinan penyebabnya:
Konsentrasi Rox tidak sesuai dengan model.
Solusi:
Disarankan untuk membatalkan koreksi Rox untuk melihat apakah kurva lelehnya normal.
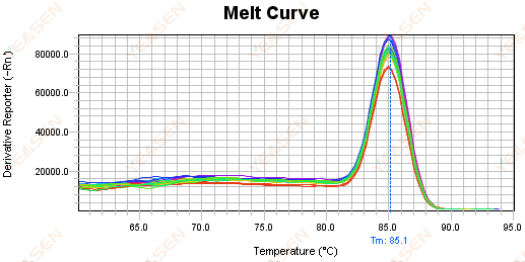
Gambar 18. Plot Kurva Lelehan
4. Informasi Pemesanan
Tabel 1. Informasi Pemesanan
| Nama Produk | Kode Produk | Spesifikasi |
| Campuran Master qPCR Hieff Unicon™ Universal Blue (Berbasis Pewarna) | 11184ES03 | 1 ml |
| 11184ES08 | ukuran 5x1 ml | |
| 11184ES50 | 50x1ml | |
| 11184ES60 | 100x1ml |
5. Produk Terkait
Produk yang disediakan oleh
Tabel 2. Produk Terkait
| Penempatan Produk | Nama Produk | Kode Produk |
| Penghapusan gDNA satu langkah dan transkripsi balik | Pencernaan RT-gDNA satu langkah Hifair™V SuperMix untuk qPCR (Pertanyaan) | 11142ES |
| Campuran Master Sensitivitas Tinggi (dengan langkah penghapusan gDNA) | Sintesis cDNA untai pertama Hifair™ III SuperMix untuk qPCR (pencerna gDNA plus) | 11141ES |
| Kit Sensitivitas Tinggi (dengan langkah penghilangan gDNA) | Kit Sintesis cDNA Untai Pertama Hifair™ III (pencerna gDNA plus) (Pertanyaan) | 11139ES |
| Campuran induk kuantitatif biasa (metode probe) | Campuran Master Probe TaqMan Hieff™ qPCR (Pertanyaan) | 11205ES |
6. Mengenai membaca
DNase I dan Aplikasinya dalam Biomedis
Pedoman Seleksi Transkriptase Terbalik
