
Konsep dan Kebutuhan Deteksi HCP
Produk biologis biasanya diproduksi menggunakan teknologi rekombinan dalam sel inang (seperti bakteri, ragi, mamalia, serangga, atau sel tumbuhan), termasuk antibodi monoklonal, protein rekombinan, dan vaksin. Proses pembuatan dan pemurnian produk ini pasti akan memasukkan protein sel inang (HCP) sebagai pengotor, yang meliputi protein struktural sel inang dan faktor pertumbuhan yang disekresikan oleh sel inang, membentuk campuran kompleks dengan berbagai sifat fisikokimia dan imunologi. Meskipun menggunakan teknik pemurnian tingkat lanjut, beberapa protein sel inang mungkin masih tetap menjadi pengotor terkait proses dalam produk obat antara.
Kotoran ini memiliki potensi imunogenisitas dan dapat meningkatkan respons imunogenik produk biofarmasi, yang memengaruhi stabilitas dan kemanjurannya, sehingga menimbulkan risiko terhadap keselamatan manusia. Oleh karena itu, strategi pemantauan yang tepat untuk menghilangkan HCP perlu ditetapkan, dan kandungan HCP dalam produk akhir perlu dikontrol untuk memenuhi persyaratan kualitas obat.
Persyaratan Peraturan untuk HCP
Kandungan residu HCP dalam produk biologis secara umum dianggap sebagai atribut kualitas kritis (CQA) produk, indeks evaluasi penting untuk pemantauan ketahanan proses, dan indeks kendali mutu utama produk. Otoritas regulasi di berbagai negara memiliki ketentuan mengenai HCP, yang mengharuskan analisis dan pemurnian biofarmasi untuk mengurangi HCP protein sel inang ke tingkat yang dapat diterima. Tingkat penerimaan HCP akan dinilai berdasarkan keadaan tertentu dan bergantung pada beberapa faktor, termasuk dosis, frekuensi pemberian dosis, jenis obat, dan tingkat keparahan penyakit.
Farmakope Cina (edisi 2020) menetapkan: Untuk sel CHO, HCP residu harus <0,05% (setara dengan kurang dari 500 ppm); untuk E. coli, HCP residu harus <0,01%.
Bab Farmakope Amerika Serikat USP <1132> menetapkan: Metode yang sangat sensitif harus digunakan untuk mendeteksi HCP dalam obat-obatan, dan kandungannya harus di bawah batas deteksi (biasanya kurang dari 100 ppm, yaitu, kandungan HCP dalam 1 mg protein total harus kurang dari 100 ng, atau <0,01%).
Farmakope Eropa EP 2.6.34 menetapkan: Dalam produk biologis, kandungan HCP harus kurang dari 0,1%.
Pedoman Konferensi Internasional tentang Harmonisasi Persyaratan Teknis untuk Pendaftaran Obat untuk Penggunaan Manusia (ICH): ICH Q6B menyatakan bahwa metode yang sensitif dan tervalidasi harus diadopsi untuk memantau HCP residu, dengan jumlah residu yang biasanya diharuskan kurang dari 100 ppm.
Dapat dilihat bahwa badan regulasi memiliki persyaratan yang sangat konsisten untuk HCP. Pengembangan proses produk biologis harus menjalani deteksi HCP, menunjukkan bahwa proses pemurnian dapat mengurangi HCP ke tingkat yang aman, dan batas yang direkomendasikan untuk kandungan residu dalam produk akhir berada di bawah 0,01% di Tiongkok dan Amerika Serikat.
Metode Deteksi HCP
Enzyme-Linked Immunosorbent Assay (ELISA) saat ini merupakan metode yang paling umum digunakan untuk mendeteksi HCP. Metode deteksi residu protein inang yang disebutkan dalam Bab 3412/3413/3414 dari Chinese Pharmacopoeia edisi 2020 semuanya merupakan metode ELISA.
Bab Farmakope Amerika Serikat USP <1132> juga menyebutkan bahwa metode seperti elektroforesis, ELISA, dan LC-MS/MS dapat digunakan untuk mendeteksi kandungan HCP, dan ELISA direkomendasikan sebagai metode pilihan untuk deteksi HCP karena kemudahan pengoperasian, kecepatan, sensitivitas tinggi, dan throughput tinggi.
Tes ELISA:
Tujuan: Mendeteksi jumlah total protein dalam HCP, dapat digunakan untuk pengembangan produk dan pengendalian proses, dan saat ini merupakan metode umum untuk mendeteksi HCP.
Keuntungan: Sensitivitas dan spesifisitas tinggi; Kemampuan throughput dan otomatisasi tinggi; Kuantitatif; Pengoperasian mudah dan cepat.
Kekurangan: Memerlukan antibodi yang spesifik; Tidak dapat secara spesifik mengidentifikasi dan mengevaluasi HCP individu; Pengembangan metode rumit, memerlukan persiapan antigen khusus; Banyak faktor yang memengaruhi metode, cakupan HCP perlu dievaluasi; Tidak dapat mengidentifikasi spesies.

Western Blotting:
Tujuan: Digunakan untuk penyaringan yang konsisten terhadap sejumlah besar sampel dan mendeteksi protein yang tidak diketahui yang bereaksi dengan antibodi anti-HCP. Cocok untuk mendeteksi HCP dan memberikan informasi perkiraan tentang berat molekul relatif HCP.
Keuntungan: Spesifisitas; Hasilnya intuitif secara visual: memvisualisasikan perbedaan dalam ukuran protein dan tingkat ekspresi; Dapat mendeteksi dan mengukur HCP tertentu.
Kekurangan: Semi-kuantitatif; Terbatas pada protein tertentu: hanya dapat mendeteksi HCP yang terikat pada antibodi; Tidak cukup sensitif untuk campuran protein kompleks; Denaturasi protein SDS dapat menyebabkan hilangnya epitop konformasi; Sensitivitas tergantung pada kualitas antibodi poliklonal.
Elektroforesis Gel Dua Dimensi (2-DE):

Tujuan: Umumnya digunakan untuk pengembangan dan karakterisasi proses hulu atau hilir, dapat membedakan HCP yang berbeda pada gel tunggal.
Keuntungan: Tidak perlu Western blotting, menghindari masalah transfer; Dapat memisahkan sejumlah kecil pengotor HCP dari produk; Menyediakan informasi perkiraan tentang berat molekul relatif dan titik isoelektrik.
Kekurangan: Protein yang berlebihan dapat menutupi bintik HCP; Distribusi HCP dalam sampel dapat diamati, tetapi tidak dapat diukur.

Analisis Spektrometri Massa:
Tujuan: Mengidentifikasi HCP individual, menyediakan informasi identifikasi dan kuantifikasi yang akurat untuk protein sel inang.
Keuntungan: Resolusi dan akurasi tinggi; Mengidentifikasi dan memantau HCP individual; Menyediakan spektrum HCP yang komprehensif; Dapat mencakup berbagai macam protein; Dapat mengidentifikasi spesies HCP.
Kekurangan: Persyaratan peralatan dan teknis tinggi; Operasi kompleks; Biaya tinggi; Throughput metode rendah; Pra-perlakuan sampel kompleks; Potensi efek matriks; Memerlukan kemampuan analisis data khusus.
ELISA merupakan metode yang direkomendasikan oleh farmakope di berbagai negara untuk mendeteksi residu HCP dalam produk biologi, yang mampu menentukan jumlah total HCP. Akan tetapi, metode ini memiliki keterbatasan dalam mengidentifikasi jenis dan kelimpahan HCP dan perlu dilengkapi dengan metode lain. Setiap metode deteksi memiliki kelebihan dan kekurangannya sendiri, dan dalam aplikasi praktis, pemilihan dapat dilakukan berdasarkan tujuan eksperimen, karakteristik sampel, akurasi, dan kemudahan operasional, di antara faktor-faktor lainnya, dikombinasikan dengan penggunaan metode yang berbeda untuk memperoleh hasil yang lebih komprehensif dan akurat.
Selain itu, United States Pharmacopeia USP <1132> dan European Pharmacopoeia EP 2.6.34. HOST-CELL PROTEIN ASSAYS menunjukkan bahwa reagen ELISA yang berbeda harus digunakan untuk deteksi HCP pada berbagai tahap pengembangan produk, mengkategorikan metode deteksi HCP menjadi reagen komersial, metode khusus produk/proses, dan metode platform.
USP <1132> menyebutkan bahwa jika tidak ada metode platform, reagen komersial dapat digunakan dalam uji klinis praklinis, Fase I, dan Fase II; dalam uji klinis Fase III/validasi proses dan produk pasca-pemasaran, karena keterbatasan seperti cakupan antibodi yang tidak memadai dari reagen deteksi HCP umum komersial, pertimbangan harus diberikan pada faktor-faktor seperti jenis sel dan spesifisitas proses, menggunakan metode platform atau metode khusus produk/proses untuk pengembangan proses hulu.
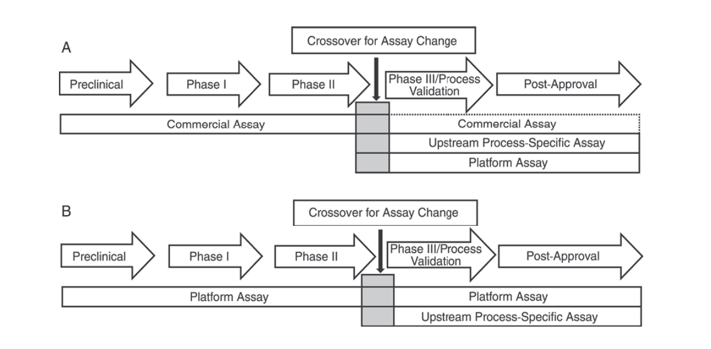
Gambar 1. Dalam USP <1132>, berbagai tahap pengembangan produk disarankan untuk menggunakan metode khusus untuk mendeteksi HCP.
| Metode | Kit Reagen Komersial | Deteksi Spesifik Produk/Proses Peralatan | Deteksi Platform Peralatan |
| Tersedianya | Tersedia secara mudah
| Memerlukan persiapan antigen, termasuk kloning garis sel inang
| Memerlukan persiapan antigen menggunakan garis sel vektor telanjang atau kosong
|
| Perkembangan | Membutuhkan persiapan minimal | Pengembangan deteksi termasuk karakterisasi antigen, imunisasi, dan konfirmasi biasanya memakan waktu setidaknya 6 bulan | Pengembangan deteksi termasuk karakterisasi antigen, imunisasi, dan konfirmasi biasanya memakan waktu setidaknya 9 bulan |
| Keberagaman | Terbatas pada sistem ekspresi yang paling umum | Berbagai jenis sistem ekspresi dapat digunakan | Berbagai jenis sistem ekspresi dapat digunakan |
| Kekhususan | Spesifisitas mungkin buruk, dengan potensi HCP yang tidak terdeteksi
| Spesifisitas biasanya ditingkatkan, dengan cakupan antibodi yang menargetkan pola HCP tertentu | Dibandingkan dengan metode deteksi komersial, spesifisitas ditingkatkan, pemahaman kinerja deteksi ditingkatkan, dan cakupan jenis HCP juga meningkat |
| Biaya | Harga awal relatif murah, tetapi biaya pengembangan akan cepat naik untuk seluruh proses pemurnian hilir | Biaya awal memang lebih tinggi, namun titik impas biasanya berada pada nilai 100 set kit reagen | Karena dapat diaplikasikan pada banyak produk, maka memiliki keuntungan biaya yang signifikan |
| Ketergantungan | Bergantung pada pemasok tertentu, reagen, dan skema kontrol berada dalam status "kotak hitam". | Memiliki kontrol komprehensif atas semua reagen dan buffer, dapat disesuaikan kapan saja | Memiliki kepemilikan dan kontrol penuh atas semua reagen, mengurangi risiko dalam rantai pasokan dan perbandingan batch |
| Persyaratan Peraturan | Tidak cocok untuk mendukung pemasaran aplikasi otorisasi | Berlaku untuk mendukung seluruh proses dari pengembangan awal hingga pemasaran produk berlisensi | Berlaku untuk mendukung pengembangan awal hingga otorisasi pemasaran |
Tabel 1.Perbandingan Berbagai Jenis Kit Reagen HCP
Yeasen Layanan Pengembangan Pengujian HCP yang Disesuaikan untuk Bioteknologi
Mengingat pentingnya deteksi HCP,
Garis Waktu Kustomisasi
Layanan kustomisasi untuk kit deteksi protein residu sel inang biasanya memakan waktu 6 hingga 10 bulan.
Persiapan Antigen-Antibodi: Menentukan antigen HCP, menetapkan standar referensi HCP, merancang jalur dan strategi imun, menyiapkan antibodi HCP, dll., biasanya memakan waktu 4 hingga 6 bulan.
Pengembangan Kit Pengujian: Optimalisasi antibodi, analisis cakupan, validasi metode kit pengujian, dll., biasanya memerlukan waktu 2 hingga 4 bulan.
Yeasen Layanan Verifikasi Cakupan Antibodi HCP Bioteknologi
Diketahui bahwa ELISA merupakan standar emas untuk mendeteksi residu HCP dalam industri, tetapi keakuratan metode ini bergantung pada cakupan antibodi multi-klon terhadap HCP. United States Pharmacopeia dan European Pharmacopeia menyebutkan imunopurifikasi dan 2D-WB sebagai metode yang direkomendasikan untuk mengkarakterisasi antibodi ELISA HCP dan cakupannya.
Cakupan Antibodi HCP Verifikasi Melayani
2D-WB pertama-tama memisahkan protein berdasarkan ukuran dan muatan menggunakan elektroforesis gel dua dimensi, kemudian mentransfer protein ini ke membran untuk inkubasi dengan antibodi HCP untuk deteksi jejak protein.
Kami memiliki perangkat lengkap instrumentasi 2D-WB dan pengalaman laboratorium yang luas untuk menyediakan layanan verifikasi cakupan antibodi untuk sampel HCP dari sel inang seperti CHO, E.coli, HEK293, dll.
Produk Terkait:
| Produk | Nomor Katalog. | Ukuran |
| 36712ES | Ukuran 48T/96T | |
| 36713ES | Ukuran 48T/96T | |
| Kit ELISA CHO HCP (CHO-K1) | 36714ES | Ukuran 48T/96T |
| Kit ELISA HCP E.coli (Plasmid) | 36721ES | Ukuran 48T/96T |
