In vivo beeldvormingstechnologie "detectie" zorgt ervoor dat "onderhuidse" cellen zich nergens kunnen verstoppen
Wilt u de tumorgroei in naakte muizen in realtime controleren? Wilt u de locatie van celkolonisatie in muizen weten? Wilt u het effect van medicamenteuze behandeling op tumoren weten? in levenden lijve? Dit kan worden bereikt door een tracker op de cel te installeren, waarmee u op elk gewenst moment de locatie en het aantal cellen kunt bepalen. Deze technologie is in vivo imaging "detectie" technologie. Dus wat is in vivo imaging technologie?
1. Wat is in vivo beeldvormingstechnologie?
2. Kenmerken van luciferase-beeldvorming
3. Toepassingsrichting van luciferase-beeldvorming
4. Experimenteel voorbeeld delen
5. Veelgestelde vragen
6. Productinformatie
7. Over het lezen
1. Wat is in vivo beeldvormingstechnologie?
Al in 1999 stelde Dr. Weissleder van Harvard University in de Verenigde Staten het concept van moleculaire beeldvorming voor, dat wil zeggen het gebruik van beeldvormingsmethoden om kwalitatief en kwantitatief onderzoek te doen naar biologische processen in vivo op cellulair en moleculair niveau. In vivo-beeldvorming is gebaseerd op moleculaire beeldvorming. Via dit beeldvormingssysteem kunnen biologische processen zoals tumorgroei en metastasering, de ontwikkeling van infectieziekten en de expressie van specifieke genen worden waargenomen bij levende dieren.
In vivo worden bij optische beeldvorming van levende dieren voornamelijk twee technologieën gebruikt: bioluminescentie en fluorescentie. Bioluminescentie is het luciferasegen om cellen of DNA te markeren, terwijl fluorescentietechnologie gebruikmaakt van fluorescerende reportergenen zoals groen fluorescerend eiwit en rood fluorescerend eiwit en fluorescentie zoals FITC, Cy5 en Cy7. Elementen en kwantumdots (QD) voor labeling. Zoogdierbioluminescentie integreert over het algemeen het vuurvliegluciferasegen (samengesteld uit 554 nucleotiden, ongeveer 50KD), dat wil zeggen het luciferasegen, in het chromosomale DNA van de verwachte observatiecel om luciferase tot expressie te brengen. Kweek vervolgens een cellijn die luciferase stabiel tot expressie kan brengen, en wanneer de cellen zich delen, differentiëren en overdragen, zal de luciferase ook stabiel tot expressie blijven komen. Genen, cellen en levende dieren kunnen allemaal worden getagd met het luciferasegen. Luciferase is een soort enzym dat substraten kan katalyseren om bioluminescentie te produceren. Luciferasen van verschillende bronnen hebben hun eigen kenmerken en kunnen substraten katalyseren om verschillende kleuren licht uit te zenden. Onder hen heeft vuurvliegluciferase een hoge gevoeligheid en een breed lineair bereik van 7~8 ordes van grootte. Het is het meest gebruikte reportergen voor zoogdiercellen geworden. Het luciferase-reporterplasmide werd overgebracht naar de cellen en het substraat luciferine werd toegevoegd om de cellen te incuberen. In aanwezigheid van ATP, O2, en magnesiumionen, luciferase zou het luciferinesubstraat kunnen oxideren om een zichtbare lichtreactie te produceren. Realiseer "eenmalige 'tracker'-installatie, en volg en detecteer op elk gewenst moment". Naast vuurvliegluciferase wordt soms ook renillaluciferase gebruikt. De substraten van de twee zijn verschillend, het substraat van de eerste is D-luciferine en het substraat van de laatste is coelenterazine. De lichtuitstralende golflengten van de twee zijn verschillend, het bereik van de lichtgolflengte die door de eerste wordt uitgezonden is 540-600 nm en het bereik van de lichtgolflengte die door de laatste wordt uitgezonden is 460-540 nm. Het licht dat door de eerste wordt uitgezonden, passeert gemakkelijker door weefsels, terwijl de laatste sneller in het lichaam wordt gemetaboliseerd en de specificiteit ervan niet zo goed is als de eerste. Daarom gebruiken de meeste in vivo-experimenten vuurvliegluciferase niet als reportergen.
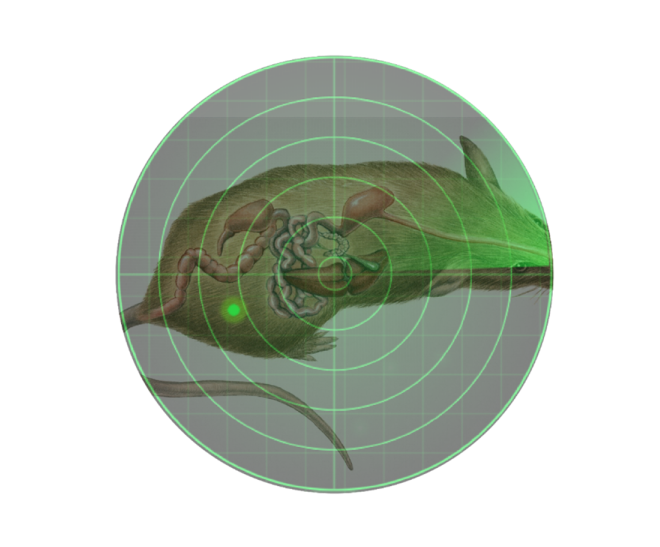
Figuur 1.Lokalisatie van luciferase-gelabelde cellen
Het optische principe van bioluminescentie: licht wordt verstrooid en geabsorbeerd wanneer het zich voortplant in zoogdierweefsels, en fotonen worden gebroken wanneer ze celmembraan en cytoplasma tegenkomen, en verschillende soorten cellen en weefsels hebben verschillende kenmerken van het absorberen van fotonen. Hemoglobine is de belangrijkste oorzaak van de absorptie van zichtbaar licht in het lichaam en kan het grootste deel van de blauwgroene band van zichtbaar licht absorberen. Maar in de rode lichtband van zichtbaar licht groter dan 600 nm is de absorptie van hemoglobine erg klein. Daarom kan een grote hoeveelheid licht door weefsel en huid gaan om te worden gedetecteerd in het roodachtige gebied. Ten minste een paar honderd subcutane cellen kunnen worden gedetecteerd met behulp van levende dierlijke bioluminescentiebeeldvormingstechnologie. Afhankelijk van de diepte van de lichtbron in de muis varieert het minimale aantal cellen dat kan worden gezien echter. Over het algemeen geldt dat voor elke toename van 1 cm de lichtsterkte 10 keer afneemt, en de afzwakking is groter voor weefsels en organen die rijk zijn aan bloed, en kleiner voor weefsels en organen die grenzen aan botten. In het geval van dezelfde diepte heeft de gedetecteerde lichtsterkte een significante lineaire relatie met het aantal cellen, en de gedetecteerde lichtsterkte kan door het instrument worden gekwantificeerd om het aantal cellen weer te geven.
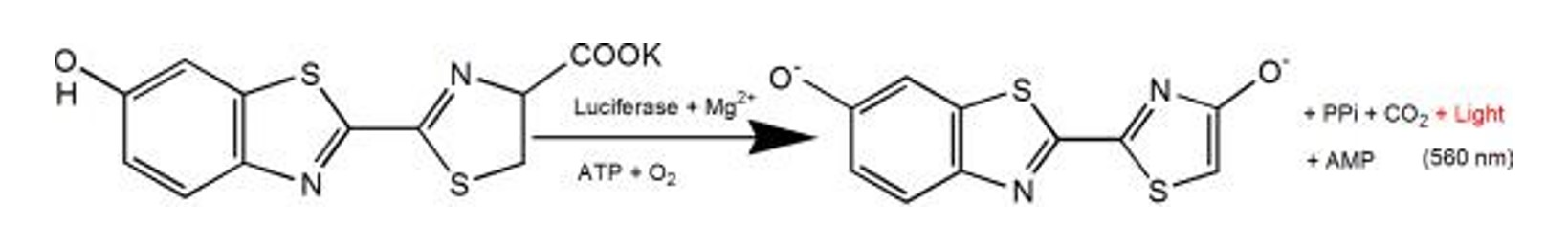
Figuur 2. Het luminescentieprincipe van de luciferase- en luciferine-kaliumzoutreactie
Anders dan bioluminescentie gebruikt fluorescentietechnologie fluorescerende reportergenen of fluorescerende kleurstoffen (inclusief nieuwe nano-labelmaterialen zoals fluorescerende kwantumdots) voor labeling. Met behulp van fluorescentie van reportergenen, fluorescerende eiwitten of kleurstoffen kan een biologische lichtbron in vivo worden gecreëerd. Bioluminescentie is autofluorescentie bij dieren zonder een excitatielichtbron, terwijl fluorescentie excitatie door een externe excitatielichtbron vereist voordat het kan worden gedetecteerd door het beeldvormingssysteem. Fluorescerende labels worden veel gebruikt, waaronder dieren, cellen, micro-organismen, antilichamen, medicijnen, nanomaterialen, enz.
2. Kenmerken van luciferase-beeldvorming
◎ geen straling, vrijwel onschadelijk voor organismen.
◎ bioluminescentie zonder exciterende lichtbron.
◎ Hoge gevoeligheid, honderden cellen kunnen worden gedetecteerd.
◎ goede penetratie, 3-4 cm weefseldiepte kan nog worden gedetecteerd.
◎ hoge signaal-ruisverhouding, sterk fluorescentiesignaal en goede anti-interferentie.
3. Toepassingsrichting van luciferase-beeldvorming
3.1 Tumorgroei
Bij het tumorigenese-experiment bij naakte muizen werd de tumorgroei in realtime waargenomen, zonder invasie. Het was niet nodig om de tumor te strippen voor de meting.
3.2 Oncologische medicijnen
De invloed van de toediening op de tumorgroei of metastasering werd gedetecteerd en het fluoresceïnesubstraat kon binnen 3 uur worden verwijderd, zonder dat het medicijnexperiment werd verstoord.
3.3 Cellokalisatie
De lokalisatie en distributie van vreemde cellen bij dieren werden gedetecteerd.
3.4 Regulatie van genexpressie
Het doelgen of de promotor van het doelgen werd gefuseerd met het luciferasegen om veranderingen in de genexpressie te detecteren tijdens de medicamenteuze behandeling of het verloop van de ziekte.
3.5 Stamcelonderzoek
Monitoring van de transplantatie, overleving en proliferatie van stamcellen; Traceren van de distributie en migratie van stamcellen in levenden lijve.
4. Experiment voorbeeld delen

Figuur 3. in levenden lijve beeldvormingsdetectie van het therapeutische effect van CAR-MUC1 T/AUTO-MUC1-IL22 T-cellen op tumorvorming door subcutane injectie van HN4-cellen in muizen[1].
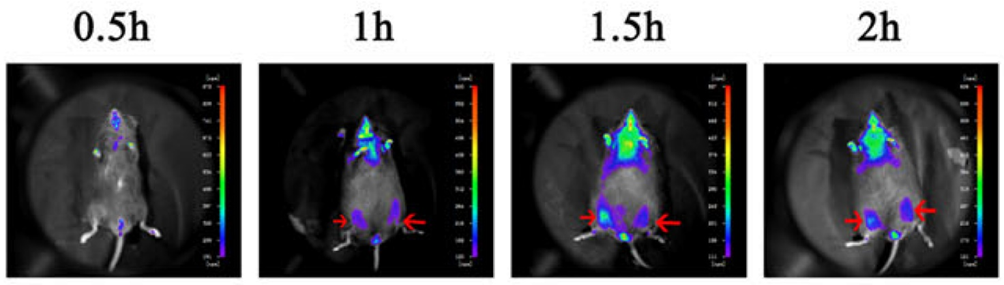
Figuur 4. Nadat HUC-MSC-cellen in de skeletspier van muizen waren geïnjecteerd, werd de lokalisatie van de cellen gedetecteerd door in levenden lijve beeldvorming (gemarkeerd met rode pijl)[2].
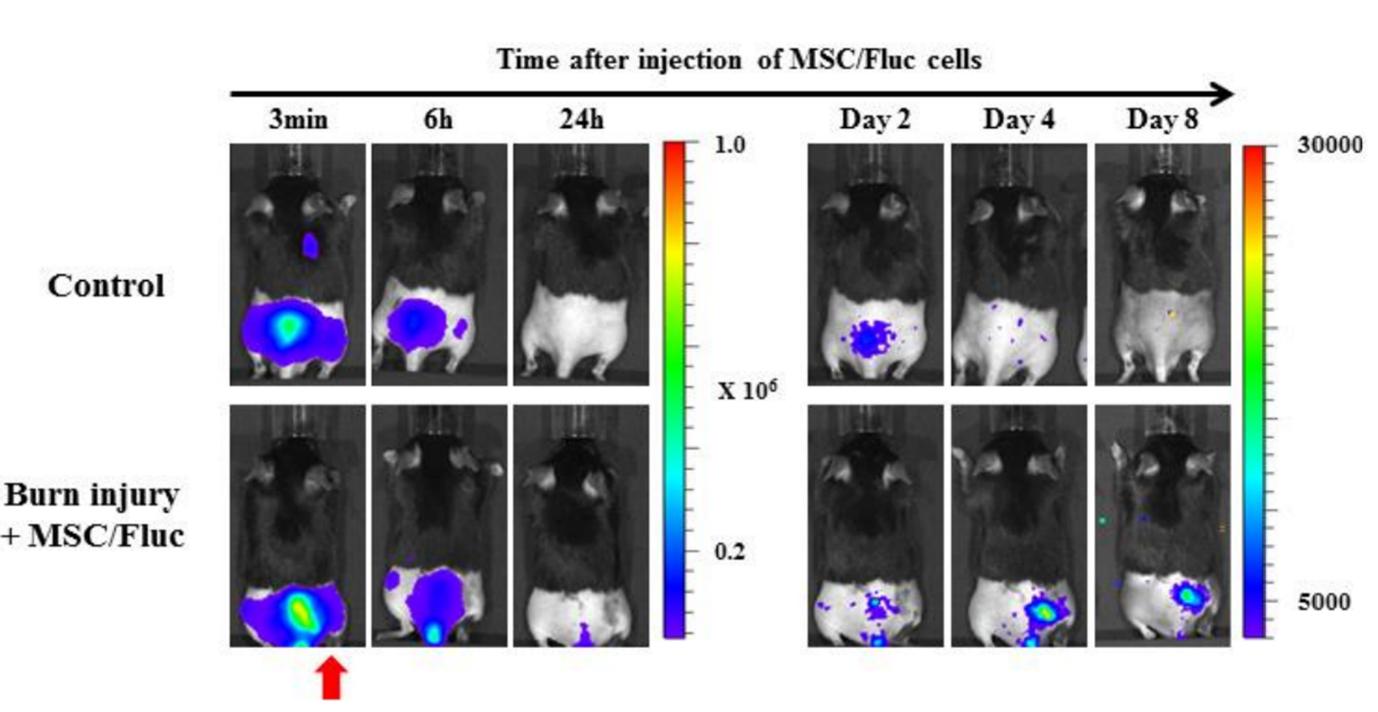
Figuur 5. Het vermogen van in levenden lijve beeldvorming om de migratie van mesenchymale stamcellen (MSC) naar brandwondenplekken te detecteren. Mesenchymale stamcellen (MSC/FLuc) werden intraveneus geïnjecteerd in het muizenmodel van de rugbrandwond. Vier dagen na de injectie verschenen bioluminescentiesignalen op de beschadigde plek van de brandwond, en namen daarna geleidelijk af (de rode pijl geeft de brandwondplek aan)[3].
5. Veelgestelde vragen
Vraag 1: Wat zijn de voordelen van bioluminescentie-beeldvormingstechnologie vergeleken met traditionele technologie?
Vergeleken met traditionele technologie is deze technologie gevoeliger dan de traditionele methoden in het onderzoek naar tumormetastasen, gentherapie, epidemiologie, stamceltracering, leukemie en ander gerelateerd onderzoek. Het kan ook snel en intuïtief de pathogenese en medicijnscreening van gerelateerde ziekten bestuderen via een reeks transgene dierlijke ziektemodellen.
Vraag 2: Hoe label je stamcellen met het luciferase-gen?
De constitutief tot expressie gebrachte genen kunnen worden gelabeld om transgene muizen te maken, en de stamcellen worden gelabeld. De hematopoëtische stamcellen worden uit het beenmerg van de muis gehaald en getransplanteerd in het beenmerg van een andere muis. Deze technologie kan worden gebruikt om de proliferatie, differentiatie en migratie van hematopoëtische stamcellen in het lichaam te traceren. Een andere methode is om stamcellen te labelen met lentivirus.
Vraag 3: Hoe lang moet ik testen na een fluoresceïne-injectie en hoe lang kan de luminescentie aanhouden?
Over het algemeen bereikt het fluorescentiesignaal de sterkste stabiele periode na intraperitoneale injectie gedurende 10-15 min en begint het na 20-30 min af te nemen. Na 3 uur is de fluoresceïne geëlimineerd en verdwijnt de luminescentie volledig.
Q4: Hoe injecteer je fluoresceïne in muizen? Wat is het verschil tussen injectiemethoden?
Fluoresceïne kan bij muizen worden geïnjecteerd door intraperitoneale injectie of staartvene-injectie. Het kan zich in ongeveer 1 minuut verspreiden naar het hele lichaam van muizen. In de meeste gevallen is de concentratie fluoresceïne 150 mg/kg. Voor muizen van 20 g kan ongeveer 3 mg fluoresceïne worden gebruikt. Voor intraperitoneale injectie is de diffusie traag, de initiële luminescentie is traag en de continue luminescentietijd is lang. Voor de staartvene-injectie van fluoresceïne diffundeert het snel en begint het snel licht uit te zenden, maar de duur van de luminescentie is kort.
6.Productinformatie
Tabel 1. Productinformatie
| Productinformatie | Productcode | Specificaties |
| D-Luciferine, natriumzout | 40901ES01/02/03/08/10 | 0,1/0,5/1/5/10 gram |
| D-Luciferine, Kaliumzout | 40902ES01/02/03/08 | 0,1/0,5/1/5 gram |
| D-Luciferine Firefly, vrij zuur (Vraag) | 40903ES01/02/03 | 0,1/0,5/1 |
| Coelenterazine h (Vraag) | 40906ES02/03/08 | 0,5/1/5mg |
| Klaar voor gebruik Coelenterazine h (Vraag) | 40907ES10 | 10 flesjes |
| Dubbele Luciferase Reporter Gen Assay Kit (Vraag) | 11402ES60/80 | 100/1000T |
| Luciferase Reporter Gen Assay Kit (Vraag) | 11401ES60/76/80 | 100/500/1000T |
| VDR (vitamine D-receptor) Luciferase-reporterplasmide (Vraag) | 11502ES03 | 1μg |
| STAT1 Luciferase Reporter Plasmide (Vraag) | 11504ES03 | 1μg |
7. Over het lezen
Een nieuwe generatie luciferase-reportergendetectiesystemen: eenvoudiger, gevoeliger en nauwkeuriger
