
Concept en noodzaak van HCP-detectie
Biologische producten worden doorgaans geproduceerd met behulp van recombinante technologie in gastheercellen (zoals bacteriën, gist, zoogdieren, insecten of plantencellen), waaronder monoklonale antilichamen, recombinante eiwitten en vaccins. De productie- en zuiveringsprocessen van deze producten introduceren onvermijdelijk gastheercelproteïnen (HCP's) als onzuiverheden, die zowel structurele eiwitten van de gastheercellen als groeifactoren omvatten die door de gastheercellen worden afgescheiden, waardoor een complex mengsel met verschillende fysicochemische en immunologische eigenschappen ontstaat. Ondanks het gebruik van geavanceerde zuiveringstechnieken kunnen sommige gastheercelproteïnen nog steeds als procesgerelateerde onzuiverheden in tussenproducten van geneesmiddelen achterblijven.
Deze onzuiverheden hebben potentiële immunogeniciteit en kunnen de immunogene respons van biofarmaceutische producten versterken, wat hun stabiliteit en werkzaamheid beïnvloedt en daarmee risico's voor de veiligheid van de mens oplevert. Daarom moeten er geschikte monitoringstrategieën voor het verwijderen van HCP's worden vastgesteld en moet de inhoud van HCP's in het eindproduct worden gecontroleerd om te voldoen aan de vereisten van de kwaliteit van het geneesmiddel.
Regelgevende vereisten voor HCP's
Het restgehalte van HCP's in biologische producten wordt over het algemeen beschouwd als een kritisch kwaliteitskenmerk (CQA) van het product, een belangrijke evaluatie-index voor het bewaken van de robuustheid van het proces en een belangrijke kwaliteitscontrole-index van het product. Regelgevende instanties in verschillende landen hebben bepalingen met betrekking tot HCP's, die analyse en zuivering van biofarmaceutica vereisen om gastheercelproteïne-HCP's tot aanvaardbare niveaus te reduceren. Het acceptatieniveau van HCP's wordt beoordeeld op basis van specifieke omstandigheden en is afhankelijk van verschillende factoren, waaronder dosis, doseringsfrequentie, type geneesmiddel en ernst van de ziekte.
De Chinese Farmacopee (editie 2020) bepaalt: Voor CHO-cellen moet het resterende HCP <0,05% zijn (gelijk aan minder dan 500 ppm); voor E. coli moet het resterende HCP <0,01% zijn.
In het hoofdstuk USP <1132> van de United States Pharmacopeia staat het volgende: Er moet een uiterst gevoelige methode worden gebruikt om HCP's in geneesmiddelen te detecteren, en het gehalte moet onder de detectielimiet liggen (meestal minder dan 100 ppm, d.w.z. het HCP-gehalte in 1 mg totaal eiwit moet minder dan 100 ng of <0,01%) zijn.
De Europese Farmacopee EP 2.6.34 specificeert: In biologische producten moet het gehalte aan HCP's minder dan 0,1% bedragen.
De richtlijnen van de Internationale Conferentie over Harmonisatie van Technische Vereisten voor de Registratie van Geneesmiddelen voor Menselijk Gebruik (ICH): ICH Q6B stelt dat gevoelige en gevalideerde methoden moeten worden toegepast om resterende HCP's te bewaken, waarbij de resterende hoeveelheid doorgaans minder dan 100 ppm moet zijn.
Het is te zien dat regelgevende instanties zeer consistente vereisten hebben voor HCP's. De procesontwikkeling van biologische producten moet HCP-detectie ondergaan, aantonen dat het zuiveringsproces HCP's kan reduceren tot veilige niveaus, en de aanbevolen limieten voor restinhoud in het eindproduct liggen onder 0,01% in zowel China als de Verenigde Staten.
HCP-detectiemethoden
Enzyme-Linked Immunosorbent Assay (ELISA) is momenteel de meest gebruikte methode voor HCP-detectie. De methoden voor detectie van host-eiwitresiduen die worden genoemd in hoofdstukken 3412/3413/3414 van de editie 2020 van de Chinese Farmacopee zijn allemaal ELISA-methoden.
In het hoofdstuk USP <1132> van de United States Pharmacopeia wordt ook vermeld dat methoden zoals elektroforese, ELISA en LC-MS/MS kunnen worden gebruikt om HCP-inhoud te detecteren. ELISA wordt aanbevolen als de voorkeursmethode voor HCP-detectie vanwege het gebruiksgemak, de snelheid, de hoge gevoeligheid en de hoge doorvoer.
ELISA-test:
Doel: Detecteert de totale hoeveelheid eiwitten in HCP's, kan worden gebruikt voor productontwikkeling en procescontrole en is momenteel een veelgebruikte methode voor het detecteren van HCP's.
Voordelen: Hoge gevoeligheid en specificiteit; Hoge doorvoer en automatiseringscapaciteit; Kwantitatief; Eenvoudige en snelle bediening.
Nadelen: Vereist specifieke antilichamen; Kan individuele HCP's niet specifiek identificeren en evalueren; Methodeontwikkeling is complex en vereist speciale antigeenbereiding; Veel beïnvloedende factoren voor de methode, HCP-dekking moet worden geëvalueerd; Kan soorten niet identificeren.

Western blotting:
Doel: Wordt gebruikt voor consistente screening van grote aantallen monsters en het detecteren van onbekende eiwitten die reageren met anti-HCP-antilichamen. Geschikt voor het detecteren van HCP's en het verstrekken van benaderende informatie over het relatieve molecuulgewicht van HCP's.
Voordelen: Specificiteit; Resultaten zijn visueel intuïtief: visualiseert verschillen in eiwitgrootte en expressieniveaus; Kan specifieke HCP's detecteren en kwantificeren.
Nadelen: Semi-kwantitatief; Beperkt tot specifieke eiwitten: kan alleen HCP's detecteren die gebonden zijn aan antilichamen; Niet gevoelig genoeg voor complexe eiwitmengsels; Denaturatie van eiwit-SDS kan leiden tot verlies van conformationele epitopen; Gevoeligheid is afhankelijk van de kwaliteit van de polyklonale antilichamen.
Twee-dimensionale gelelektroforese (2-DE):

Doel: Het wordt vaak gebruikt voor de ontwikkeling en karakterisering van upstream- of downstream-processen en kan verschillende HCP's op één gel onderscheiden.
Voordelen: Western blotting is niet nodig, waardoor overdrachtsproblemen worden vermeden. Kan sporen van HCP-verontreinigingen uit het product scheiden. Geeft benaderende informatie over het relatieve molecuulgewicht en het iso-elektrische punt.
Nadelen: Een teveel aan eiwitten kan HCP-vlekken maskeren. De verdeling van HCP's in het monster kan worden waargenomen, maar niet worden gekwantificeerd.

Massaspectrometrie-analyse:
Doel: Identificeert individuele HCP's en biedt nauwkeurige identificatie- en kwantificeringsinformatie voor gastheercelproteïnen.
Voordelen: Hoge resolutie en nauwkeurigheid; Identificeert en bewaakt individuele HCP's; Biedt uitgebreide spectra van HCP's; Kan een breed scala aan eiwitten bestrijken; Kan HCP-soorten identificeren.
Nadelen: Hoge eisen aan de apparatuur en de techniek; Complexe bediening; Hoge kosten; Lage methodedoorvoer; Complexe voorbehandeling van monsters; Mogelijke matrixeffecten; Vereist gespecialiseerde mogelijkheden voor gegevensanalyse.
ELISA is de aanbevolen methode voor het detecteren van rest-HCP's in biologische producten door farmacopees in verschillende landen, die in staat is om de totale hoeveelheid HCP's te bepalen. Het heeft echter beperkingen bij het identificeren van de typen en hoeveelheden HCP's en moet worden aangevuld met andere methoden. Elke detectiemethode heeft zijn voor- en nadelen, en in praktische toepassingen kan de selectie worden gemaakt op basis van experimentele doeleinden, monsterkenmerken, nauwkeurigheid en operationeel gemak, naast andere factoren, gecombineerd met het gebruik van verschillende methoden om uitgebreidere en nauwkeurigere resultaten te verkrijgen.
Bovendien geven de United States Pharmacopeia USP <1132> en de European Pharmacopoeia EP 2.6.34. HOST-CELL PROTEIN ASSAYS aan dat verschillende ELISA-reagentia moeten worden gebruikt voor HCP-detectie in verschillende stadia van productontwikkeling, waarbij HCP-detectiemethoden worden gecategoriseerd in commerciële reagentia, product-/processpecifieke methoden en platformmethoden.
USP <1132> vermeldt dat bij het ontbreken van platformmethoden commerciële reagentia kunnen worden gebruikt in preklinische, fase I- en fase II-klinische onderzoeken; bij fase III-klinische onderzoeken/procesvalidatie en postmarketingproducten moet, vanwege beperkingen zoals onvoldoende antilichaamdekking van commerciële algemene HCP-detectiereagentia, rekening worden gehouden met factoren zoals celtype en processpecificiteit, waarbij platformmethoden of product-/processpecifieke methoden worden gebruikt voor de upstream-procesontwikkeling.
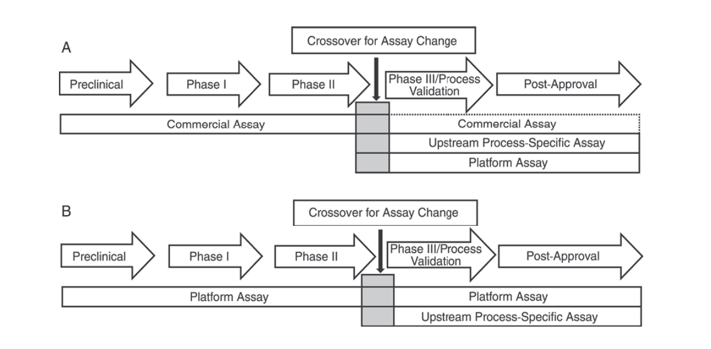
Figuur 1. In de USP <1132> wordt voorgesteld om in verschillende stadia van productontwikkeling specifieke methoden te gebruiken voor het detecteren van HCP's.
| Methode | Commerciële reagenskit | Product-/processpecifieke detectie Uitrusting | Platformdetectie Uitrusting |
| Beschikbaarheid | Gemakkelijk beschikbaar
| Vereist de bereiding van antigenen, inclusief het klonen van gastcellijnen
| Vereist de bereiding van antigenen met behulp van naakte of lege vectorcellijnen
|
| Ontwikkeling | Vereist minimale voorbereiding | De detectieontwikkeling, inclusief antigeenkarakterisering, immunisatie en bevestiging, duurt doorgaans minimaal 6 maanden | De detectieontwikkeling, inclusief antigeenkarakterisering, immunisatie en bevestiging, duurt doorgaans minimaal 9 maanden |
| Diversiteit | Beperkt tot de meest voorkomende expressiesystemen | Er kunnen verschillende soorten expressiesystemen worden gebruikt | Er kunnen verschillende soorten expressiesystemen worden gebruikt |
| Specificiteit | De specificiteit kan slecht zijn, met potentiële onontdekte HCP's
| De specificiteit wordt gewoonlijk verbeterd, met antilichaamdekking gericht op specifieke HCP-patronen | Vergeleken met commerciële detectiemethoden is de specificiteit verbeterd, is het inzicht in de detectieprestaties vergroot en is de dekking van HCP-typen ook vergroot |
| Kosten | De initiële prijzen zijn relatief laag, maar de ontwikkelingskosten zullen snel stijgen voor het gehele verdere zuiveringsproces | De initiële kosten zijn hoger, maar het omslagpunt ligt doorgaans bij de waarde van 100 sets reagenskits | Door de toepasbaarheid op meerdere producten heeft het aanzienlijke kostenvoordelen |
| Afhankelijkheid | Afhankelijk van een specifieke leverancier bevinden reagentia en controleschema's zich in een 'black box'-status. | Heeft uitgebreide controle over alle reagentia en buffers, kan op elk moment worden aangepast | Heeft volledige eigendom en controle over alle reagentia, waardoor risico's in de toeleveringsketen worden verminderd en batchvergelijkbaarheid wordt gewaarborgd |
| Wettelijke vereisten | Niet geschikt voor ondersteunende marketing autorisatieaanvragen | Toepasbaar voor de ondersteuning van het gehele proces, van de vroege ontwikkeling tot de marketing van gelicentieerde producten | Toepasbaar voor ondersteuning van vroege ontwikkeling tot aan vergunning voor het op de markt brengen |
Tabel 1.Vergelijking van verschillende HCP-reagenskittypen
Yeasen Biotech op maat gemaakte HCP-testontwikkelingsservice
Gezien het belang van HCP-detectie,
Tijdlijn voor aanpassing
De maatwerkservice voor detectiekits voor resteiwitten van gastheercellen duurt doorgaans 6 tot 10 maanden.
Bereiding van antigeen-antilichamen: het bepalen van HCP-antigenen, het vaststellen van HCP-referentienormen, het bedenken van immuunpaden en -strategieën, het bereiden van HCP-antilichamen, enz. duurt doorgaans 4 tot 6 maanden.
Ontwikkeling van assaykits: het optimaliseren van antilichamen, het analyseren van de dekking, het valideren van assaykitmethoden, enz. duurt doorgaans 2 tot 4 maanden.
Yeasen Biotech HCP-antilichaamdekkingsverificatieservice
Het is bekend dat ELISA de gouden standaard is voor het detecteren van rest-HCP in de industrie, maar de nauwkeurigheid van deze methode hangt af van de dekking van multi-kloon antilichamen tegen HCP. De United States Pharmacopeia en European Pharmacopeia noemen immunopurificatie en 2D-WB als aanbevolen methoden voor het karakteriseren van HCP ELISA antilichamen en hun dekking.
HCP-antilichaamdekking Verificatie Dienst
Bij 2D-WB worden eiwitten eerst gescheiden op basis van grootte en lading met behulp van tweedimensionale gelelektroforese. Vervolgens worden deze eiwitten overgebracht naar een membraan voor incubatie met HCP-antilichamen voor detectie van de eiwitafdruk.
Wij beschikt over een volledige set 2D-WB-instrumentatie en uitgebreide laboratoriumervaring om verificatieservices voor antilichaamdekking te leveren voor HCP-monsters van gastcellen zoals CHO, E. coli, HEK293, enz.
Gerelateerd product:
| Product | Catalogusnr. | Maat |
| 36712ES | 48T/96T | |
| 36713ES | 48T/96T | |
| CHO HCP ELISA-kit (CHO-K1) | 36714ES | 48T/96T |
| E. coli HCP ELISA-kit (plasmide) | 36721ES | 48T/96T |
