Ceturegel™ Basale Membraan Matrix - Uw eerste keuze
Met de vooruitgang van stamceltherapie en op organoïden gebaseerde medicijnontwikkeling speelt de basaalmembraanmatrix een cruciale rol als voedingsstof en ondersteunende drager voor stamcelculturen en organoïden, 3D-celculturen en andere toepassingen, waaronder angiogenese, in vivo tumorigenese-experimenten, enz. Ceturegel™ basaalmembraanextracten worden geëxtraheerd uit Engelbreth-Holm-Swarm (EHS) muizentumoren die rijk zijn aan extracellulaire matrixproteïnen, waaronder laminine, type IV collageen, nestine, enz. IGF, FGF en andere groeifactoren. Bij kamertemperatuur polymeriseert de Ceturegel™ basaalmembraanmatrix om een biologisch actieve driedimensionale matrix te vormen. Het kan de structuur, samenstelling, fysieke eigenschappen en functies van het celbasaalmembraan in vivo simuleren, wat gunstig is voor de kweek en differentiatie van cellen in vitro en een goed matrigelalternatief is.
1. Wat is Ceturegel™ basaalmembraanmatrix?
2. Wat is de rol van de Ceturegel™ basaalmembraanmatrix?
3. Wat zijn de kenmerken van de Ceturegel™ basaalmembraanmatrix?
4. De populaire toepassing van Ceturegel™ basaalmembraanmatrix
5. Veelgestelde vragen
6. De selectiegids van Ceturegel™ basaalmembraanmatrix van
1. Wat is Ceturegel™ basaalmembraanmatrix?
De matrix grenzend aan endotheelcellen, epitheelcellen, spiercellen en neuronale cellen vormt een continue, gelaagde extracellulaire matrix die het basaalmembraan wordt genoemd. Het basaalmembraan degenereert en regenereert tijdens de ontwikkeling en wondgenezing. Het ondersteunt niet alleen cellen en cellagen, maar speelt ook een belangrijke rol bij de vorming van weefsels door celadhesie, migratie, proliferatie en differentiatie te beïnvloeden, wat functies zijn van het basaalmembraan. Daarom kan worden gezegd dat het basaalmembraan de belangrijkste barrière is tegen de invasie van metastatische tumorcellen.
Figuur 1. De Ceturegel™ basaalmembraanmatrix
De Ceturegel™ basaalmembraanmatrix ontwikkeld en geproduceerd door
2. Wat is de rol van de Ceturegel™ basaalmembraanmatrix?
Ceturegel™ basaalmembraanmatrix kan worden gebruikt om basaalmembraanmatrices van verschillende vereisten te bereiden. Het kan worden gebruikt voor celsignaleringsstudies, zoals de studie van de rol van groeifactoren bij de vorming van nierbuisjes door muizennierstamcellen, de genexpressiestudie van muizenmammaire epitheliale stamcellen en het tumorinvasiviteitsexperiment van Transwell. Tegelijkertijd kan het worden gebruikt voor de studie van celmorfologie, biochemische functie, migratie, infectie en genexpressie. Ceturegel™ basaalmembraanmatrix kan effectief helpen bij de hechting en differentiatie van epitheelcellen en andere soorten cellen, waaronder zenuwcellen, stamcellen, zoogdierepitheelcellen, melanoomcellen, vasculaire endotheelcellen, schildkliercellen en haarfollikelcellen. Tegelijkertijd beïnvloedt Ceturegel™ basaalmembraanmatrix ook het eiwitexpressieniveau van muizenmammaire epitheelcellen en ondersteunt het perifere zenuwregeneratie.

Figuur 2.De belangrijkste toepassingsrichtingen van Ceturegel™ basaalmembraanmatrix
Celmigratie en -invasie in detail: Celmigratie, ook wel celkruipen, beweging of beweging genoemd, verwijst naar de beweging van cellen nadat ze een migratiesignaal hebben ontvangen of een gradiënt van bepaalde stoffen hebben gevoeld. Celmigratie is een afwisselend proces van uitbreiding van pseudopodia in de celkop, vestiging van nieuwe verklevingen en intrekking van de staart van het cellichaam. Celmigratie is een van de basisfuncties van normale cellen en het is ook een fysiologisch proces van normale groei en ontwikkeling van het lichaam. Als een alomtegenwoordige vorm van beweging van levende cellen, kan het deelnemen aan een verscheidenheid aan collectieve fysiologische en pathologische processen. Zoals embryonale ontwikkeling, angiogenese, wondgenezing, immuunreactie, ontstekingsreactie, atherosclerose, kankermetastase, enz. Terwijl celinvasie verwijst naar het vermogen van cellen om van het ene gebied naar het andere te migreren door de extracellulaire matrix. Celinvasie is de reactie van normale cellen en kankercellen op chemische en mechanische stimuli. Celinvasie komt vaak voor tijdens wondgenezingsprocessen, angiogenese, ontstekingen, tumorcelmetastasen en abnormale infiltratie van weefsels.
3. Wat zijn de kenmerken van de Ceturegel™ basaalmembraanmatrix?
Hoge veiligheid: geen LDEV (lactaatdehydrogenase verhoogd virus)
Concentratie diversiteit: het concentratiebereik ligt tussen 8~20 mg/ml
Goede batchstabiliteit: strikt inspectieproces van de productiekwaliteit om stabiele prestaties tussen batches te garanderen
Laag endotoxine: endotoxinegehalte <8 EU/ml
Detectie van besmetting: er zijn geen resten van mycoplasma, bacteriën en schimmels aangetroffen
Hoge output van één batch: de output van een enkele batch ligt boven het niveau van 50L
Verenigbaarheid: Compatibel met elk type celkweekmedium
4. De populaire toepassing van Ceturegel™ basaalmembraanmatrix
4.1 Migratie- en invasietest
De experimentele methode om het vermogen van celmigratie en invasie te detecteren is het Transwell-experiment, en Transwell wordt ook wel het perforatie-experiment genoemd. De celsuspensie wordt eerst aan de kamer toegevoegd omdat de kamer dichte poriën heeft. De kamers werden vervolgens in een 24-wells plaat geplaatst waaraan een compleet medium werd toegevoegd. Cellen vervormden en passeerden gaten in de kamer naar de buitenkant van de meer voedingsrijke kamer, waar ze aan de buitenkant bleven plakken. Door de cellen buiten de kamer te kleuren en te tellen, kan het migratie- en invasievermogen van de cellen worden beoordeeld. Het principe van Transwell is om de kleine kamer in de kweekplaat te plaatsen, de kleine kamer wordt de bovenste kamer genoemd en de kweekplaat wordt de onderste kamer genoemd. De bovenste en onderste lagen van kweekvloeistof worden gescheiden door een polycarbonaatmembraan, de bovenste laag kweekvloeistof wordt toegevoegd aan de bovenste kamer en de onderste laag kweekvloeistof wordt toegevoegd aan de onderste kamer. De cellen bevinden zich in de bovenste kamer en de samenstelling van het onderste medium zal de cellen in de bovenste kamer beïnvloeden vanwege de permeabiliteit van het membraan. Verder werden de effecten van de componenten in het onderste medium op de celgroei en -beweging onderzocht.
Specifieke bewerkingen van de Ceturegel™-basaalmembraanmatrix in migratie- en invasietesten: De verdunde Ceturegel™-basaalmembraanmatrix werd toegevoegd aan de bovenste kamer van de Transwell, en de cellen werden geplateerd en geïncubeerd in een omgeving van 37 °C, 5% CO2 incubator gedurende 24 uur, gefixeerd in 4% paraformaldehyde en gekleurd met 0,1% kristalviolet kleuroplossing. Cellen werden geobserveerd en geteld onder een omgekeerde fasecontrastmicroscoop.
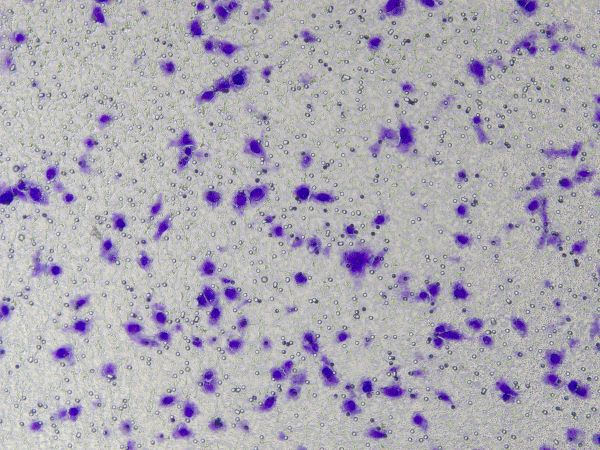
Figuur 3. Resultaten van kristalvioletkleuring na celinvasie
4.2 Angiogenese
1) Haal de Ceturegel™ een dag voor het experiment eruit Haal Matrigel uit de vriezer en laat het een nacht ontdooien in een koelkast van 4°C. Koel ondertussen de gebruikte verbruiksartikelen alvast af.
2) Bewaar Ceturegel™ Matrigel altijd in een koelbox voor het experiment. Open de steriele verpakking van de angiogene slides en haal de slides eruit.
3) Voeg 10 μl Ceturegel™ Matrigel toe aan elke well. Let op dat de pipetpunt loodrecht op de bovenkant van het binnenste gat moet staan bij het toevoegen van Ceturegel™ Matrigel om te voorkomen dat de Matrigel door het bovenste gat stroomt en lijmresten achterlaat.
4) Bedek eerst de glaasje, bereid een petrischaal van 10 cm voor en doe er in water gedrenkte papieren handdoeken in om een natte doos te maken.
5) Doe de slides in de petrischaal en dek de petrischaal af. Doe het in een CO2 incubator, laat het ongeveer 30 minuten staan, wacht tot de gel stolt en bereid tegelijkertijd de celsuspensie.
6) Bereid de verteerde cellen voor in een celsuspensie met een dichtheid van 2*105 cellen/ml en meng grondig.
7) Verwijder het glazen plaatje met het bloedvat dat is gestold tot een gel. Voeg 50 μl van de celsuspensie toe aan elke well, waarbij u ervoor zorgt dat de pipetpunt verticaal boven de bovenste well blijft en de gel in de onderste well niet raakt.
8) Voeg het celkweekmedium toe, sluit het deksel en laat het staan. Na enige tijd zullen alle cellen naar het oppervlak van de Matrigel zinken.
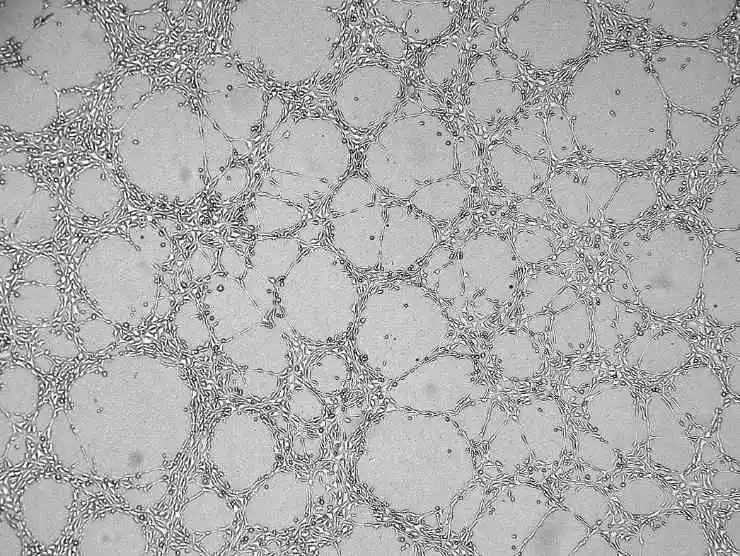
Figuur 4. Grafiek met angiogeneseresultaten
Immunofluorescentiekleuring
1) Verwijder het medium voorzichtig uit de wells zonder de lijm of het celnetwerk aan te raken. Verdun calceïne in serumvrij medium tot een uiteindelijke concentratie van 6–8 µg/ml. Voeg celkleuringsoplossing toe om de cellen volledig onder te dompelen en incubeer bij kamertemperatuur gedurende 30-40 minuten in het donker.
2) Was drie keer met PBS. Let op dat PBS langzaam aan de bovenste putjes moet worden toegevoegd om te voorkomen dat de cellen worden beïnvloed. Fluorescentie-observatie met Ex=485 nm, Em=529 nm golflengte
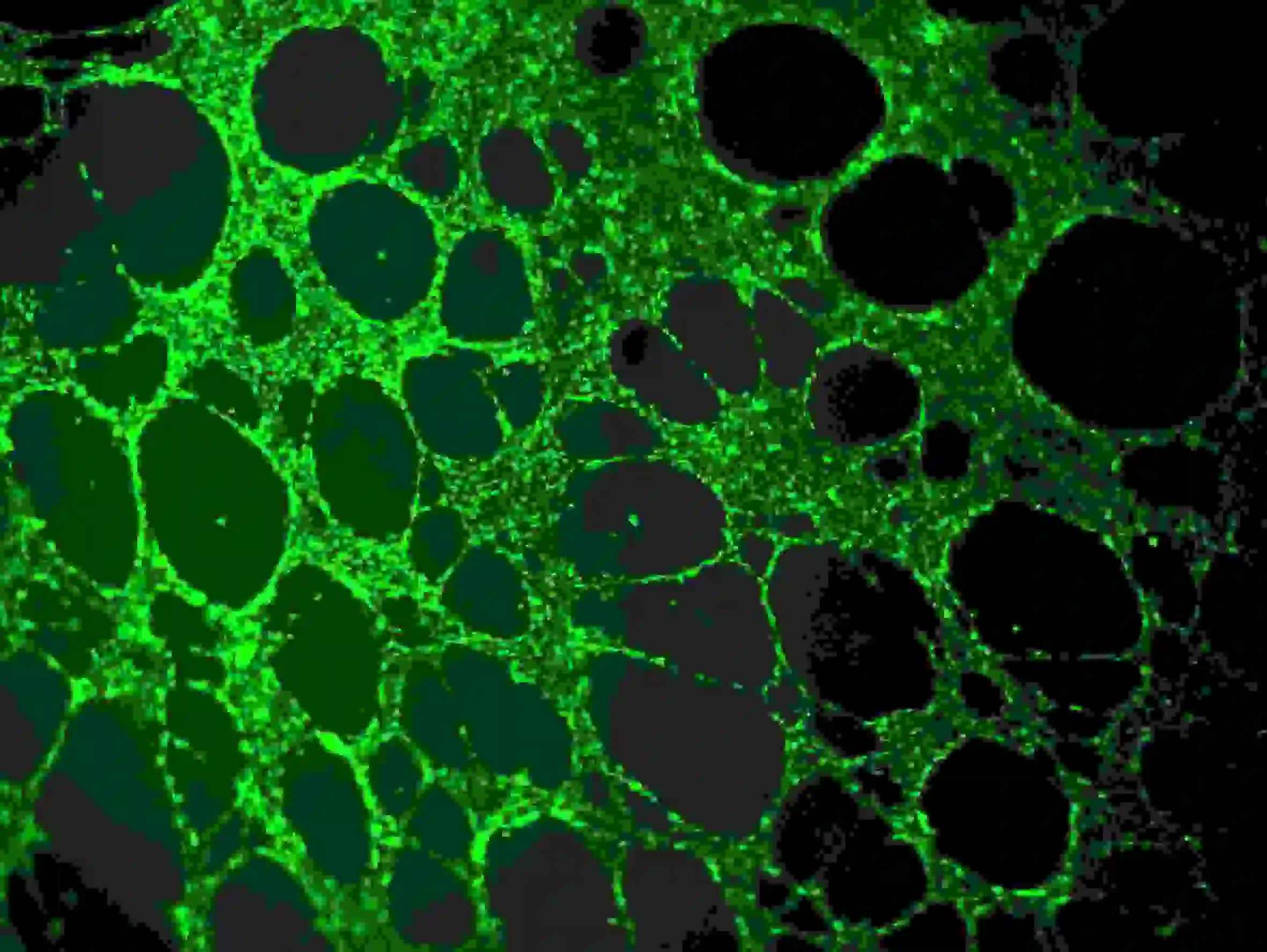
Figuur 5. Immunofluorescentiekleuring van bloedvaten
4.3 3D celcultuur
In tegenstelling tot traditionele celkweek reproduceert 3D-celkweek de in vivo-omgeving van cellen. Zelfs eenvoudige sferoïdemodellen kunnen de tekortkomingen van monolaagculturen compenseren. Deze structuren kunnen gradiënten van zuurstof, voedingsstoffen, metabolieten en oplosbare signalen vormen, die op hun beurt diverse celpopulaties vormen. 3D-celkweektechnologie kan de natuurlijke omgeving waarin cellen in organismen leven beter simuleren, waardoor de interacties tussen cellen en biochemische en fysiologische reacties realistischer worden. In een 3D-omgeving lijken de reacties van cellen op endogene en exogene stimuli meer op hun in vivo-reacties.
De specifieke werking van de Ceturegel™ basaalmembraanmatrix in 3D-celkweek is als volgt: meng de Ceturegel™ basaalmembraanmatrix voorzichtig met de aangepaste concentratie van enkelvoudige cel HepG2-suspensie 1:1 en voeg 50 μl van de hierboven gemengde enkelvoudige celsuspensie toe aan de voorgekoelde 24-wells plaat met een voorgekoelde pipetpunt om boogvormige celdruppels te vormen die werden gekweekt in een incubator van 37 °C, 5% CO2, en elke dag werden geobserveerd en gefotografeerd.
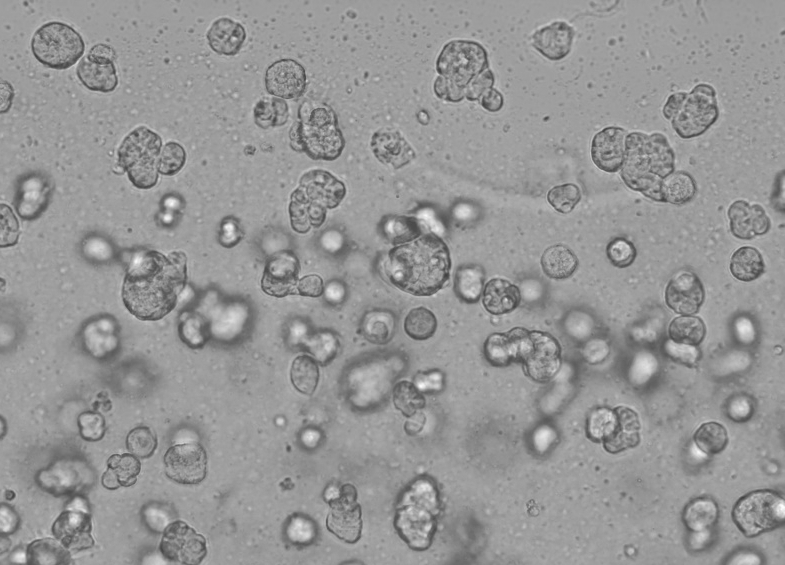
Figuur 6. Resultaten van 3D-celkweek
Tabel 1. 3D-celcultuur Ceturegel™ basaalmembraanmatrix Gebruiksreferentie:
| Cultuurplaat (schaal) type | Celkweekoppervlak (cm2) | Gebruiksdosering (concentratie ≥ 3 mg/ml)* |
|---|---|---|
| 6-wells plaat | 9.6 | 200 μL/cm2 |
| 12-wells plaat | 4.5 | 180 μL/cm2 |
| 24-wells plaat | 2.0 | 180 μL/cm2 |
| 96-wells plaat | 0,32 | 160 μL/cm2 |
| 35mm gerecht | 11.78 | 200 μL/cm2 |
| 100mm gerecht | 58,95 | 200 μL/cm2 |
Let op: Verschillende batches Ceturegel™ basaalmembraanmatrix hebben een bepaald concentratieverschil, de aanbevolen dosering is alleen ter referentie
4.4 Tumorvormingsexperiment in vivo
Met het subcutane tumorigenese-experiment van HepG2-cellen in naakte muizen als voorbeeld, werden Ceturegel™ basaalmembraanmatrix en celsuspensie gebruikt voor 1:1-verdunning, en BALB/c-nu-vrouwtjesmuizen van 4-5 weken oud werden subcutaan geïnoculeerd. Het experimentele proces is als volgt:
♦ Bereid HepG2-cellen voor met logaritmische groei en een celdichtheid van ongeveer 80-90% en ververs het verse medium de avond voordat u de cellen verzamelt.
♦ De cellen worden verteerd door trypsine. Wanneer de cellen rond worden en de kweekschaal niet verlaten, wordt de trypsine verwijderd, wordt het serumvrije medium toegevoegd om de celsuspensie te maken, eenmaal gecentrifugeerd en gereinigd, en de uiteindelijke concentratie is 5 × 107 cellen/ml.
♦ Verdun de celsuspensie en Ceturegel™ basaalmembraanmatrix in een verhouding van 1:1 bij 4 ℃ om een uiteindelijke concentratie van 5 × 10 te bereiden7 cellen/ml.
♦ Pak een vaste naakte muis met de linkerhand en injecteer deze subcutaan in de rechterschouder van de naakte muis. Tijdens de inoculatie wordt de naald subcutaan iets dieper ingebracht, ongeveer 1 cm diep, om de overloop van celsuspensie uit het naaldoog na de injectie te verminderen.
Het inoculatievolume is 200 μL. (Dit proces moet zo veel mogelijk binnen een half uur worden voltooid. Onderweg moet de celsuspensie op ijs worden geplaatst om cel-apoptose te vertragen en gelfenomeen te voorkomen).
♦ Zet de naakte muizen terug in de kooi om ze verder te voeden. De tumor zal dan nog ongeveer een week tot een maand zichtbaar zijn.Volgens het experimentele ontwerp moeten de naakte muizen worden geëuthanaseerd wanneer het tumorvolume aan de vereisten voldoet, en moeten er foto's worden gemaakt.
Let op: De controlegroep is de suspensie van het kweekmedium en de cellen, en de uiteindelijke dichtheid is gelijk aan die van de matrixlijmtestgroep.
4.5 Organoïde cultuur
Organoïden zijn 3D multicellulaire kleine weefsels die zijn gedifferentieerd uit stamcellen. Sommige eigenschappen van organen kunnen worden gereproduceerd. Organoïden zijn multicellulair en vertonen een hoge mate van zelfassemblage, en zijn daarom beter in staat om complexe in vivo cellulaire reacties en interacties te vertonen dan traditionele 2D-culturen. Stamcellen en/of orgaanprogenitorcellen van normaal of ziek weefsel kunnen worden gemengd met Ceturegel™ basaalmembraanmatrix of collageen. Vorm nier, schildklier, lever, hersenen, longen, darmen, prostaat en andere micro-organen. Bijvoorbeeld, voor onderzoekers die genetische screenings uitvoeren, kunnen Ceturegel™ basaalmembraanmatrixsubstraten worden gebruikt als bio-inkten om nauwkeurige lokalisatie en inbedding van levende cellen/organoïden in 3D-bioprinting mogelijk te maken.
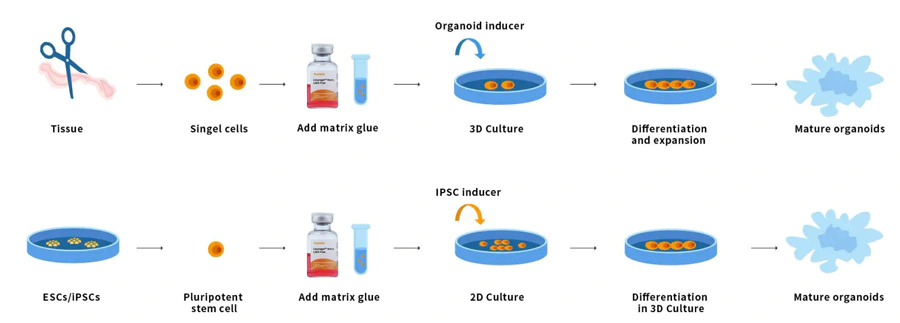
Figuur 7. Organoïde-werkingsproces
Constructie van de dunne darmorganoïde van muizen
Monsterbereiding: De muizen werden gedood door hun nek door te snijden en het oppervlak werd besproeid met alcohol voor sterilisatie. Snijd het darmweefsel 3~15cm uit nabij het maaguiteinde onder de steriele omgeving, verwijder voorzichtig het mesenterium en vet buiten het darmkanaal met een pincet en doe het in de DPBS-oplossing met 1% dubbel antilichaam dat vooraf is gekoeld op 4 ℃.
Reiniging van het monster: spoel het darmkanaal 2-3 keer met een spuit, knip het darmkanaal voorzichtig open met de darmholte naar boven met een chirurgische schaar en schraap voorzichtig de darmvlokken van het oppervlak van de darmholte af met een chirurgisch mesje. Nadat de darmvlokken zijn afgeschraapt (waardoor het transparante weefsel zichtbaar wordt), plaatst u het darmweefsel 2-3 keer in een nieuw kweekschaaltje met DPBS.
Eerste behandeling van monsters: snijd het gewassen dunne darmweefsel in 2 mm brede kleine stukjes en breng ze vervolgens over in een nieuwe 50 ml centrifugebuis. Was ze voorzichtig 3-5 keer met DPBS om darmvilluscellen en drijvend vetweefsel te verwijderen.
Vertering van het monster: voeg 10-15 ml voorgekoelde DPBS met 3-5 mM EDTA toe aan de gereinigde dunne darmfragmenten voor vertering, laat het mengsel ongeveer 30 minuten incuberen bij 4 ℃ en schud de centrifugebuis gedurende deze periode elke 10 minuten voorzichtig.
Gooi na de spijsvertering de supernatant van de EDTA-digestieoplossing weg en spoel de weefsels voorzichtig 2-3 keer met nieuwe DPBS-bufferoplossing om de resterende EDTA te verwijderen.
Voeg 10-15 ml voorgekoelde DPBS met 0,1% BSA toe aan de weefselfragmenten van de dunne darm, blaas en resuspendeer de weefselfragmenten herhaaldelijk om de uitsparing van de basale laag te scheiden, neem dan een beetje suspensie voor microscopisch onderzoek. Wanneer een groot aantal uitsparingachtige structuren wordt gezien, stop met blazen en gebruik 70% voor de geblazen weefselsuspensie μM Filterscherm om de weefselsuspensie die door het filterscherm gaat te filteren en te verzamelen.
Herhaal stap 5-6 twee keer en centrifugeer op 1500 tpm en 4 ℃ gedurende 3 min.
Vorming van mengsel: Ceturegel™ Matrixlijm zware suspensie recess weefselprecipitatie, elke 10 μL matrixlijmsuspensie bevat 200~600 recessen. Na resuspensie wordt het mengsel op ijs geplaatst en zo snel mogelijk gebruikt om te voorkomen dat de matrixlijm gel vormt.
Let op: verdunningsverhouding van matrixlijm ≥ 50% om Ceturegel™ te verzekeren tijdens het kweken van de stabiliteit van de matrixlijmstructuur.
Plaats de gemengde suspensie in het midden van de bodem van de 24-wellsplaat, 30~50 μL per well links en rechts om te voorkomen dat de suspensie in contact komt met de zijwand van de plaat met openingen.
Plaats de gekweekte kweekplaat in de broedstoof met een constante koolstofdioxidetemperatuur van 37 ℃ en broed deze ongeveer 30 minuten uit totdat de matrixgel stolt.
Wacht op Ceturegel™ Zodra de matrixlijm volledig is uitgehard, voegt u langzaam het voorbereide kweekmedium voor darmorganen toe langs de wand, 800 μL per putje.
Plaats de 24-wells plaat in de 37 ℃ koolstofdioxide incubator voor kweek. Vervang het verse medium elke 3 dagen en controleer de groeistatus van een orgaan zoals organen. Over het algemeen worden de dunne darm orgaan zoals organen van muizen binnen 5-7 dagen gevormd.
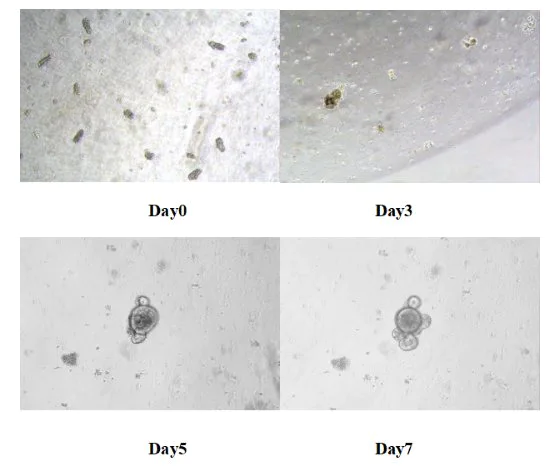
Figuur 8. Resultaten van in vitro-kweek van muizenorganen die lijken op dunne darm
5. Veelgestelde vragen
1. Wat is de reden voor het kleurverschil (lichtgeel tot donkerrood) van het verkregen substraat?
Voor de Ceturegel™ basaalmembraanmatrix die fenolrood bevat, wordt dit voornamelijk veroorzaakt door de interactie van fenolrood en bicarbonaat met CO2, maar het kleurverschil zal kleiner worden na equilibratie met 5% CO2. Schud het flesje na het invriezen en ontdooien voorzichtig om de Ceturegel™ basaalmembraanmatrix gelijkmatig te verdelen.
2. Waar moet op worden gelet bij de werking van de Ceturegel™ basaalmembraanmatrix?
Alle handelingen dienen in een steriele omgeving te worden uitgevoerd en er dient een voorgekoelde pipet te worden gebruikt om ervoor te zorgen dat de Ceturegel™ basaalmembraanmatrix gehomogeniseerd is.
3. Hoe kan ik de Ceturegel™ basaalmembraanmatrix invriezen en bewaren voor gebruik?
De bevroren en ontdooide Ceturegel™ Matrix LDEV-Free Ceturegel™ basaalmembraanmatrix kan worden verdeeld in meerdere kleine buisjes. Alle verdelingen moeten in voorgekoelde cryovials worden gedaan, die snel moeten worden ingevroren en opgeslagen om meervoudig invriezen en ontdooien te voorkomen. Alle betrokken items moeten voor gebruik worden gekoeld. Gebruik voorgekoelde pipetten, tips en kleine buisjes om Ceturegel™ basaalmembraanmatrix te hanteren.
6. De selectiegids van Ceturegel™ basaalmembraanmatrix van Yeasen
Verschillende typen Ceturegel™ basaalmembraanmatrix hebben verschillende toepassingen. Standaardconcentraties van Ceturegel™ basaalmembraanmatrix kunnen worden gebruikt voor polaire celculturen, zoals epitheelcellen. Het kan de differentiatie van verschillende cellen bevorderen en worden gebruikt voor tumorcelmigratie- en invasie-experimenten. Hoge concentraties van Ceturegel™ basaalmembraanmatrix worden veel gebruikt in vivo en kunnen worden gebruikt voor tubuliformatie-experimenten. De belangrijkste functie van lage groeifactor (GFR) is om de interferentie van groeifactoren in het experiment te elimineren en het is geschikt voor studies met hoge eisen voor basaalmembraanpreparatie. Ceturegel™ basaalmembraanmatrix zonder fenolrood kan de interferentie van fenolroodindicator elimineren en is geschikt voor kleurontwikkelingsexperimenten, zoals colorimetrie en fluorescentiedetectie. Ceturegel™ basaalmembraanmatrix van menselijke embryonale stamcelcultuurkwaliteit wordt speciaal gebruikt voor menselijke embryonale stamcelcultuur, geïnduceerde pluripotente feedervrije stamcelcultuur.
Tabel 2. Ceturegel™Matrix selectiegids
| Producttype | Cat.nr. | Productnaam | Matrigel Cat.nr. | Toepassingsrichting |
| Basisconcentratie (8-12 mg/ml) | 40183ES | 356234/ 354234 | Geschikt voor 2D- en 3D-kweek-, invasie- en migratie-experimenten en kan ook worden gebruikt voor in vivo tumorigene experimenten | |
| 40184ES | 356237 | Wordt voornamelijk gebruikt voor kleurdetectie, zoals fluorescentiedetectie-experimenten, enz. | ||
| Groeifactorreductie
| 40185ES | 354230 | Voornamelijk om de interferentie van groeifactoren op het experiment uit te sluiten. Toegepast op gerelateerd onderzoek naar groeifactoren, signaleringspaden, etc. | |
| 40186ES | 356231 | |||
| Hoge concentratie (≥18mg/ml) | 40187ES | 354248 | Wordt voornamelijk gebruikt bij experimenten zoals angiogenese, gel-embolisatie en in vivo tumorvorming (voor angiogenese wordt aanbevolen dat de uiteindelijke concentratie van Ceturegel™ basaalmembraanmatrix ≥10 mg/ml is) | |
| 40189ES (navraag) | Ceturegel™Matrix Hoge concentratie, GFR, LDEV-vrij | 354263 | ||
| 40188ES | Ceturegel™Matrix Hoge concentratie, fenolroodvrij, LDEV-vrij | 354262 | ||
| Voor stamcellen | 40190ES | 354277 | Wordt voornamelijk gebruikt voor stamcelkweek zoals hESC, iPSC, etc. | |
| Organoïde-specifiek | 40191ES (navraag) | Ceturegel™ Matrix voor Organoïde cultuur, Fenolrood-vrij, LDEV-vrij | 356255 | Ceturegel™ basaalmembraanmatrix voor organoïdecultuur |
