Коммерческий набор реагентов HCP от Yeasen Biotechnology — это простой, высокочувствительный и объективный метод обнаружения HCP. Компания Yeasen Biotechnology самостоятельно разработала несколько наборов реагентов, которые могут чувствительно определять остаточные уровни HCP в образцах. Эти наборы реагентов можно использовать для оптимизации процесса очистки биофармацевтических препаратов, контроля примесей в промежуточных процессах и выпуска тестирования конечных продуктов. Хотите узнать больше о том, как наборы реагентов HCP от Yeasen Biotechnology могут улучшить ваше биофармацевтическое производство? Читать статья сейчас!

Концепция и необходимость обнаружения HCP
Биологические продукты обычно производятся с использованием рекомбинантной технологии в клетках-хозяевах (таких как бактерии, дрожжи, клетки млекопитающих, насекомых или растений), включая моноклональные антитела, рекомбинантные белки и вакцины. Процессы производства и очистки этих продуктов неизбежно вводят белки клеток-хозяев (HCP) в качестве примесей, которые включают как структурные белки клеток-хозяев, так и факторы роста, секретируемые клетками-хозяевами, образуя сложную смесь с различными физико-химическими и иммунологическими свойствами. Несмотря на использование передовых методов очистки, некоторые белки клеток-хозяев все еще могут оставаться в качестве примесей, связанных с процессом, в промежуточных лекарственных продуктах.
Эти примеси обладают потенциальной иммуногенностью и могут усиливать иммуногенный ответ биофармацевтических продуктов, влияя на их стабильность и эффективность, тем самым создавая риски для безопасности человека. Поэтому необходимо разработать соответствующие стратегии мониторинга для удаления HCP, а также контролировать содержание HCP в конечном продукте для соответствия требованиям качества лекарственных средств.
Нормативные требования к медицинским работникам
Остаточное содержание HCP в биологических продуктах обычно считается критическим атрибутом качества (CQA) продукта, важным индексом оценки для мониторинга надежности процесса и ключевым индексом контроля качества продукта. Регулирующие органы в разных странах имеют положения относительно HCP, требующие анализа и очистки биофармацевтических препаратов для снижения HCP белка клетки-хозяина до приемлемых уровней. Уровень приемлемости HCP будет оцениваться на основе конкретных обстоятельств и зависит от нескольких факторов, включая дозу, частоту дозирования, тип препарата и тяжесть заболевания.
Китайская фармакопея (издание 2020 г.) устанавливает: для клеток CHO остаточный HCP должен быть <0,05% (что эквивалентно менее 500 ppm); для E. coli остаточный HCP должен быть <0,01%.
В главе <1132> Фармакопеи США указано: Для обнаружения HCP в лекарственных средствах следует использовать высокочувствительный метод, а их содержание должно быть ниже предела обнаружения (обычно менее 100 ppm, т. е. содержание HCP в 1 мг общего белка должно быть менее 100 нг или <0,01%).
Европейская фармакопея EP 2.6.34 устанавливает: В биологических продуктах содержание HCP должно быть менее 0,1%.
В рекомендациях Международной конференции по гармонизации технических требований к регистрации фармацевтических препаратов для человека (ICH): ICH Q6B указано, что для мониторинга остаточных количеств HCP следует применять чувствительные и проверенные методы, при этом остаточное количество, как правило, должно быть менее 100 ppm.
Видно, что регулирующие органы предъявляют весьма последовательные требования к HCP. Разработка процесса биологических продуктов должна проходить через обнаружение HCP, демонстрировать, что процесс очистки может снизить HCP до безопасного уровня, а рекомендуемые пределы остаточного содержания в конечном продукте составляют менее 0,01% как в Китае, так и в США.
Методы обнаружения HCP
Иммуноферментный анализ (ELISA) в настоящее время является наиболее часто используемым методом обнаружения HCP. Методы обнаружения остатков белка хозяина, упомянутые в главах 3412/3413/3414 издания Китайской фармакопеи 2020 года, все являются методами ELISA.
В главе <1132> Фармакопеи США также упоминается, что для определения содержания HCP можно использовать такие методы, как электрофорез, ИФА и ЖХ-МС/МС, а ИФА рекомендуется в качестве предпочтительного метода определения HCP из-за простоты использования, скорости, высокой чувствительности и высокой пропускной способности.
ИФА:
Цель: Определяет общее количество белков в HCP, может использоваться для разработки продуктов и контроля процесса и в настоящее время является распространенным методом обнаружения HCP.
Преимущества: Высокая чувствительность и специфичность; Высокая пропускная способность и возможность автоматизации; Количественный; Простота и быстрота эксплуатации.
Недостатки: Требуются специфические антитела; Невозможность специфической идентификации и оценки отдельных HCP; Разработка метода сложна, требует специальной подготовки антигена; На метод влияет множество факторов, необходимо оценить охват HCP; Невозможность идентификации видов.

Вестерн-блоттинг:
Цель: Используется для последовательного скрининга большого количества образцов и обнаружения неизвестных белков, которые реагируют с антителами к HCP. Подходит для обнаружения HCP и предоставления приблизительной информации об относительной молекулярной массе HCP.
Преимущества: Специфичность; Результаты наглядно видны: визуализируются различия в размерах белков и уровнях экспрессии; Может обнаруживать и количественно определять конкретные HCP.
Недостатки: Полуколичественный; Ограничен определенными белками: может обнаруживать только HCP, связанные с антителами; Недостаточно чувствителен для сложных смесей белков; Денатурация белка SDS может привести к потере конформационных эпитопов; Чувствительность зависит от качества поликлональных антител.
Двумерный гель-электрофорез (2-DE):

Цель: Обычно используемый для разработки и характеристики предшествующих или последующих процессов, он позволяет различать различные HCP в одном геле.
Преимущества: Нет необходимости в вестерн-блоттинге, что позволяет избежать проблем с переносом; Возможность отделения следовых количеств примесей HCP от продукта; Предоставляет приблизительную информацию об относительной молекулярной массе и изоэлектрической точке.
Недостатки: Избыточное количество белка может маскировать пятна HCP; распределение HCP в образце можно наблюдать, но его невозможно количественно оценить.

Масс-спектрометрический анализ:
Цель: Определяет отдельные HCP, предоставляя точную информацию об идентификации и количественной оценке белков клетки-хозяина.
Преимущества: Высокое разрешение и точность; Идентифицирует и контролирует отдельные HCP; Предоставляет комплексные спектры HCP; Может охватывать широкий спектр белков; Может идентифицировать виды HCP.
Недостатки: Высокие требования к оборудованию и техническим характеристикам; Сложная эксплуатация; Высокая стоимость; Низкая производительность метода; Сложная предварительная обработка образцов; Потенциальные матричные эффекты; Требуются специализированные возможности анализа данных.
ELISA является рекомендуемым методом обнаружения остаточных HCP в биологических продуктах фармакопеями разных стран, способным определять общее количество HCP. Однако он имеет ограничения в определении типов и распространенности HCP и должен быть дополнен другими методами. Каждый метод обнаружения имеет свои преимущества и недостатки, и в практическом применении выбор может быть сделан на основе экспериментальных целей, характеристик образца, точности и удобства эксплуатации, среди прочих факторов, в сочетании с использованием различных методов для получения более полных и точных результатов.
Кроме того, в Фармакопее США USP <1132> и Европейской Фармакопее EP 2.6.34. АНАЛИЗЫ БЕЛКОВ КЛЕТОК-ХОЗЯЕВ указывают, что для обнаружения HCP на разных этапах разработки продукта следует использовать различные реагенты ELISA, классифицируя методы обнаружения HCP на коммерческие реагенты, методы, специфичные для продукта/процесса, и платформенные методы.
В USP <1132> упоминается, что при отсутствии платформенных методов коммерческие реагенты могут использоваться в доклинических испытаниях, клинических испытаниях фазы I и фазы II; в клинических испытаниях фазы III/валидации процесса и послепродажном выпуске продукта из-за таких ограничений, как недостаточное покрытие антителами коммерческих реагентов для обнаружения HCP общего назначения, следует учитывать такие факторы, как тип клеток и специфичность процесса, используя платформенные методы или методы, специфичные для продукта/процесса, для разработки процесса на начальном этапе.
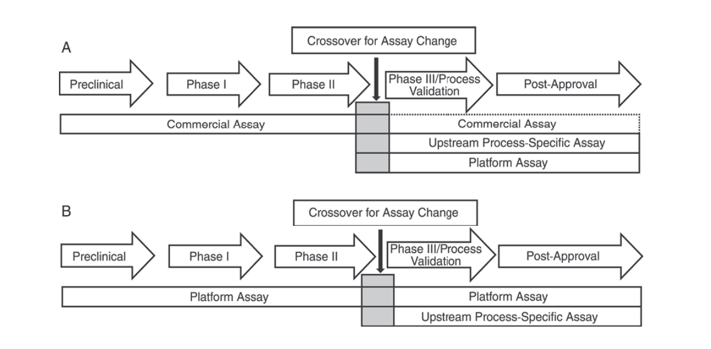
Рисунок 1. В Фармакопее США <1132> на разных этапах разработки продукта предлагается использовать определенные методы обнаружения HCP.
| Метод | Коммерческий набор реагентов | Обнаружение, специфичное для продукта/процесса Набор | Обнаружение платформы Набор |
| Доступность | Легкодоступно
| Требуется подготовка антигенов, включая клонирование линий клеток-хозяев.
| Требуется подготовка антигенов с использованием голых или пустых векторных клеточных линий.
|
| Разработка | Требуется минимальная подготовка | Разработка метода обнаружения, включая характеристику антигена, иммунизацию и подтверждение, обычно занимает не менее 6 месяцев. | Разработка метода обнаружения, включая характеристику антигена, иммунизацию и подтверждение, обычно занимает не менее 9 месяцев. |
| Разнообразие | Ограничено наиболее распространенными системами выражения | Могут использоваться различные типы систем выражения | Могут использоваться различные типы систем выражения |
| Специфичность | Специфичность может быть низкой, с возможными необнаруженными медицинскими работниками
| Специфичность обычно повышается за счет охвата антителами определенных моделей HCP. | По сравнению с коммерческими методами обнаружения повышается специфичность, улучшается понимание эффективности обнаружения, а также увеличивается охват типов HCP. |
| Расходы | Первоначальные цены относительно низкие, но затраты на разработку быстро возрастут для всего последующего процесса очистки. | Первоначальные затраты выше, но точка безубыточности обычно находится на уровне стоимости 100 наборов реагентов. | Благодаря возможности применения к нескольким продуктам он имеет значительные преимущества в плане затрат. |
| Зависимость | Реагенты и схемы контроля, зависящие от конкретного поставщика, находятся в состоянии «черного ящика». | Имеет полный контроль над всеми реагентами и буферами, может быть скорректирован в любое время | Имеет полное право собственности и контроль над всеми реагентами, что снижает риски в цепочке поставок и сопоставимости партий |
| Нормативные требования | Не подходит для поддержки маркетинга заявки на авторизацию | Применимо для поддержки всего процесса от ранней разработки до маркетинга лицензионной продукции. | Применимо для поддержки ранней разработки до получения разрешения на продажу |
Таблица 1.Сравнение различных типов наборов реагентов HCP
Yeasen Biotech индивидуальные услуги по разработке HCP-анализов
Учитывая важность обнаружения HCP, Йесен Biotech опирается на высокопроизводительную платформу разработки моноклональных антител для создания платформ разработки критического сырья для белковых антител и независимой лаборатории для разработки продуктов иммунного обнаружения, оснащенной передовыми исследовательскими инструментами, такими как анализаторы иммуноферментного анализа и системы двунаправленного гель-электрофореза-иммуноблоттинга 2D-WB. Платформа разработки является высокозрелой и способна быстро настраивать наборы для анализа HCP для различных остатков клеток-хозяев, включая клетки млекопитающих, клетки насекомых (например, Sf9), бактерии и дрожжи.
Хронология настройки
Услуга по настройке наборов для обнаружения остатков белка в клетках-хозяевах обычно занимает от 6 до 10 месяцев.
Подготовка антигена-антитела: определение антигенов HCP, установление эталонных стандартов HCP, разработка иммунных путей и стратегий, подготовка антител HCP и т. д. обычно занимает от 4 до 6 месяцев.
Разработка набора для анализа: оптимизация антител, анализ покрытия, валидация метода набора для анализа и т. д. обычно занимает от 2 до 4 месяцев.
Йесен Служба проверки покрытия антител Biotech HCP
Известно, что ИФА является золотым стандартом для обнаружения остаточных HCP в отрасли, но точность этого метода зависит от покрытия мультиклонированными антителами к HCP. Фармакопея США и Европейская фармакопея упоминают иммуноочистку и 2D-WB как рекомендуемые методы для характеристики антител HCP ELISA и их покрытия.
Покрытие антителами HCP Проверка Услуга
2D-WB сначала разделяет белки по размеру и заряду с помощью двумерного гель-электрофореза, затем переносит эти белки на мембрану для инкубации с антителами HCP для обнаружения белкового отпечатка.
Мы имеет полный набор инструментов для 2D-WB и обширный лабораторный опыт для предоставления услуг по проверке покрытия антителами образцов HCP из клеток-хозяев, таких как CHO, E.coli, HEK293 и т. д.
Сопутствующий продукт:
| Продукт | Номер по каталогу | Размер |
| 36712ES | 48Т/96Т | |
| 36713ES | 48Т/96Т | |
| Набор для иммуноферментного анализа CHO HCP (CHO-K1) | 36714ES | 48Т/96Т |
| Набор E.coli HCP ELISA (плазмида) | 36721ES | 48Т/96Т |
