Описание
Hieff NGS™ OnePot Pro DNA Library Prep Kit V4 — это набор для подготовки ферментативной библиотеки нового поколения, разработанный для использования с Illumina. и платформы высокопроизводительного секвенирования MGI. По сравнению с традиционными методами подготовки библиотек, этот набор использует высококачественные ферменты фрагментации, устраняя необходимость в громоздких процессах ультразвуковой обработки. Модули фрагментации и восстановления концов объединены в один шаг, что значительно сокращает как время, так и стоимость подготовки библиотеки. Этот набор подходит для широкого спектра типов образцов, включая геномы растений и животных, микробные геномы и многое другое, с диапазоном ввода образца от 1 нг до 1 мкг. Ферментативная фрагментация обеспечивает однородные размеры фрагментов для разных видов с минимальными межвидовыми вариациями. Кроме того, этот набор можно использовать в паре с Illumina или МГИ адаптеры и праймеры для секвенирования на высокопроизводительных платформах Illumina или MGI.
Технические характеристики
| Кат.№ | 12972ES08 / 12972ES24 / 12972ES96 |
| Размер | 8 Т / 24 Т/96 Т |
Компоненты
| Номер компонента | Имя | 12972ES08 | 12972ES24 | 12972ES96 |
| 12972-А | 80 мкл | 240 мкл | 960 мкл | |
| 12972-Б | Смеараза™ Фермент 4.0 | 80 мкл | 240 мкл | 960 мкл |
| 12972-С | Усилитель лигирования 4.0 | 240 мкл | 720 мкл | 3×960 мкл |
| 12972-Д | Стремительный ДНК-лигаза 4.0 | 80 мкл | 240 мкл | 2×480 мкл |
| 12972-Э | 2×Ultima HF усилительный микс | 200 мкл | 600 мкл | 3×800 мкл |
Хранилище
Этот продукт следует хранить при температуре от -25 до -15℃ в течение 1 год.
Примечания
1. О ходе операции
1. Пожалуйста, работайте в лабораторных халатах и одноразовых перчатках.,для вашей безопасности.
2. Разморозьте компоненты при комнатной температуре. После размораживания, тщательно перемешайте встряхиванием, быстро поверните пробирку в центрифуге и поместите ее на лед для дальнейшего использования.
3. При приготовлении реакционного раствора на каждом этапе рекомендуется использовать пипетку для тщательного перемешивания или осторожного встряхивания. Интенсивное встряхивание может привести к снижению выхода библиотеки.
4. Настоятельно рекомендуется использовать фильтрованные наконечники пипеток, чтобы избежать перекрестного загрязнения. Обязательно меняйте наконечники пипеток при обработке разных образцов.
5. Неправильные операции с большой вероятностью могут привести к аэрозольным загрязнениям, что повлияет на точность результата. Рекомендуется обязательная физическая изоляция областей смешивания реакции ПЦР и областей анализа очистки продукта ПЦР. Оснащен оборудованием, таким как специализированные пипетки для создания библиотеки.Выполняйте обычную уборку каждой зоны, протирая поверхности 0,5% раствором гипохлорита натрия или 10% отбеливателем.
6. Данный продукт предназначен только для исследовательских целей.
2. Фрагментация ДНК1. Комплект совместим с 100 стр. - 1000 нг входной ДНК. Настоятельно рекомендуется использовать высококачественную входную ДНК с A260/A280 = 1,8-2,0.
2. На следующие эксперименты может повлиять, если высокие концентрации солей, таких как металл-хелатирующий агент, были введены с входной ДНК. Мы рекомендуем элюировать образец ДНК в ддх2О для фрагментации.
3. Пожалуйста, обратитесь к таблице. 6 для времени фрагментации стандартных образцов ДНК.Набор имеет низкую степень фрагментации и обеспечивает равномерное покрытие образцов ДНК с широким диапазоном составов ГХ. Пожалуйста, отрегулируйте время фрагментации в соответствии с вашими экспериментальными требованиями.
4. Для точной фрагментации готовьте реакцию на льду.
3. Лигирование адаптера
1. Клиентам доступны комплекты длинных адаптеров (адаптеров со штрих-кодом) Illumina или MGI, а также комплекты коротких адаптеров, которые они могут выбрать в соответствии со своими экспериментальными требованиями.
2. Рекомендуется выбирать высококачественные коммерческие адаптеры. Если вы выбираете адаптеры собственного изготовления, пожалуйста, доверьте это компании с опытом в синтезе праймеров NGS и отметьте необходимость строгого контроля загрязнения. Кроме того, рекомендуется готовить раствор для отжига ДНК в чистом помещении и использовать только один тип адаптера каждый раз, чтобы предотвратить перекрестное загрязнение.
3. Размораживайте адаптеры на льду или при температуре 4°C; при работе при комнатной температуре температура в лаборатории не должна превышать 25°C, чтобы предотвратить денатурацию адаптеров.
4. Качество и концентрация адаптеров напрямую влияют на эффективность лигирования и выход библиотеки. Слишком высокая концентрация адаптеров способствует образованию димера адаптера, в то время как слишком низкая концентрация адаптера снижает скорость лигирования и выход библиотеки. Соответствующие разбавления с буфером TE в соответствии с количеством входной ДНК при использовании адаптера.Таблица 2 -3 перечислены рекомендуемые методы разбавления адаптера для различных количеств входной ДНК с использованием этого набора.
Таблица 1 Рекомендуемое количество адаптеров Illumina для различных входных ДНК
| Ввод ДНК | Разбавление адаптера (объем адаптера : общий объем) | Концентрация |
| 1 нг | 30-Сложить (1 : 30) | 0,5 мкМ |
| 10 нг | 7.5-Сложить (1 : 7.5) | 2 мкМ |
| 100 нг | 3-Сложить (1 : 3) | 5 мкМ |
| 1000 нг | 1.5-Сложить (1 : 1.5) | 10 мкМ |
Таблица 2 Рекомендуемое количество адаптера MGI для разного входного количества ДНК
| Ввод ДНК | Разбавление адаптера (объем адаптера : общий объем) | Концентрация |
| 1 нг | 20-Сложить (1 : 20) | 0,5 мкМ |
| 10 нг | 5-Сложить (1 : 5) | 2 мкМ |
| 100 нг | 2-Сложить (1 : 2) | 5 мкМ |
| 1000 нг | неразбавленный | 10 мкМ |
4. Очистка ДНК с помощью гранул и выбор размера
1. Этап выбора размера фрагмента ДНК может быть выполнен либо после лигирования адаптера, либо после амплификации библиотеки.
2. Рекомендуется проводить выбор размера сразу после лигирования адаптера, если количество вводимой ДНК превышает 50 нг.; в противном случае, пожалуйста, выполните выбор размера после усиления.
3. Ligation Enhancer содержит высокую концентрацию ПЭГ, что может оказать существенное влияние на точность выбора размера. Таким образом, если выбор размера должен быть выполнен сразу после лигирования адаптера, настоятельно рекомендуется добавить этап очистки бусин перед выбором размера. Этап выбора размера может быть выполнен напрямую, если он выполняется до окончания ремонта/dA-tailing или после усиление библиотеки.
4. Перед использованием магнитные шарики следует выдержать при комнатной температуре, в противном случае выход снизится и повлияет на эффект выбора размера.
5. Перед использованием магнитные частицы следует тщательно перемешать с помощью вортекса или пипетки.
6. Не аспирируйте частицы при переносе супернатанта, даже следовые количества частиц могут повлиять на последующие реакции.
7. 80%-ный этанол должен быть свежеприготовленным, в противном случае это повлияет на эффективность восстановления.
8. Для точного подбора размера рекомендуется начинать с объема более 100 мкл. Если меньше, рекомендуется довести объем до 100 мкл сверхчистой водой.
9. Магнитные бусины следует высушить при комнатной температуре перед элюированием продукта. Недостаточная сухость легко может привести к тому, что остаточный этанол повлияет на последующие реакции; чрезмерная сухость приведет к растрескиванию магнитных бусинок и снижению выхода очистки. Обычно сушки при комнатной температуре в течение 3-5 минут достаточно, чтобы бусины полностью высохли.
10. При необходимости очищенные или отобранные по размеру образцы ДНК элюируются в 0.1× Буфер TE можно хранить при температуре 4°C в течение 1-2 недель или при температуре -20°C в течение месяца.
5. Расширение библиотеки
1. Проводить или нет амплификацию библиотеки зависит от количества входной ДНК, типов адаптеров, приложений данных секвенирования и т. д. Этап амплификации требуется при использовании частичных адаптеров. При использовании полноразмерных адаптеров, если входная ДНК < 200 нг, рекомендуется проводить амплификацию; в противном случае амплификация не требуется.
2. Количество циклов амплификации должно строго контролироваться. Недостаточная амплификация может привести к низкому выходу библиотеки; Чрезмерная амплификация может привести к увеличению смещения, ошибок, дублирования прочтений и химерных продуктов. Таблица 3 перечислены рекомендуемые числа циклов, ориентированные на выход библиотеки 1 мкг.
Таблица 3 Рекомендуемое количество циклов для генерации 1000 нг выхода библиотеки
| Ввод ДНК | Количество циклов, необходимое для получения 1 мкг библиотеки |
| 1000 нг | 2 - 4 |
| 500 нг | 2 - 4 |
| 250 нг | 4 - 6 |
| 100 нг | 5 - 7 |
| 50 нг | 7 - 9 |
| 1 нг | 12 - 14 |
Примечание:
1.Таблица 3 показывает количество параметров цикла с использованием высококачественных тестов входной ДНК размером около 200 п.н. Качество ДНК FFPE сильно варьируется, и если качество ДНК плохое или длина библиотеки большая, количество циклов необходимо соответствующим образом увеличить для получения достаточного количества библиотек.
2.яЕсли в процессе построения библиотеки требуется выбор размера, рекомендуется использовать большее количество циклов для усиления библиотеки; в противном случае рекомендуется меньшее количество циклов.
3.яЕсли используются неполные адаптеры, необходимо провести амплификацию не менее 2 циклов для формирования полного адаптера.
6. Анализ качества библиотеки
1. Качество созданных библиотек обычно анализируется путем измерения концентраций и распределений размеров.
2. Концентрации библиотек можно измерить с помощью флуоресцентных методов, таких как Qubit и PicoGreen, или количественной ПЦР.
3. НЕ рекомендуется использовать методы количественной оценки, основанные на поглощении, такие как NanoDrop.
4. Рекомендуется использовать метод qPCR для количественной оценки библиотеки: флуоресцентные методы, такие как Qubit и PicoGreen, не могут дифференцировать неполные структуры dsDNA (вставки без адаптера или только с одним из концов, лигированным с адаптером) от полных библиотек. Метод qPCR будет амплифицировать и измерять только полные библиотеки с обоими концами, лигированными с адаптерами (секвенируемые библиотеки), тем самым обеспечивая более точное измерение для загрузки.
5. Распределение размеров библиотек можно проанализировать с помощью Agilent Bioanalyzer или других устройств, основанных на принципах капиллярного электрофореза или микрофлюидики.
7. Другие материалы
1. Магнитные шарики для очистки ДНК: Hieff NGSТМ Бусины для отбора ДНК (Yeasen Cat#12601) или AMPure® XP Beads (A63880) или другие эквивалентные продукты.
2. Адаптеры: Полный адаптер для Illumina: Йесен Кот#13519-13520; 384 Двойных праймера CDI: Йесен Кот#12412~Кот#12413; 384 уникальных праймера с двойным индексом (UDI): Йесен Кат#12327~Кот#13330; UMI UDI-адаптеры: Йесен Кот#13370~Кот#13371; Полный адаптер для MGI: Yeasen Cat#13360-13362. Смесь праймеров ДНК:Кот#12190 или Кот#12191.
3. Анализ качества библиотеки: чип Agilent 2100 Bioanalyzer DNA 1000/чип высокой чувствительности или другие эквивалентные продукты; количественные реагенты библиотеки.
4. Другие материалы: абсолютный этанол, стерильная сверхчистая вода, наконечники для пипеток с низкой степенью удержания, пробирки для ПЦР, магнитные стойки, термоциклер и т. д.
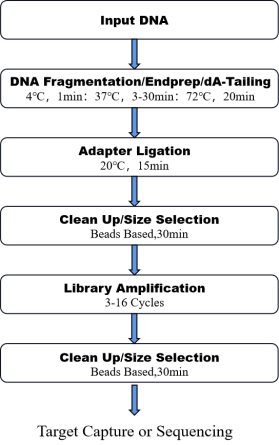
8. Рабочий процесс
Рисунок 1.Рабочий процесс OnePot Профи ДНК Комплект для подготовки к библиотеке
Оплата и безопасность
Ваша платежная информация обрабатывается надежно. Мы не храним данные кредитной карты и не имеем доступа к информации вашей кредитной карты.
Расследование
Вам также может понравиться
Часто задаваемые вопросы
Продукт предназначен только для исследовательских целей и не предназначен для терапевтического или диагностического использования на людях или животных. Продукты и содержимое защищены патентами, товарными знаками и авторскими правами, принадлежащими Yeasen Biotechnology. Символы товарных знаков указывают на страну происхождения, а не обязательно на регистрацию во всех регионах.
Для некоторых приложений могут потребоваться дополнительные права интеллектуальной собственности третьих лиц.
Йесен привержен этической науке, полагая, что наши исследования должны затрагивать важнейшие вопросы, обеспечивая при этом безопасность и соблюдение этических стандартов.