Yeasen Biotechnologys kommersiella HCP-reagenssats är en enkel, mycket känslig och objektiv metod för HCP-detektion. Yeasen Biotechnology har självständigt utvecklat flera reagenskit, som känsligt kan detektera kvarvarande HCP-nivåer i prover. Dessa reagenssatser kan användas för att optimera reningsprocessen av bioläkemedel, kontrollera föroreningar i mellanprocesser och släppa testning av slutprodukter. Vill du lära dig mer om hur Yeasen Biotechnologys HCP-reagenskit kan förbättra din biofarmaceutiska produktion? Läsa artikeln nu!

Koncept och nödvändighet för HCP-detektering
Biologiska produkter produceras vanligtvis med hjälp av rekombinant teknologi i värdceller (såsom bakterier, jäst, däggdjurs-, insekts- eller växtceller), inklusive monoklonala antikroppar, rekombinanta proteiner och vacciner. Tillverknings- och reningsprocesserna för dessa produkter introducerar oundvikligen värdcellsproteiner (HCP) som föroreningar, vilket inkluderar både strukturella proteiner från värdcellerna och tillväxtfaktorer som utsöndras av värdcellerna, vilket bildar en komplex blandning med olika fysikalisk-kemiska och immunologiska egenskaper. Trots användningen av avancerade reningstekniker kan vissa värdcellsproteiner fortfarande finnas kvar som processrelaterade föroreningar i mellanliggande läkemedelsprodukter.
Dessa föroreningar har potentiell immunogenicitet och kan förstärka det immunogena svaret hos biofarmaceutiska produkter, vilket påverkar deras stabilitet och effektivitet och därigenom utgöra risker för människors säkerhet. Därför måste lämpliga övervakningsstrategier för avlägsnande av HCP fastställas, och innehållet av HCP i slutprodukten måste kontrolleras för att uppfylla kraven på läkemedelskvalitet.
Regulatoriska krav för HCP
Resthalten av HCP i biologiska produkter anses i allmänhet vara ett kritiskt kvalitetsattribut (CQA) hos produkten, ett viktigt utvärderingsindex för övervakning av processtålighet och ett nyckelindex för produktens kvalitetskontroll. Tillsynsmyndigheter i olika länder har bestämmelser om HCP som kräver analys och rening av bioläkemedel för att reducera värdcellprotein HCP till acceptabla nivåer. Acceptansnivån för HCP kommer att bedömas baserat på specifika omständigheter och beror på flera faktorer, inklusive dos, doseringsfrekvens, läkemedelstyp och sjukdomens svårighetsgrad.
Den kinesiska farmakopén (2020-utgåvan) föreskriver: För CHO-celler måste den kvarvarande HCP vara <0,05 % (motsvarande mindre än 500 ppm); för E. coli måste den kvarvarande HCP vara <0,01 %.
Kapitlet United States Pharmacopeia USP <1132> specificerar: En mycket känslig metod bör användas för att detektera HCP i läkemedel, och innehållet bör vara under detektionsgränsen (vanligtvis mindre än 100 ppm, dvs. HCP-innehållet i 1 mg totalt protein ska vara mindre än 100 ng, eller <0,01%).
Den europeiska farmakopén EP 2.6.34 specificerar: I biologiska produkter bör innehållet av HCP vara mindre än 0,1 %.
Den internationella konferensen om harmonisering av tekniska krav för registrering av läkemedel för mänskligt bruk (ICH) riktlinjer: ICH Q6B anger att känsliga och validerade metoder bör användas för att övervaka kvarvarande HCP, med restmängden vanligtvis mindre än 100 ppm.
Det kan ses att tillsynsmyndigheter har mycket konsekventa krav på HCP. Processutvecklingen av biologiska produkter måste genomgå HCP-detektering, visa att reningsprocessen kan reducera HCP till säkra nivåer, och de rekommenderade gränserna för resthalt i slutprodukten är under 0,01 % i både Kina och USA.
HCP-detektionsmetoder
Enzym-Linked Immunosorbent Assay (ELISA) är för närvarande den mest använda metoden för HCP-detektion. Metoderna för detektion av värdproteinrester som nämns i kapitel 3412/3413/3414 i 2020 års upplaga av Chinese Pharmacopoeia är alla ELISA-metoder.
Kapitlet United States Pharmacopeia USP <1132> nämner också att metoder som elektrofores, ELISA och LC-MS/MS kan användas för att detektera HCP-innehåll, och ELISA rekommenderas som den föredragna metoden för HCP-detektion på grund av dess enkla användning, hastighet, höga känslighet och höga genomströmning.
ELISA:
Ändamål: Detekterar den totala mängden proteiner i HCP, kan användas för produktutveckling och processkontroll, och är idag en vanlig metod för att detektera HCP.
Fördelar: Hög känslighet och specificitet; Hög genomströmning och automationsförmåga; Kvantitativ; Enkel och snabb drift.
Nackdelar: Kräver specifika antikroppar; Kan inte specifikt identifiera och utvärdera individuella HCP; Metodutveckling är komplex och kräver speciell antigenberedning; Många påverkande faktorer för metoden, HCP-täckning måste utvärderas; Kan inte identifiera arter.

Western Blotting:
Ändamål: Används för konsekvent screening av ett stort antal prover och för att detektera okända proteiner som reagerar med anti-HCP-antikroppar. Lämplig för att detektera HCP och ge ungefärlig information om den relativa molekylvikten för HCP.
Fördelar: Specificitet; Resultaten är visuellt intuitiva: visualiserar skillnader i proteinstorlek och uttrycksnivåer; Kan upptäcka och kvantifiera specifika HCP.
Nackdelar: Semi-kvantitativ; Begränsad till specifika proteiner: kan endast detektera HCP:er bundna till antikroppar; Inte tillräckligt känslig för komplexa proteinblandningar; Protein SDS-denaturering kan leda till förlust av konformationsepitoper; Känslighet beror på kvaliteten på polyklonala antikroppar.
Tvådimensionell gelelektrofores (2-DE):

Ändamål: Vanligtvis används för uppströms eller nedströms processutveckling och karakterisering, det kan särskilja olika HCP på en enda gel.
Fördelar: Inget behov av Western blotting, undvika överföringsproblem; Kan separera spårmängder av HCP-föroreningar från produkten; Ger ungefärlig information om relativ molekylvikt och isoelektrisk punkt.
Nackdelar: För mycket protein kan maskera HCP-fläckar; Fördelningen av HCP i provet kan observeras, men kan inte kvantifieras.

Masspektrometrianalys:
Ändamål: Identifierar individuella HCP, tillhandahåller korrekt identifierings- och kvantifieringsinformation för värdcellsproteiner.
Fördelar: Hög upplösning och noggrannhet; Identifierar och övervakar individuella HCP; Tillhandahåller omfattande spektra av HCPs; Kan täcka ett brett spektrum av proteiner; Kan identifiera HCP-arter.
Nackdelar: Hög utrustning och tekniska krav; Komplex operation; Hög kostnad; Låg metodgenomströmning; Komplex provförbehandling; Potentiella matriseffekter; Kräver specialiserade dataanalysfunktioner.
ELISA är den rekommenderade metoden för att detektera kvarvarande HCP i biologiska produkter genom farmakopéer i olika länder, som kan bestämma den totala mängden HCP. Det har dock begränsningar när det gäller att identifiera typer och mängder av HCP och behöver kompletteras med andra metoder. Varje detektionsmetod har sina fördelar och nackdelar, och i praktiska tillämpningar kan urval göras baserat på experimentella syften, provets egenskaper, noggrannhet och bekvämlighet, bland annat, kombinerat med användningen av olika metoder för att erhålla mer heltäckande och korrekta resultat.
Dessutom, United States Pharmacopeia USP <1132> och European Pharmacopoeia EP 2.6.34. VÄRD-CELL PROTEIN-ANALYS indikerar att olika ELISA-reagenser bör användas för HCP-detektion i olika stadier av produktutvecklingen, genom att kategorisera HCP-detektionsmetoder i kommersiella reagenser, produkt-/processspecifika metoder och plattformsmetoder.
USP <1132> nämner att i avsaknad av plattformsmetoder kan kommersiella reagens användas i prekliniska, fas I och fas II kliniska prövningar; i kliniska fas III-prövningar/processvalidering och produkt efter marknadsföring, på grund av begränsningar såsom otillräcklig antikroppstäckning av kommersiella allmänna HCP-detektionsreagenser, bör hänsyn tas till faktorer som celltyp och processspecificitet, med användning av plattformsmetoder eller produkt-/processspecifika metoder för processutveckling uppströms.
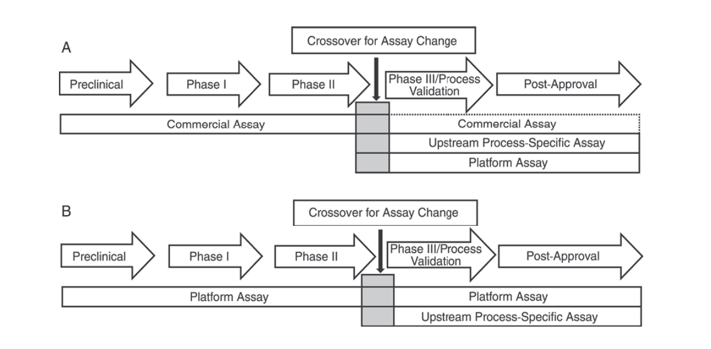
Figur 1. I USP <1132> föreslås olika stadier av produktutveckling att använda specifika metoder för att upptäcka HCP.
| Metod | Kommersiellt reagenssats | Produkt-/processspecifik upptäckt Utrustning | Plattformsdetektering Utrustning |
| Tillgänglighet | Lätt tillgänglig
| Kräver beredning av antigener, inklusive kloning av värdcellinjer
| Kräver beredning av antigener med nakna eller tomma vektorcellinjer
|
| Utveckling | Kräver minimal förberedelse | Detektionsutveckling inklusive antigenkarakterisering, immunisering och bekräftelse tar vanligtvis minst 6 månader | Detektionsutveckling inklusive antigenkarakterisering, immunisering och bekräftelse tar vanligtvis minst 9 månader |
| Mångfald | Begränsad till de vanligaste uttryckssystemen | Olika typer av uttryckssystem kan användas | Olika typer av uttryckssystem kan användas |
| Specificitet | Specificiteten kan vara dålig, med potentiella oupptäckta HCP
| Specificiteten förstärks vanligtvis, med antikroppstäckning inriktad på specifika HCP-mönster | Jämfört med kommersiella detektionsmetoder förbättras specificiteten, förståelsen för detektionsprestanda förbättras och täckningen av HCP-typer ökar också |
| Kosta | Initiala priser är relativt billiga, men utvecklingskostnaderna kommer snabbt att stiga för hela nedströmsreningen | Initiala kostnader är högre, men brytpunkten är vanligtvis till värdet av 100 uppsättningar reagenssatser | På grund av dess tillämpbarhet på flera produkter har den betydande kostnadsfördelar |
| Beroende | Beroende på en specifik leverantör är reagenser och kontrollscheman i en "svart låda". | Har omfattande kontroll över alla reagenser och buffertar, kan justeras när som helst | Har fullständigt ägande och kontroll över alla reagenser, vilket minskar riskerna i leveranskedjan och batchjämförbarhet |
| Regulatoriska krav | Inte lämplig för att stödja marknadsföring auktorisationsansökningar | Tillämplig för att stödja hela processen från tidig utveckling till marknadsföring av licensierade produkter | Gäller för att stödja tidig utveckling fram till marknadsföringstillstånd |
Tabell 1.Jämförelse av olika typer av HCP-reagenssatser
Yeasen Biotech Customized HCP Assay Development Service
Med tanke på betydelsen av HCP-detektering, Yeasen Biotech förlitar sig på en högpresterande plattform för utveckling av monoklonala antikroppar för att etablera plattformar för utveckling av kritiska råvaror för proteinantikroppar och ett oberoende laboratorium för produktutveckling för immundetektering, utrustat med avancerade forskningsinstrument såsom enzymimmunoanalysanalysatorer och 2D-WB dubbelriktade gelelektrofores-immunoblottingsystem. Utvecklingsplattformen är mycket mogen och kan snabbt anpassa HCP-analyssatser för olika värdcellsrester inklusive däggdjursceller, insektsceller (som Sf9), bakterier och jäst.
Anpassningstidslinje
Anpassningstjänsten för värdcellsrester för proteindetektion tar vanligtvis 6 till 10 månader.
Antigen-antikroppsberedning: Att bestämma HCP-antigener, upprätta HCP-referensstandarder, utforma immunvägar och strategier, bereda HCP-antikroppar, etc., tar vanligtvis 4 till 6 månader.
Utveckling av analyskit: Antikroppsoptimering, täckningsanalys, validering av analyskitmetod, etc., tar vanligtvis 2 till 4 månader.
Yeasen Biotech HCP Antibody Coverage Verification Service
Det är känt att ELISA är guldstandarden för att detektera kvarvarande HCP i industrin, men noggrannheten hos denna metod beror på täckningen av multiklonantikroppar mot HCP. United States Pharmacopeia och European Pharmacopeia nämner immunrening och 2D-WB som rekommenderade metoder för att karakterisera HCP ELISA-antikroppar och deras täckning.
HCP-antikroppstäckning Kontroll Service
2D-WB separerar först proteiner baserat på storlek och laddning med hjälp av tvådimensionell gelelektrofores, och överför sedan dessa proteiner till ett membran för inkubation med HCP-antikroppar för att detektera proteinavtryck.
Vi har en komplett uppsättning 2D-WB-instrumentering och omfattande laboratorieerfarenhet för att tillhandahålla antikroppstäckningsverifieringstjänster för HCP-prover från värdceller som CHO, E.coli, HEK293, etc.
Relaterad produkt:
| Produkt | Katalog nr. | Storlek |
| 36712ES | 48T/96T | |
| 36713ES | 48T/96T | |
| CHO HCP ELISA kit (CHO-K1) | 36714ES | 48T/96T |
| E.coli HCP ELISA Kit (plasmid) | 36721ES | 48T/96T |
