เมื่อผล qPCR ออกมาแปลก ๆ จะต้องทำอย่างไร?
การทดลอง qPCR อาจดูง่ายหรือบางครั้งก็ยาก หลังจากออกแบบไพรเมอร์เสร็จแล้ว จะมีการเติมตัวอย่าง qPCR ทีละขั้นตอนเหมือน PCR และทำการทดลองบนเครื่องได้ มีปัญหาทั่วไปหลายประการในการทดลอง qPCR โดยใช้สีย้อม และเมื่อพิจารณาจากสาเหตุและแนวทางแก้ไขที่เป็นไปได้ เราหวังว่าคุณจะสามารถใช้สิ่งเหล่านี้เพื่อแก้ไขปัญหาในการทดลอง qPCR ได้
1. qPCR คืออะไร?
2. กราฟขยาย qPCR ที่ผิดปกติ
3. กราฟการหลอมเหลวของ qPCR ที่ผิดปกติ
4. ข้อมูลการสั่งซื้อ
5. สินค้าที่เกี่ยวข้อง
6. เรื่องการอ่านหนังสือ
1. qPCR คืออะไร?
นับตั้งแต่มีการคิดค้นเทคนิคปฏิกิริยาลูกโซ่โพลีเมอเรส (PCR) PCR อาจเป็นเทคนิคที่ใช้กันอย่างแพร่หลายที่สุดในชีววิทยาโมเลกุลเนื่องจากความเรียบง่าย ราคาถูก ความน่าเชื่อถือ ความรวดเร็ว และความไวสูง qPCR เป็นเทคโนโลยีที่พัฒนาโดยเทคโนโลยี PCR ในระหว่างกระบวนการขยาย DNA วิธีการตรวจจับปริมาณผลิตภัณฑ์ทั้งหมดหลังจากแต่ละรอบ PCR ด้วยสีย้อมเรืองแสงไม่เพียงแต่มีความรวดเร็วและความไวของ PCR เท่านั้น แต่ยังมีความจำเพาะเจาะจงมากขึ้น รวมถึงการเฝ้าติดตามแบบเรียลไทม์ที่สูง การวัดปริมาณที่ทำซ้ำได้และแม่นยำ และข้อดีอื่นๆ qPCR เป็นเทคโนโลยีที่ใช้เครื่องขยายปริมาณ PCR แบบเรียลไทม์เชิงปริมาณ คือ เครื่องมือ qPCR เพื่อตรวจสอบผลิตภัณฑ์การขยายกรดนิวคลีอิกแบบเรียลไทม์ระหว่างกระบวนการ PCR qPCR ดำเนินการวิเคราะห์เชิงปริมาณของเทมเพลตเริ่มต้นผ่านการวิเคราะห์ค่า Ct และเส้นโค้งมาตรฐาน ในปี 1992 Higuchi ชาวญี่ปุ่นได้เสนอ "เทคโนโลยี PCR เชิงปริมาณเรืองแสงแบบเรียลไทม์" เป็นคนแรก ในปี 1996 บริษัท American Biological ได้เปิดตัวเครื่องมือ PCR เชิงปริมาณเรืองแสงเครื่องแรกของโลก ซึ่งประกอบด้วยระบบวงจรความร้อนของการขยาย PCR ระบบออปติกตรวจจับการเรืองแสง และซอฟต์แวร์คอมพิวเตอร์และแอปพลิเคชัน สามารถตรวจสอบผลิตภัณฑ์การขยายกรดนิวคลีอิกแบบเรียลไทม์ผ่านสีย้อมเรืองแสงหรือโพรบเรืองแสง โดยผ่านความสัมพันธ์ของฟังก์ชันทางคณิตศาสตร์ รวมกับซอฟต์แวร์สำหรับการวิเคราะห์ผลลัพธ์ การคำนวณปริมาณเทมเพลตเริ่มต้นของตัวอย่างที่จะทดสอบจึงเกิดขึ้นได้ ดังนั้น เทคโนโลยี PCR เชิงปริมาณเรืองแสงแบบเรียลไทม์จึงถูกใช้กันอย่างแพร่หลาย วิธีการติดฉลากเรืองแสงสำหรับ qPCR แบ่งออกเป็นวิธีโมเสกสีย้อมเรืองแสงตามวิธีสีย้อม SYBR Green I วิธีโพรบเรืองแสงตามวิธีโพรบ Taqman (Cycling Probe, Molecular Bracon เป็นต้น) วิธีไพรเมอร์สีย้อมดับ
การทดลอง qPCR อาจดูง่ายหรือบางครั้งก็ยาก หลังจากออกแบบไพรเมอร์เสร็จแล้ว จะเพิ่มตัวอย่าง qPCR ทีละขั้นตอนเหมือน PCR และทำการทดลองบนเครื่องได้ อย่างไรก็ตาม รายละเอียดเล็กๆ น้อยๆ หลายอย่างต้องใส่ใจ เช่น ไม่มีของเหลวแขวนบนผนังท่อ ไม่มีฟองอากาศในท่อ และความจำเป็นที่จะต้องลดการสัมผัสโดยตรงระหว่างผนังท่อ ฝาท่อ ฯลฯ เพื่อลดข้อผิดพลาดในการทดลองหรือผลการทดลองที่แปลกประหลาด Xiaoyi ได้รวบรวมปัญหาทั่วไปหลายประการในการทดลอง qPCR โดยใช้สีย้อม และให้สาเหตุและแนวทางแก้ไขที่เป็นไปได้ ซึ่งเราหวังว่าคุณจะใช้แก้ไขปัญหาในการทดลอง qPCR ได้
2. กราฟขยาย qPCR ที่ผิดปกติ
2.1 ความผิดปกติในเฟสพื้นฐานของกราฟลอการิทึมของเส้นโค้งการขยาย
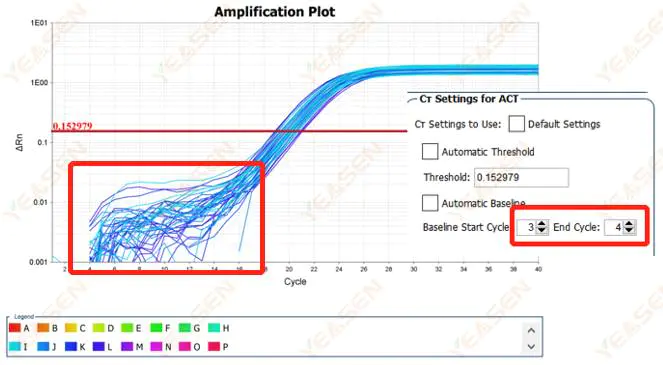
รูปที่ 1. กราฟการขยาย
สาเหตุที่เป็นไปได้:
การตั้งค่าพื้นฐานไม่ถูกต้อง
วิธีแก้ไข:
ขอแนะนำให้เพิ่มค่าปลายทางของเส้นฐานแผนภาพตัวอย่างการปรับปรุงมีดังนี้

รูปที่ 2. กราฟการขยาย
2.2 กราฟลอการิทึมการขยายกราฟการแบ่งส่วนกราฟ
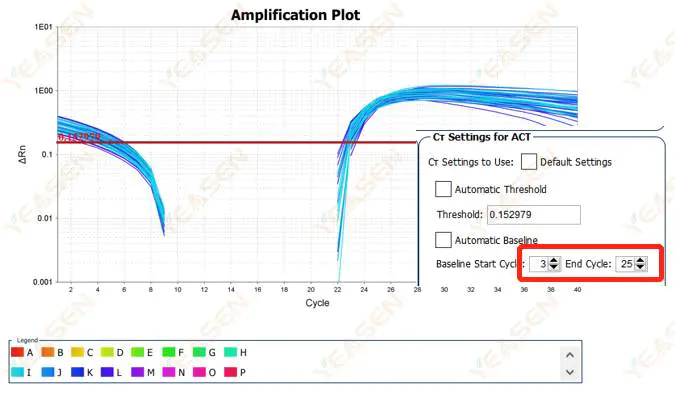
รูปที่ 3. กราฟการขยาย
สาเหตุที่เป็นไปได้:
เส้นฐานตั้งไว้สูงเกินไป
วิธีแก้ไข:
ขอแนะนำให้ลดค่าจุดสิ้นสุดของเส้นฐาน ตัวอย่างไดอะแกรมการปรับมีดังนี้
2.3 กราฟเส้นตรงของการขยายสัญญาณที่ไม่ราบรื่น
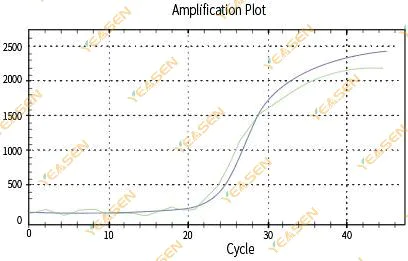
รูปที่ 4. กราฟการขยาย
สาเหตุที่เป็นไปได้:
1) ท่อปฏิกิริยา PCR ไม่ได้ปิดฝาให้แน่นและสารละลายปฏิกิริยาก็รั่วไหล
2)สารละลายปฏิกิริยา PCR แบบแขวนผนัง
3) เครื่องมือไม่ได้รับการสอบเทียบ (รวมถึงการสอบเทียบอัตโนมัติ หรือการสอบเทียบ ROX)
4) ระบบมีสารยับยั้งจำนวนมาก ทำให้เกิดการเรืองแสงที่ไม่เสถียร
5) การใช้งานเครื่องมือมากเกินไปส่งผลให้การรวบรวมฟลูออเรสเซนต์ไม่เสถียร
วิธีแก้ไข:
1) กดฝาครอบท่อให้แน่น
2) ผสมสารเคมีให้ทั่วและใส่ลงในเครื่องมือวัดปริมาณอย่างระมัดระวังหลังจากการปั่นเหวี่ยงจนเสร็จ
3)ปรับเทียบเครื่องมือ
4) ปรับปรุงความบริสุทธิ์ของ RNA และเลือกรีเอเจนต์การถอดรหัสย้อนกลับที่เหมาะสม
2.4 กราฟเส้นขยายโค้งซิกแซกที่ระดับราบ
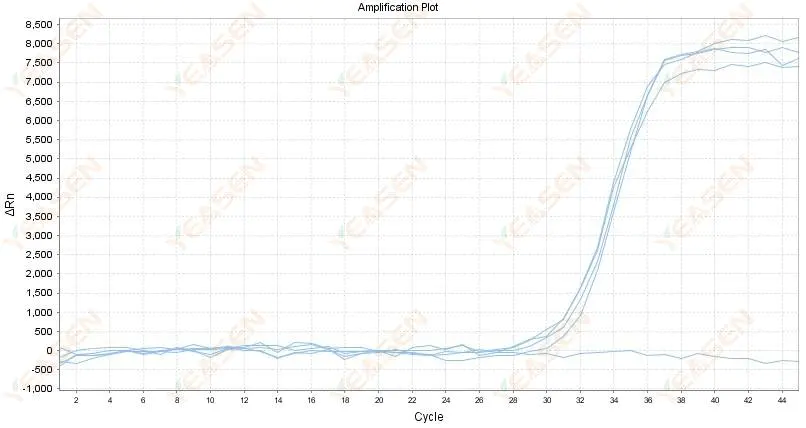
รูปที่ 5 กราฟการขยาย
สาเหตุที่เป็นไปได้:
1) ความบริสุทธิ์ของ RNA ไม่ดีและมีสิ่งเจือปนอยู่มาก
2) ใช้เครื่องดนตรีมานานเกินไป
วิธีแก้ไข:
1) การสกัด RNA คุณภาพสูงกลับมาอีกครั้ง
2) เจือจางเทมเพลต RNA เพื่อลดความเข้มข้นของสิ่งเจือปน
3) สอบเทียบเครื่องมือวัด
2.5 กราฟเส้นตรงของเส้นโค้งการขยายไม่สามารถไปถึงระดับคงที่ได้
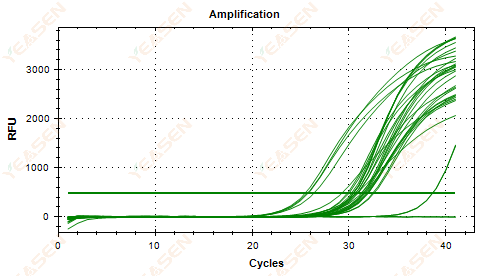
รูปที่ 6 กราฟการขยาย
สาเหตุที่เป็นไปได้:
1) ความเข้มข้นของเทมเพลตต่ำ (ค่า Ct ประมาณ 35)
2) รอบขยายเสียงน้อยเกินไป
3) ประสิทธิภาพการขยายรีเอเจนต์ต่ำ (Ct เล็กแต่ไม่สามารถไปถึงระดับคงที่ได้)
วิธีแก้ไข:
1) เพิ่มความเข้มข้นของเทมเพลต
2) เพิ่มจำนวนรอบ
3) เพิ่มแมกนีเซียม2+ ความเข้มข้น.
2.6 กราฟเส้นขยายความลาดเอียงของที่ราบสูง
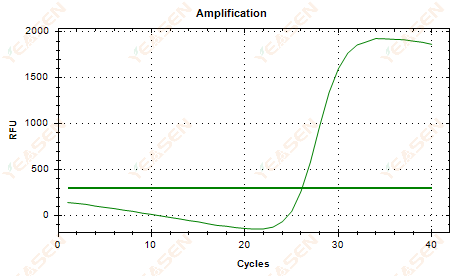
รูปที่ 7 กราฟการขยาย
สาเหตุที่เป็นไปได้:
1) การปรากฏตัวของความเสื่อมโทรม (ความเสื่อมโทรมของผลิตภัณฑ์ขยาย, ความเสื่อมโทรมของ SYBR)
2) ฝาหลอดทดลองไม่ได้รับการปิดอย่างถูกต้อง และสารเคมีก็ระเหยไป
3) ความเข้มข้นของ cDNA สูงเกินไป (หากค่า Ct ต่ำเกินไป เกณฑ์การเรืองแสงจะเพิ่มขึ้น และการหย่อนคล้อยจะรุนแรงมากขึ้น)
4) มีฟองอากาศอยู่ในท่อแล้วก็หายไป
วิธีแก้ไข:
1) ปรับปรุงความบริสุทธิ์ของระบบ
2) ลดปริมาณ cDNA (เจือจางเทมเพลต)
3) ลดค่าจุดสิ้นสุดของเส้นฐาน
2.7 ค่า Ct มีขนาดใหญ่ในเส้นโค้งการขยาย
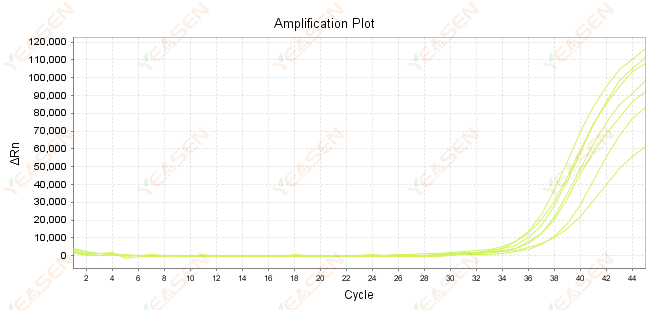
รูปที่ 8 กราฟการขยาย
สาเหตุที่เป็นไปได้:
1) จำนวนเทมเพลตน้อย
2) ประสิทธิภาพการขยายสัญญาณต่ำ
3) ชิ้นส่วน PCR ยาวเกินไป
4) การมีสารยับยั้งอยู่ในระบบปฏิกิริยา
วิธีแก้ไข:
1) ลดเวลาการเจือจางหรือเพิ่มปริมาณเทมเพลตให้ค่า Ct อยู่ระหว่าง 15 ถึง 30 ให้ได้มากที่สุด
2) ปรับปรุงเงื่อนไขปฏิกิริยา ลองใช้ขั้นตอนการขยายสามขั้นตอน หรือออกแบบไพรเมอร์ใหม่
3) ความยาวของผลิตภัณฑ์ PCR ออกแบบให้อยู่ระหว่าง 100 -150 bp ไม่แนะนำให้เกิน 300 bp
4) การผลิตซ้ำเทมเพลตที่มีความบริสุทธิ์สูง
2.8 ความสามารถในการทำซ้ำของเส้นโค้งการขยายสัญญาณไม่ดี
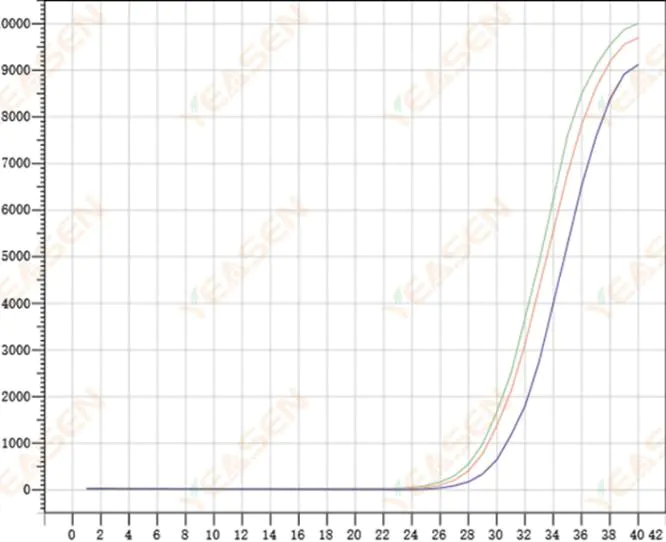
รูปที่ 9 กราฟการขยาย
สาเหตุที่เป็นไปได้:
1) ข้อผิดพลาดในการสไปก์ขนาดใหญ่
2) สารเคมีและระบบต่างๆ ยังไม่ผสมเข้ากันได้ดี
3) จำนวนสำเนาของ cDNA ต่ำ
4) ไม่ได้ใช้การสอบเทียบ Rox
วิธีแก้ไข:
1) การสอบเทียบปิเปต
2) การผสมระบบปฏิกิริยาอย่างทั่วถึง
3) ความเข้มข้นของเทมเพลตต่ำ ความสามารถในการทำซ้ำต่ำ หลุมผสม 4-6 หลุม และค่าที่เบี่ยงเบน 1-2 ค่าสามารถละทิ้งได้อย่างเหมาะสม
4) ควรใช้การปรับเทียบ Rox หากรีเอเจนต์ที่ใช้ไม่มี Rox จะต้องเลือกสีอ้างอิงเป็น None
2.9 เส้นโค้งการขยายแบบสุ่ม
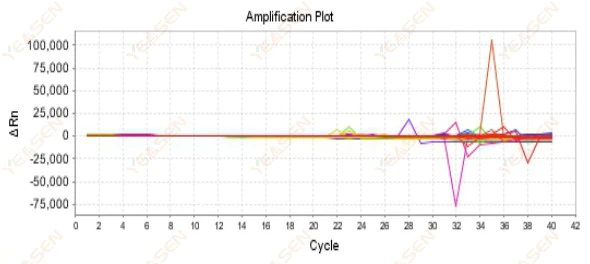
รูปที่ 10 กราฟการขยาย
สาเหตุที่เป็นไปได้:
ความไม่ตรงกันระหว่างความเข้มข้นของ Rox และแบบจำลอง
วิธีแก้ไข:
เปลี่ยนการตั้งค่าสีอ้างอิงบนเครื่องดนตรีจาก ROX เป็น NONE และดูว่าเส้นโค้งการขยายสัญญาณกลับมาเป็นปกติหรือไม่
2.10 พีคกิ้ง NTC
2.10.1 Ct>35, ค่า Tm ของเส้นโค้งการหลอมเหลว <80℃
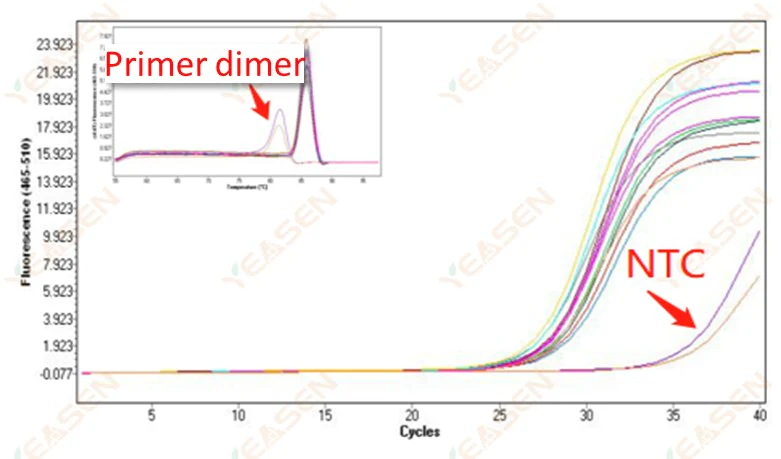
รูปที่ 11 กราฟการขยาย
สาเหตุที่เป็นไปได้:
ผลลัพธ์ของการสร้างไดเมอร์ของไพรเมอร์
วิธีแก้ไข:
ไพรเมอร์ที่ได้รับการเพิ่มประสิทธิภาพ
2.10.ค่า 2 Ct <35, กราฟการหลอมละลายของ NTC และกราฟการหลอมละลายของยีนทับซ้อนกัน
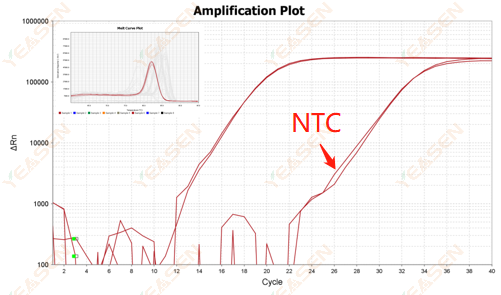
รูปที่ 12 กราฟการขยาย
สาเหตุที่เป็นไปได้:
การปนเปื้อนของระบบปฏิกิริยา
วิธีแก้ไข:
ตรวจสอบแหล่งกำเนิดมลพิษทีละแห่ง
3. กราฟการหลอมเหลวของ qPCR ที่ผิดปกติ
3.1 กราฟการหลอมละลายแบบจุดเดียวแต่ไม่คมชัด
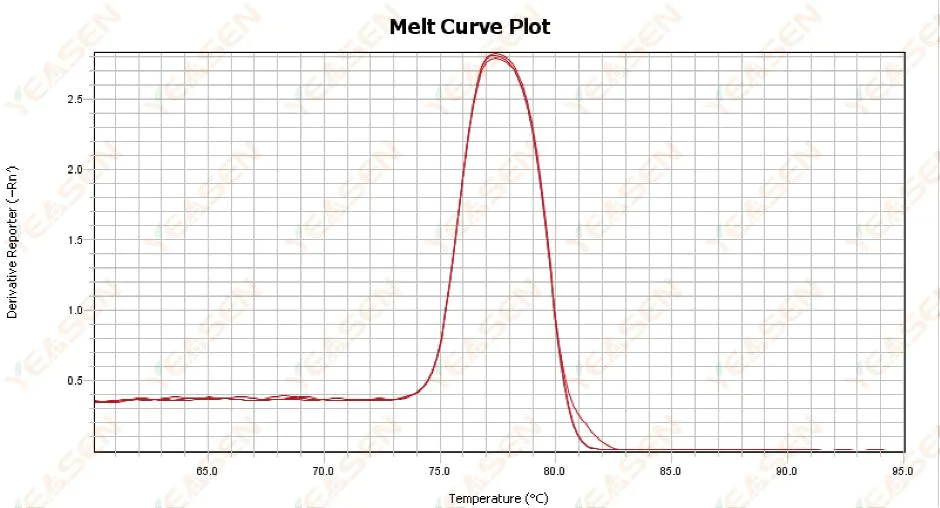
รูปที่ 13 กราฟเส้นโค้งการละลาย
สาเหตุที่เป็นไปได้:
1) มันเกี่ยวข้องกับองค์ประกอบของสารเคมีและแบบจำลองเครื่องมือ
2) การมีอยู่ของการขยายแบบไม่เฉพาะเจาะจงของชิ้นส่วนที่มีขนาดใกล้เคียงกัน
วิธีแก้ไข:
1) ช่วงอุณหภูมิตั้งแต่จุดเริ่มสูงสุดจนถึงจุดสิ้นสุดสูงสุดไม่สูงกว่า 7°C ผลลัพธ์ถือว่าใช้ได้ กล่าวคือ จุดสูงสุดครั้งเดียว
2) ดำเนินการอิเล็กโทรโฟรีซิสอะกาโรสที่มีความเข้มข้นสูง (เช่น อะกาโรส 3%) เพื่อช่วยในการกำหนด
3.2 เส้นโค้งการหลอมเหลวมีจุดสูงสุดสองเท่า และจุดสูงสุดที่ต่ำกว่า Tm อยู่ก่อนถึง 80°C
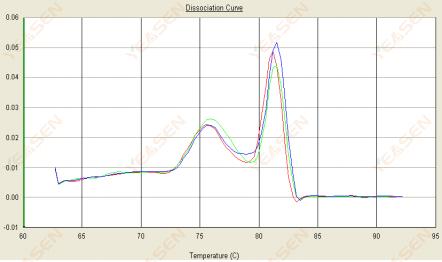
รูปที่ 14 กราฟเส้นความแตกแยก
สาเหตุที่เป็นไปได้:
การปรากฏตัวของไพรเมอร์ไดเมอร์
วิธีแก้ไข:
เพิ่มอุณหภูมิการอบ ลดความเข้มข้นของไพรเมอร์ หรือออกแบบไพรเมอร์ใหม่
3.3 เส้นโค้งการหลอมเหลวมีจุดยอดสองเท่า และจุดยอดต่ำสุด Tm อยู่หลังอุณหภูมิ 80°C
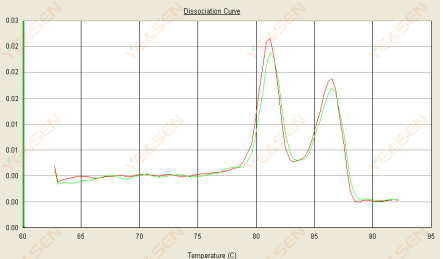
รูปที่ 15 เส้นโค้งการแยกตัว
สาเหตุที่เป็นไปได้:
1) ความจำเพาะของไพรเมอร์ที่ไม่ดีนำไปสู่การเพิ่มปริมาณผลิตภัณฑ์ที่ไม่เฉพาะเจาะจง
2) การปนเปื้อนของ gDNA
วิธีแก้ไข:
1) การตรวจสอบความเฉพาะของไพรเมอร์บลาสต์เช็ค ออกแบบใหม่หากไม่ดี
2) การยืนยันโดย NRC การควบคุมเชิงลบ หากมี จำเป็นต้องเตรียมเทมเพลตใหม่
3.4 จุดสูงสุดของเส้นโค้งการหลอมละลายที่ยุ่งเหยิง
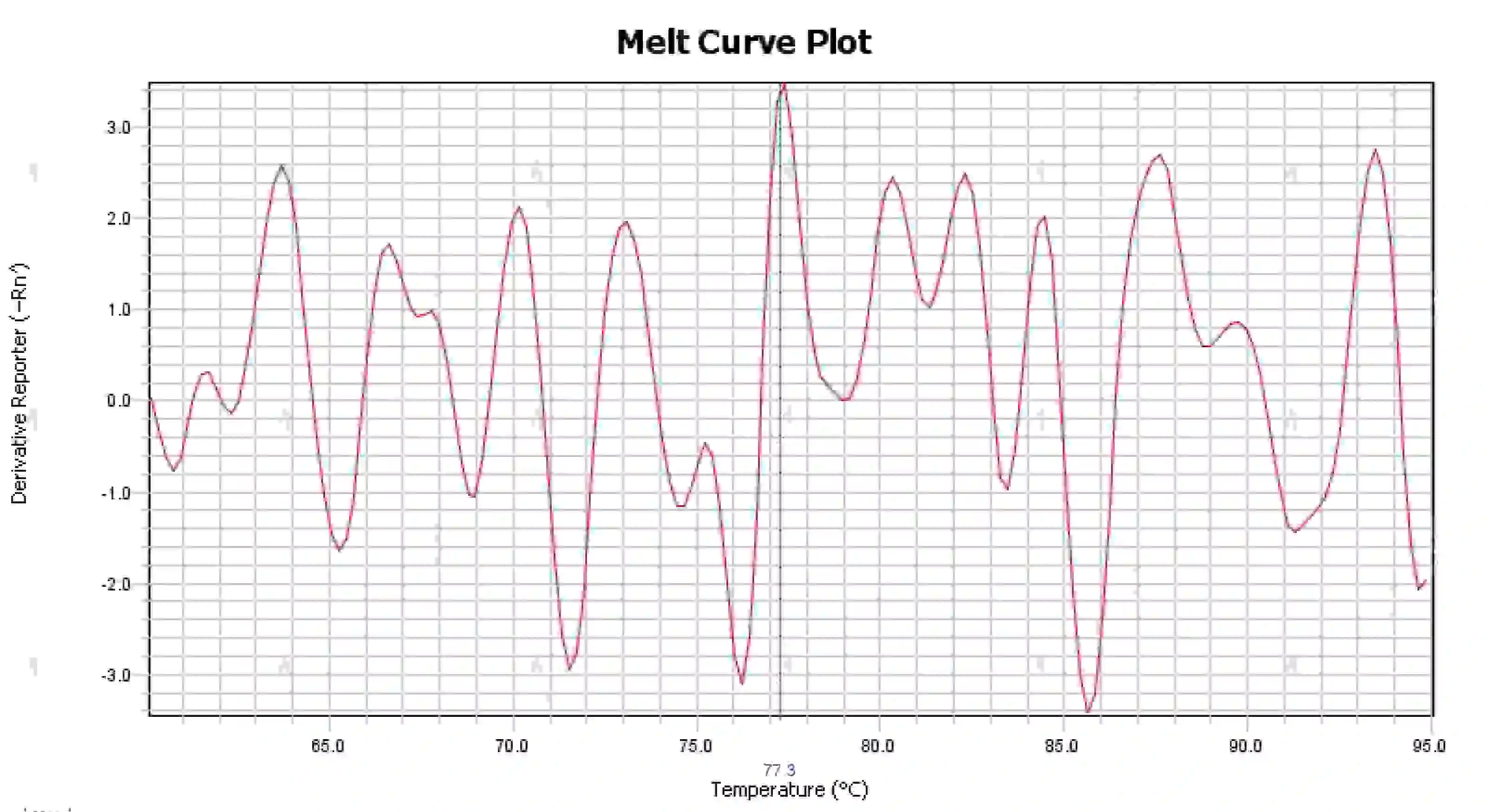
รูปที่ 16 กราฟเส้นโค้งการละลาย
สาเหตุที่เป็นไปได้:
1) การปนเปื้อนของระบบปฏิกิริยา
2) การสัมผัสของสารเคมีกับแสงสว่างหรืออุณหภูมิสูงอาจทำให้สารเคมีทำงานล้มเหลวได้
3) เครื่องมือไม่ได้รับการสอบเทียบมาเป็นเวลานานแล้ว
4) ความไม่ตรงกันระหว่างวัสดุสิ้นเปลืองและเครื่องมือ
วิธีแก้ไข:
1) การรวมผล NTC และ NRC เพื่อยืนยันการปนเปื้อน ขอแนะนำให้แยกการปนเปื้อนออกจากน้ำ ไพรเมอร์ เอนไซม์ และสิ่งแวดล้อมทีละอย่าง
2) ขอแนะนำให้ทำการทดลองเปรียบเทียบกับสารเคมีใหม่
3) ขอแนะนำให้บำรุงรักษาเครื่องมือสอบเทียบเป็นประจำ
4) ยืนยันข้อกำหนดของเครื่องมือที่เกี่ยวข้องกับวัสดุสิ้นเปลือง
3.5 จุดยอดปลอมที่ปลายด้านหน้าของเส้นโค้งการหลอมละลาย
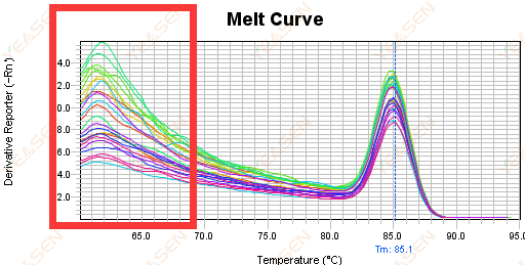
รูปที่ 17 กราฟเส้นโค้งการหลอมละลาย
สาเหตุที่เป็นไปได้:
ความเข้มข้นของ Rox ไม่ตรงกับแบบจำลอง
วิธีแก้ไข:
ขอแนะนำให้ยกเลิกการแก้ไข Rox เพื่อดูว่าเส้นโค้งการหลอมเหลวเป็นปกติหรือไม่
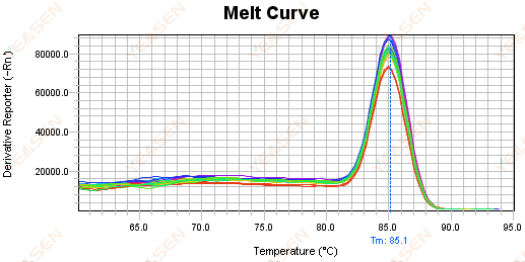
รูปที่ 18 กราฟเส้นโค้งการหลอมละลาย
4. ข้อมูลการสั่งซื้อ
ตารางที่ 1 ข้อมูลการสั่งซื้อ
| ชื่อสินค้า | รหัสสินค้า | ข้อมูลจำเพาะ |
| Hieff Unicon™ Universal Blue qPCR Master Mix (ตามสีย้อม) | 11184ES03 | 1 มล. |
| 11184ES08 | 5×1 มล. | |
| 11184ES50 | 50×1 มล. | |
| 11184ES60 | 100×1 มล. |
5. สินค้าที่เกี่ยวข้อง
ผลิตภัณฑ์ที่จัดทำโดย
ตารางที่ 2 สินค้าที่เกี่ยวข้อง
| การวางตำแหน่งผลิตภัณฑ์ | ชื่อสินค้า | รหัสสินค้า |
| การกำจัด gDNA ขั้นตอนเดียวและการถอดรหัสย้อนกลับ | การย่อย RT-gDNA แบบขั้นตอนเดียวของ Hifair™V SuperMix สำหรับ qPCR (สอบถามเพิ่มเติม- | 11142ES |
| มาสเตอร์มิกซ์ความไวสูง (พร้อมขั้นตอนการกำจัด gDNA) | Hifair™ III 1st Strand cDNA Synthesis SuperMix สำหรับ qPCR (gDNA digester plus) | 11141ES |
| ชุดความไวสูง (พร้อมขั้นตอนการลบ gDNA) | ชุดสังเคราะห์ cDNA Hifair™ III 1st Strand (gDNA digester plus) -สอบถามเพิ่มเติม- | 11139ES |
| มาสเตอร์มิกซ์เชิงปริมาณธรรมดา (วิธีโพรบ) | มาสเตอร์โพรบ TaqMan Probe Mix ของ Hieff™ qPCR -สอบถามเพิ่มเติม- | 11205ES |
6. เรื่องการอ่านหนังสือ
DNase I และการประยุกต์ใช้ในชีวการแพทย์
แนวทางการคัดเลือกเอนไซม์ทรานสคริปเทสย้อนกลับ
