
แนวคิดและความจำเป็นในการตรวจจับ HCP
ผลิตภัณฑ์ทางชีวภาพโดยทั่วไปผลิตขึ้นโดยใช้เทคโนโลยีรีคอมบิแนนท์ในเซลล์โฮสต์ (เช่น แบคทีเรีย ยีสต์ สัตว์เลี้ยงลูกด้วยนม แมลง หรือเซลล์พืช) รวมถึงแอนติบอดีโมโนโคลนัล โปรตีนรีคอมบิแนนท์ และวัคซีน กระบวนการผลิตและการทำให้บริสุทธิ์ของผลิตภัณฑ์เหล่านี้จะต้องมีโปรตีนเซลล์โฮสต์ (HCP) เข้ามาเป็นสารเจือปนอย่างหลีกเลี่ยงไม่ได้ ซึ่งรวมถึงโปรตีนโครงสร้างของเซลล์โฮสต์และปัจจัยการเจริญเติบโตที่หลั่งออกมาจากเซลล์โฮสต์ โดยก่อตัวเป็นส่วนผสมที่ซับซ้อนที่มีคุณสมบัติทางฟิสิกเคมีและภูมิคุ้มกันต่างๆ แม้จะใช้เทคนิคการทำให้บริสุทธิ์ขั้นสูง แต่โปรตีนเซลล์โฮสต์บางส่วนอาจยังคงอยู่เป็นสารเจือปนที่เกี่ยวข้องกับกระบวนการในผลิตภัณฑ์ยาขั้นกลาง
สิ่งเจือปนเหล่านี้มีศักยภาพในการสร้างภูมิคุ้มกันและอาจเพิ่มการตอบสนองทางภูมิคุ้มกันของผลิตภัณฑ์ทางชีวเภสัชกรรม ส่งผลต่อความเสถียรและประสิทธิผลของผลิตภัณฑ์ จึงก่อให้เกิดความเสี่ยงต่อความปลอดภัยของมนุษย์ ดังนั้น จึงจำเป็นต้องกำหนดกลยุทธ์การตรวจสอบที่เหมาะสมสำหรับการกำจัด HCP และต้องควบคุมเนื้อหาของ HCP ในผลิตภัณฑ์ขั้นสุดท้ายเพื่อให้เป็นไปตามข้อกำหนดด้านคุณภาพของยา
ข้อกำหนดด้านกฎระเบียบสำหรับ HCP
โดยทั่วไปแล้ว ปริมาณสารตกค้างของ HCP ในผลิตภัณฑ์ทางชีวภาพถือเป็นคุณลักษณะคุณภาพที่สำคัญ (CQA) ของผลิตภัณฑ์ เป็นดัชนีประเมินที่สำคัญสำหรับการติดตามความทนทานของกระบวนการ และเป็นดัชนีควบคุมคุณภาพที่สำคัญของผลิตภัณฑ์ หน่วยงานกำกับดูแลในประเทศต่างๆ มีข้อกำหนดเกี่ยวกับ HCP โดยกำหนดให้วิเคราะห์และทำให้บริสุทธิ์ผลิตภัณฑ์ทางชีวเภสัชเพื่อลด HCP ของโปรตีนเซลล์โฮสต์ให้เหลือระดับที่ยอมรับได้ ระดับการยอมรับของ HCP จะได้รับการประเมินตามสถานการณ์เฉพาะและขึ้นอยู่กับปัจจัยหลายประการ รวมถึงขนาดยา ความถี่ในการให้ยา ประเภทของยา และความรุนแรงของโรค
ตำรายาจีน (ฉบับปี 2020) กำหนดไว้ว่า สำหรับเซลล์ CHO ปริมาณ HCP ที่เหลือจะต้องน้อยกว่า 0.05% (เทียบเท่ากับน้อยกว่า 500 ppm) สำหรับ E. coli ปริมาณ HCP ที่เหลือจะต้องน้อยกว่า 0.01%
บท USP <1132> ของเภสัชตำรับสหรัฐอเมริกา ระบุว่า ควรใช้วิธีที่มีความไวสูงเพื่อตรวจหา HCP ในยา และปริมาณควรอยู่ต่ำกว่าขีดจำกัดการตรวจจับ (โดยทั่วไปจะน้อยกว่า 100 ppm นั่นคือ ปริมาณ HCP ในโปรตีนรวม 1 มก. ควรน้อยกว่า 100 นาโนกรัม หรือ <0.01%)
European Pharmacopoeia EP 2.6.34 ระบุว่า: ในผลิตภัณฑ์ทางชีวภาพ ปริมาณของ HCP ควรน้อยกว่า 0.1%
แนวปฏิบัติการประชุมนานาชาติว่าด้วยการประสานข้อกำหนดทางเทคนิคสำหรับการลงทะเบียนยาสำหรับใช้ในมนุษย์ (ICH): ICH Q6B ระบุว่าควรใช้วิธีการที่ละเอียดอ่อนและผ่านการตรวจสอบเพื่อตรวจสอบ HCP ที่เหลือ โดยโดยทั่วไปปริมาณที่เหลือต้องน้อยกว่า 100 ppm
จะเห็นได้ว่าหน่วยงานกำกับดูแลมีข้อกำหนดสำหรับ HCP ที่สอดคล้องกันอย่างมาก การพัฒนาขั้นตอนของผลิตภัณฑ์ทางชีวภาพต้องผ่านการตรวจจับ HCP แสดงให้เห็นว่ากระบวนการทำให้บริสุทธิ์สามารถลด HCP ให้เหลือระดับที่ปลอดภัยได้ และขีดจำกัดที่แนะนำสำหรับเนื้อหาตกค้างในผลิตภัณฑ์ขั้นสุดท้ายอยู่ต่ำกว่า 0.01% ทั้งในประเทศจีนและสหรัฐอเมริกา
วิธีการตรวจจับ HCP
ปัจจุบัน วิธี Enzyme-Linked Immunosorbent Assay (ELISA) เป็นวิธีที่ใช้กันทั่วไปที่สุดในการตรวจหา HCP วิธีการตรวจหาสารตกค้างของโปรตีนโฮสต์ที่กล่าวถึงในบทที่ 3412/3413/3414 ของตำรายาจีนฉบับปี 2020 ล้วนเป็นวิธี ELISA
บท USP <1132> ของเภสัชตำรับสหรัฐอเมริกายังระบุด้วยว่าสามารถใช้วิธีการต่างๆ เช่น อิเล็กโตรโฟเรซิส ELISA และ LC-MS/MS เพื่อตรวจหาเนื้อหา HCP และ ELISA ได้รับการแนะนำให้ใช้เป็นวิธีการตรวจจับ HCP เนื่องจากใช้งานง่าย มีความรวดเร็ว มีความไวสูง และมีปริมาณงานสูง
เอลิซ่า:
วัตถุประสงค์: ตรวจจับปริมาณโปรตีนทั้งหมดใน HCP สามารถใช้สำหรับการพัฒนาผลิตภัณฑ์และการควบคุมกระบวนการ และปัจจุบันเป็นวิธีการทั่วไปในการตรวจจับ HCP
ข้อดี: ความไวและความจำเพาะสูง ความสามารถในการประมวลผลสูงและอัตโนมัติ เชิงปริมาณ การทำงานที่ง่ายและรวดเร็ว
ข้อเสีย : ต้องใช้แอนติบอดีที่เฉพาะเจาะจง ไม่สามารถระบุและประเมิน HCP แต่ละตัวได้อย่างเฉพาะเจาะจง การพัฒนาวิธีมีความซับซ้อน ต้องมีการเตรียมแอนติเจนเป็นพิเศษ ปัจจัยที่มีอิทธิพลต่อวิธีการนี้หลายประการ จำเป็นต้องมีการประเมินการครอบคลุมของ HCP ไม่สามารถระบุสายพันธุ์ได้

เวสเทิร์นบล็อต:
วัตถุประสงค์: ใช้ในการคัดกรองตัวอย่างจำนวนมากอย่างสม่ำเสมอและตรวจหาโปรตีนที่ไม่รู้จักซึ่งทำปฏิกิริยากับแอนติบอดีต่อ HCP เหมาะสำหรับตรวจหา HCP และให้ข้อมูลโดยประมาณเกี่ยวกับน้ำหนักโมเลกุลสัมพันธ์ของ HCP
ข้อดี: ความจำเพาะ ผลลัพธ์สามารถเข้าใจได้ด้วยสายตา: แสดงความแตกต่างของขนาดโปรตีนและระดับการแสดงออก สามารถตรวจจับและระบุปริมาณ HCP เฉพาะได้
ข้อเสีย : กึ่งเชิงปริมาณ; จำกัดเฉพาะโปรตีนเฉพาะ: สามารถตรวจจับ HCP ที่จับกับแอนติบอดีเท่านั้น; ไม่ไวพอสำหรับส่วนผสมโปรตีนที่ซับซ้อน; การเปลี่ยนแปลงโครงสร้าง SDS ของโปรตีนอาจนำไปสู่การสูญเสียเอพิโทปเชิงโครงร่าง; ความไวขึ้นอยู่กับคุณภาพของแอนติบอดีโพลีโคลนัล
การวิเคราะห์ด้วยเจลอิเล็กโทรโฟเรซิสสองมิติ (2-DE):

วัตถุประสงค์: โดยทั่วไปจะใช้สำหรับการพัฒนาและการกำหนดลักษณะกระบวนการต้นน้ำหรือปลายน้ำ โดยสามารถแยกแยะ HCP ต่างๆ บนเจลตัวเดียวได้
ข้อดี: ไม่จำเป็นต้องใช้การบล็อตแบบเวสเทิร์น จึงหลีกเลี่ยงปัญหาการถ่ายโอน สามารถแยกปริมาณร่องรอยของสิ่งเจือปน HCP ออกจากผลิตภัณฑ์ได้ ให้ข้อมูลโดยประมาณเกี่ยวกับน้ำหนักโมเลกุลสัมพันธ์และจุดไอโซอิเล็กทริก
ข้อเสีย : โปรตีนที่มากเกินไปอาจปกปิดจุด HCP ได้ การกระจายตัวของ HCP ในตัวอย่างสามารถสังเกตได้ แต่ไม่สามารถระบุปริมาณได้

การวิเคราะห์มวลสาร:
วัตถุประสงค์: ระบุ HCP แต่ละตัวโดยให้ข้อมูลการระบุและการวัดปริมาณที่แม่นยำสำหรับโปรตีนของเซลล์โฮสต์
ข้อดี: ความละเอียดและความแม่นยำสูง ระบุและตรวจสอบ HCP แต่ละตัว ให้สเปกตรัมของ HCP ที่ครอบคลุม สามารถครอบคลุมโปรตีนได้หลากหลาย สามารถระบุสายพันธุ์ HCP ได้
ข้อเสีย : อุปกรณ์และความต้องการทางเทคนิคสูง การดำเนินการที่ซับซ้อน ต้นทุนสูง ปริมาณงานที่ทำได้ต่ำ การเตรียมตัวอย่างล่วงหน้าที่ซับซ้อน ผลกระทบต่อเมทริกซ์ที่อาจเกิดขึ้น ต้องใช้ความสามารถในการวิเคราะห์ข้อมูลเฉพาะทาง
ELISA เป็นวิธีที่แนะนำสำหรับการตรวจหา HCP ที่เหลือในผลิตภัณฑ์ทางชีวภาพโดยเภสัชตำรายาในประเทศต่างๆ ซึ่งสามารถระบุปริมาณ HCP ทั้งหมดได้ อย่างไรก็ตาม ELISA มีข้อจำกัดในการระบุประเภทและปริมาณของ HCP และจำเป็นต้องใช้วิธีอื่นเสริม วิธีการตรวจหาแต่ละวิธีมีข้อดีและข้อเสีย และในการใช้งานจริง สามารถเลือกได้ตามวัตถุประสงค์ในการทดลอง ลักษณะของตัวอย่าง ความแม่นยำ และความสะดวกในการใช้งาน รวมถึงปัจจัยอื่นๆ ร่วมกับการใช้วิธีการต่างๆ เพื่อให้ได้ผลลัพธ์ที่ครอบคลุมและแม่นยำยิ่งขึ้น
นอกจากนี้ ตำรายา USP <1132> ของสหรัฐอเมริกาและตำรายา EP 2.6.34 ของยุโรป ระบุว่าควรใช้รีเอเจนต์ ELISA ที่แตกต่างกันสำหรับการตรวจหา HCP ในขั้นตอนต่างๆ ของการพัฒนาผลิตภัณฑ์ โดยแบ่งประเภทวิธีการตรวจหา HCP ออกเป็นรีเอเจนต์เชิงพาณิชย์ วิธีเฉพาะผลิตภัณฑ์/กระบวนการ และวิธีเฉพาะแพลตฟอร์ม
USP <1132> ระบุว่า ในกรณีที่ไม่มีวิธีแพลตฟอร์ม สามารถใช้รีเอเจนต์เชิงพาณิชย์ในการทดลองทางคลินิกก่อนทางคลินิก ในระยะที่ 1 และระยะที่ 2 ได้ ในการทดลองทางคลินิก/การตรวจสอบกระบวนการในระยะที่ 3 และผลิตภัณฑ์หลังการตลาด เนื่องด้วยข้อจำกัด เช่น การครอบคลุมแอนติบอดีไม่เพียงพอของรีเอเจนต์ตรวจจับ HCP ทั่วไปในเชิงพาณิชย์ ควรพิจารณาปัจจัย เช่น ชนิดของเซลล์และความจำเพาะของกระบวนการ โดยใช้วิธีแพลตฟอร์มหรือวิธีเฉพาะผลิตภัณฑ์/กระบวนการสำหรับการพัฒนาขั้นตอนต้นน้ำ
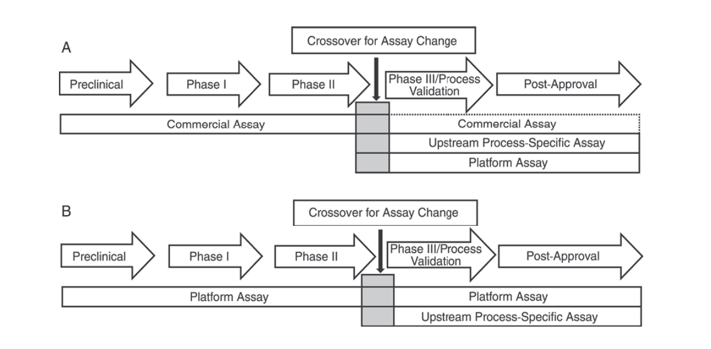
รูปที่ 1 ใน USP <1132> แนะนำให้ใช้วิธีเฉพาะในการตรวจจับ HCP ในแต่ละขั้นตอนของการพัฒนาผลิตภัณฑ์
| วิธี | ชุดน้ำยาเชิงพาณิชย์ | การตรวจจับเฉพาะผลิตภัณฑ์/กระบวนการ ชุด | การตรวจจับแพลตฟอร์ม ชุด |
| ความพร้อมจำหน่าย | พร้อมใช้งาน
| ต้องมีการเตรียมแอนติเจน รวมถึงการโคลนสายเซลล์โฮสต์
| ต้องเตรียมแอนติเจนโดยใช้เซลล์เวกเตอร์แบบเปลือยหรือเปล่า
|
| การพัฒนา | ต้องการการเตรียมการขั้นต่ำ | การพัฒนาการตรวจจับรวมทั้งการกำหนดลักษณะของแอนติเจน การสร้างภูมิคุ้มกัน และการยืนยันโดยปกติจะใช้เวลาอย่างน้อย 6 เดือน | การพัฒนาการตรวจจับรวมทั้งการกำหนดลักษณะของแอนติเจน การสร้างภูมิคุ้มกัน และการยืนยันโดยปกติจะใช้เวลาอย่างน้อย 9 เดือน |
| ความหลากหลาย | จำกัดเฉพาะระบบการแสดงออกที่พบมากที่สุด | ระบบการแสดงออกหลากหลายประเภทสามารถนำมาใช้ได้ | ระบบการแสดงออกหลากหลายประเภทสามารถนำมาใช้ได้ |
| ความเฉพาะเจาะจง | ความจำเพาะอาจไม่ดี โดยอาจมี HCP ที่ตรวจไม่พบ
| โดยปกติแล้วความจำเพาะจะได้รับการเสริมด้วยการครอบคลุมของแอนติบอดีที่กำหนดเป้าหมายรูปแบบ HCP ที่เฉพาะเจาะจง | เมื่อเปรียบเทียบกับวิธีการตรวจจับเชิงพาณิชย์ ความจำเพาะได้รับการปรับปรุง ความเข้าใจเกี่ยวกับประสิทธิภาพการตรวจจับได้รับการปรับปรุง และการครอบคลุมประเภท HCP ก็เพิ่มขึ้นเช่นกัน |
| ค่าใช้จ่าย | ราคาเริ่มต้นค่อนข้างถูก แต่ต้นทุนการพัฒนาจะเพิ่มขึ้นอย่างรวดเร็วสำหรับกระบวนการทำให้บริสุทธิ์ปลายน้ำทั้งหมด | ต้นทุนเริ่มต้นจะสูงกว่า แต่จุดคุ้มทุนมักจะอยู่ที่มูลค่าชุดรีเอเจนต์ 100 ชุด | เนื่องจากสามารถนำไปใช้กับผลิตภัณฑ์ได้หลายประเภท จึงมีข้อได้เปรียบด้านต้นทุนที่สำคัญ |
| การพึ่งพาอาศัย | ขึ้นอยู่กับซัพพลายเออร์เฉพาะ สารเคมี และแผนการควบคุมจะอยู่ในสถานะ "กล่องดำ" | มีการควบคุมที่ครอบคลุมสำหรับสารเคมีและบัฟเฟอร์ทั้งหมด สามารถปรับได้ตลอดเวลา | เป็นเจ้าของและควบคุมสารเคมีทั้งหมดอย่างครบถ้วน ลดความเสี่ยงในห่วงโซ่อุปทานและเปรียบเทียบชุดผลิตภัณฑ์ได้ |
| ข้อกำหนดด้านกฎระเบียบ | ไม่เหมาะสำหรับการสนับสนุนการตลาด ใบสมัครอนุญาต | สามารถใช้ได้เพื่อรองรับกระบวนการทั้งหมดตั้งแต่การพัฒนาขั้นต้นจนถึงการทำตลาดผลิตภัณฑ์ที่ได้รับอนุญาต | ใช้ได้สำหรับรองรับการพัฒนาในระยะเริ่มต้นจนถึงการอนุญาตการตลาด |
ตารางที่ 1.การเปรียบเทียบชุดน้ำยา HCP ชนิดต่างๆ
Yeasen บริการพัฒนาการทดสอบ HCP ที่กำหนดเองสำหรับเทคโนโลยีชีวภาพ
เมื่อพิจารณาถึงความสำคัญของการตรวจจับ HCP
ไทม์ไลน์การปรับแต่ง
การบริการปรับแต่งสำหรับชุดตรวจจับโปรตีนที่เหลือจากเซลล์โฮสต์มักใช้เวลา 6 ถึง 10 เดือน
การเตรียมแอนติเจน-แอนติบอดี: การกำหนดแอนติเจน HCP การกำหนดมาตรฐานอ้างอิง HCP การออกแบบเส้นทางและกลยุทธ์ทางภูมิคุ้มกัน การเตรียมแอนติบอดี HCP เป็นต้น โดยทั่วไปใช้เวลา 4 ถึง 6 เดือน
การพัฒนาชุดทดสอบ: การเพิ่มประสิทธิภาพของแอนติบอดี การวิเคราะห์การครอบคลุม การตรวจสอบวิธีของชุดทดสอบ ฯลฯ โดยทั่วไปใช้เวลา 2 ถึง 4 เดือน
Yeasen บริการตรวจสอบความครอบคลุมของแอนติบอดีของ Biotech HCP
เป็นที่ทราบกันดีว่า ELISA เป็นมาตรฐานทองคำสำหรับการตรวจหา HCP ที่เหลือในอุตสาหกรรม แต่ความแม่นยำของวิธีนี้ขึ้นอยู่กับการครอบคลุมของแอนติบอดีโคลนหลายตัวต่อ HCP เภสัชตำรับของสหรัฐอเมริกาและเภสัชตำรับของยุโรปกล่าวถึงการทำให้บริสุทธิ์ภูมิคุ้มกันและ 2D-WB เป็นวิธีการที่แนะนำสำหรับการกำหนดลักษณะของแอนติบอดี ELISA ของ HCP และการครอบคลุมของแอนติบอดีเหล่านี้
การครอบคลุมแอนติบอดี HCP การตรวจสอบ บริการ
ขั้นแรก 2D-WB จะแยกโปรตีนตามขนาดและประจุโดยใช้อิเล็กโทรโฟเรซิสเจลสองมิติ จากนั้นจึงถ่ายโอนโปรตีนเหล่านี้ไปที่เมมเบรนเพื่อฟักกับแอนติบอดี HCP เพื่อตรวจจับการพิมพ์โปรตีน
เรา มีชุดเครื่องมือ 2D-WB ครบชุดและประสบการณ์ห้องปฏิบัติการอันกว้างขวางเพื่อให้บริการการตรวจสอบการครอบคลุมแอนติบอดีสำหรับตัวอย่าง HCP จากเซลล์โฮสต์ เช่น CHO, E.coli, HEK293 เป็นต้น
สินค้าที่เกี่ยวข้อง:
| ผลิตภัณฑ์ | เลขที่แคตตาล็อก | ขนาด |
| 36712ES | 48T/96T | |
| 36713ES | 48T/96T | |
| ชุดตรวจ ELISA CHO HCP (CHO-K1) | 36714ES | 48T/96T |
| ชุดทดสอบ ELISA ของ E.coli HCP (พลาสมิด) | 36721ES | 48T/96T |
