qPCR sonuçları tuhaf olduğunda ne yapmalı?
qPCR deneyleri kolay ve bazen zor hissedilebilir. Primer tasarımı tamamlandıktan sonra, PCR gibi adım adım qPCR örnekleri eklenir ve deney makinede tamamlanabilir. Boya yöntemiyle qPCR deneylerinde birkaç yaygın sorun vardır ve olası nedenler ve çözümler verildiğinde, bunları qPCR deneylerindeki sorunları çözmek için kullanabileceğinizi umuyoruz.
1. qPCR nedir?
2. Anormal qPCR amplifikasyon eğrisi
3. Anormal qPCR erime eğrisi
4. Sipariş Bilgileri
5. İlgili Ürünler
6. Okuma ile ilgili
1. qPCR nedir?
Polimeraz zincir reaksiyonu tekniği (PCR) icat edildiğinden beri, PCR muhtemelen basitliği, ucuzluğu, güvenilirliği, hızı ve yüksek hassasiyeti nedeniyle moleküler biyolojide en yaygın kullanılan tekniktir. qPCR, PCR teknolojisi tarafından geliştirilen bir teknolojidir. DNA amplifikasyon süreci sırasında, floresan boyalarla her PCR döngüsünden sonra toplam ürün miktarını tespit etme yöntemi yalnızca PCR'nin hızına ve hassasiyetine sahip olmakla kalmaz, aynı zamanda daha fazla özgüllüğe ve Yüksek, gerçek zamanlı izleme, tekrarlanabilir ve doğru kantifikasyona ve diğer avantajlara da sahiptir. qPCR, PCR süreci sırasında nükleik asit amplifikasyon ürünlerini gerçek zamanlı olarak izlemek için bir Kantitatif Gerçek Zamanlı PCR amplifikasyon cihazı, yani bir qPCR cihazı kullanan bir teknolojidir. qPCR, Ct değeri ve standart eğrinin analizi yoluyla başlangıç şablonunun kantitatif analizini gerçekleştirir. 1992'de Japon Higuchi ilk olarak "gerçek zamanlı floresan kantitatif PCR teknolojisini" önerdi. 1996 yılında, American Biological Company, PCR amplifikasyon termal çevrim sistemi, floresan algılama optik sistemi ve bilgisayar ve uygulama yazılımından oluşan dünyanın ilk floresan kantitatif PCR cihazını piyasaya sürdü. Floresan boyalar veya floresan problar aracılığıyla nükleik asit amplifikasyon ürünlerini gerçek zamanlı olarak izleyebilir. Sonuç analizi için yazılımla birleştirilen matematiksel fonksiyon ilişkisi aracılığıyla, test edilecek numunenin başlangıç şablon miktarının hesaplanması gerçekleştirilir. Bu nedenle, gerçek zamanlı floresan kantitatif PCR teknolojisi yaygın olarak kullanılmıştır. qPCR için floresan etiketleme yöntemleri, SYBR Green I boya yöntemine dayalı floresan boya mozaik yöntemi, Taqman prob yöntemine (Cycling Probe, Molecular Bracon, vb.) dayalı floresan prob yöntemi, söndürücü boya astar yöntemi olarak ayrılır.
qPCR deneyleri kolay ve bazen zor hissedilebilir. Primer tasarımı tamamlandıktan sonra, PCR gibi adım adım qPCR örnekleri eklenir ve deney makinede tamamlanabilir. Ancak, boru duvarında sıvı asılı olmaması, boruda kabarcık olmaması ve deneysel hataları veya garip deneysel sonuçları azaltmak için boru duvarı, boru kapağı vb. arasındaki doğrudan temasın en aza indirilmesi gerektiği gibi birçok küçük ayrıntıya dikkat edilmesi gerekir. Xiaoyi, boya yöntemiyle qPCR deneylerindeki birkaç yaygın sorunu derledi ve olası nedenleri ve çözümleri verdi; bunları qPCR deneylerindeki sorunları çözmek için kullanabileceğinizi umuyoruz.
2. Anormal qPCR amplifikasyon eğrisi
2.1 Amplifikasyon eğrisinin logaritmik grafiğinin temel fazındaki anormallikler
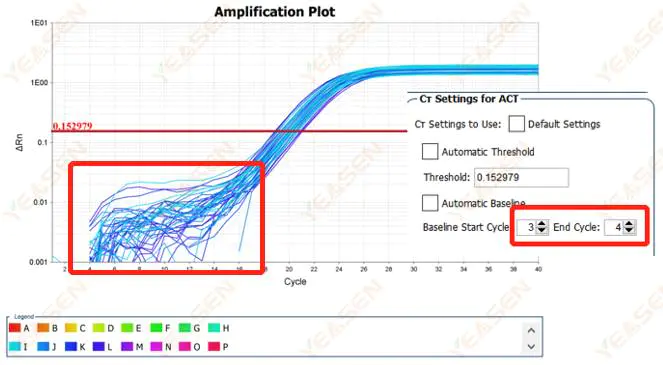
Şekil 1. Amplifikasyon Grafiği
Olası nedenler:
Uygunsuz temel ayarı.
Çözümler:
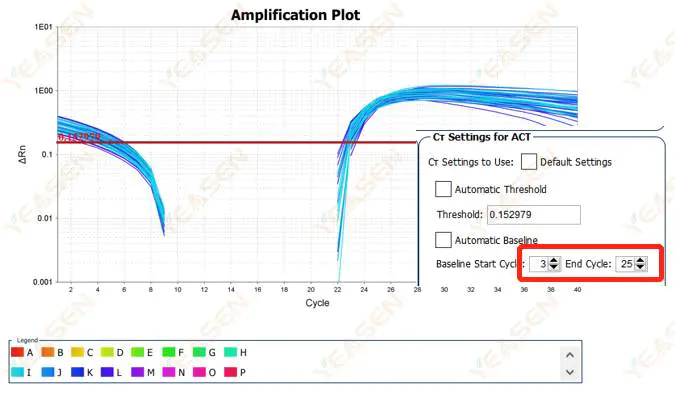
Bazal değerin uç nokta değerinin artırılması önerilir.Ayarlama örneği diyagramı aşağıdaki gibidir.

Şekil 2. Amplifikasyon Grafiği
2.2 Amplifikasyon eğrisi logaritmik çizim eğri segmentasyonu
Şekil 3. Amplifikasyon Grafiği
Olası nedenler:
Taban çizgisi çok yüksek ayarlanmış.
Çözümler:
Taban çizgisinin uç nokta değerinin azaltılması önerilir. Ayarlama örnek diyagramı aşağıdaki gibidir.
2.3 Pürüzsüz olmayan amplifikasyon eğrisi doğrusallık grafiği
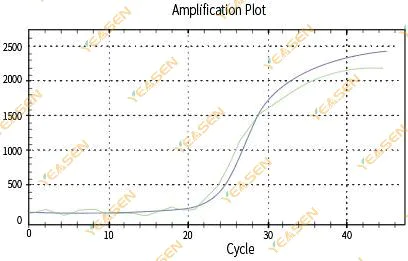
Şekil 4. Amplifikasyon Grafiği
Olası nedenler:
1) PCR reaksiyon tüpünün kapağı sıkıca kapatılmadığından reaksiyon çözeltisi sızdı.
2)Asılı duvarlı PCR reaksiyon çözeltisi.
3)Cihaz kalibre edilmemiştir (otomatik kalibrasyon veya ROX kalibrasyonu dahil).
4) Sistemde çok sayıda inhibitör bulunduğundan, floresans kararsızdır.
5)Cihazın aşırı kullanımı kararsız floresan toplanmasına neden olur.
Çözümler:
1)Boru kapağını sıkıca bastırın.
2)Reaktifi iyice karıştırın ve tam santrifüjlemeden sonra dikkatlice kantitatif cihaza koyun.
3)Cihazı kalibre edin.
4)RNA saflığını artırın ve uygun ters transkripsiyon reaktiflerini seçin.
2.4 Yükseltilmiş eğri doğrusal grafik bir platoda zikzak şeklindedir
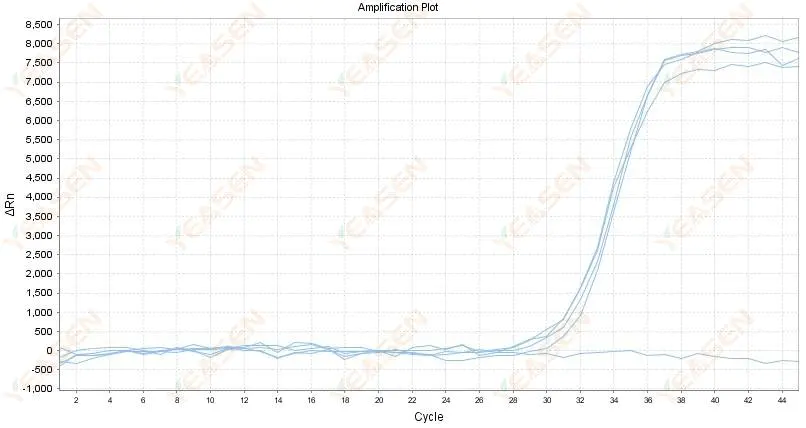
Şekil 5. Amplifikasyon Grafiği
Olası nedenler:
1) RNA'nın saflığı düşüktür ve çok sayıda safsızlık vardır.
2) Alet çok uzun süre kullanılıyor.
Çözümler:
1) Yüksek kaliteli RNA'yı tekrar çıkarın.
2) Kirlilik konsantrasyonunu azaltmak için RNA şablonunu seyreltin.
3) Cihazı kalibre edin.
2.5 Amplifikasyon eğrisinin doğrusal çizimi bir platoya ulaşamıyor
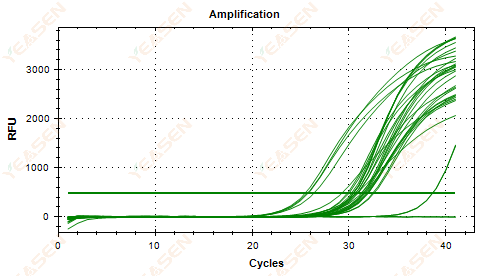
Şekil 6. Amplifikasyon Grafiği
Olası nedenler:
1) Düşük şablon konsantrasyonu (Ct değeri yaklaşık 35).
2) Çok az amplifikasyon çevrimi.
3) Reaktif amplifikasyonunun etkinliği düşüktür (küçük Ct, ancak platoya ulaşamamaktadır).
Çözümler:
1) Şablonun konsantrasyonunu artırın.
2) Döngü sayısını artırın.
3) Artan Mg2+ Konsantrasyon.
2.6 Amplifikasyon eğrisi doğrusal çizim plato sarkması
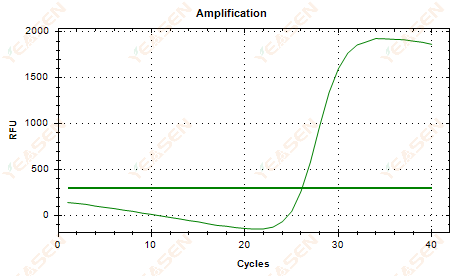
Şekil 7. Amplifikasyon Grafiği
Olası nedenler:
1) Bozunmanın varlığı (amplifikasyon ürünü bozunması, SYBR bozunması).
2) Tüp kapağı düzgün kapatılmamış ve reaktif uçmuş.
3) cDNA konsantrasyonu çok yüksektir (eğer Ct değeri çok küçükse, floresan eşiği yükselir ve sarkma daha şiddetli olur).
4) Tüpün içinde hava kabarcıkları oluşuyor, sonra kayboluyorlar.
Çözümler:
1) Sistem saflığını artırın.
2) cDNA miktarını azaltın (şablonu seyreltin).
3) Taban çizgisinin uç nokta değerini azaltın.
2.7 Amplifikasyon eğrisinde Ct'nin büyük değeri
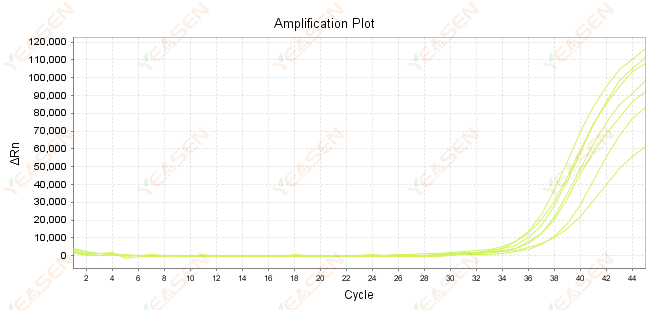
Şekil 8. Amplifikasyon Grafiği
Olası nedenler:
1) Şablon sayısı az.
2) Düşük amplifikasyon verimliliği.
3) PCR fragmanı çok uzun.
4) Reaksiyon sisteminde inhibitörlerin varlığı.
Çözümler:
1) Seyreltme sürelerini kısaltın veya şablon miktarını arttırın, böylece Ct değeri mümkün olduğunca 15 ile 30 arasına düşsün.
2) Reaksiyon koşullarını optimize edin, üç adımlı bir amplifikasyon prosedürü deneyin veya primerleri yeniden tasarlayın.
3) PCR ürün uzunluğunun 100-150 bp aralığında olması amaçlanmaktadır, 300 bp’yi aşması önerilmemektedir.
4) Daha yüksek saflıktaki şablonların çoğaltılması.
2.8 Amplifikasyon eğrilerinin zayıf tekrarlanabilirliği
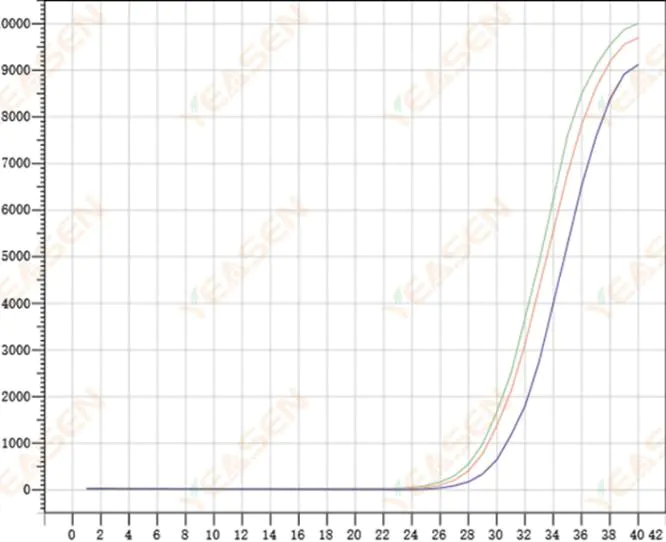
Şekil 9. Amplifikasyon Grafiği
Olası nedenler:
1) Büyük sivri uç hataları.
2) Reaktifler ve sistemler iyi karıştırılmamış.
3) cDNA'nın kopya sayısı düşüktür.
4) Rox kalibrasyonu kullanılmadı.
Çözümler:
1) Pipetlerin kalibrasyonu.
2) Reaksiyon sisteminin iyice karıştırılması.
3) Düşük şablon konsantrasyonu, zayıf tekrarlanabilirlik, 4-6 bileşik delik ve daha büyük değerlerin 1-2 sapması uygun şekilde elenebilir.
4) Rox kalibrasyonunu kullanmak en iyisidir. Kullanılan reaktif Rox içermiyorsa, referans boyanın Hiçbiri olarak seçilmesi gerekir.
2.9 Rastgele amplifikasyon eğrileri
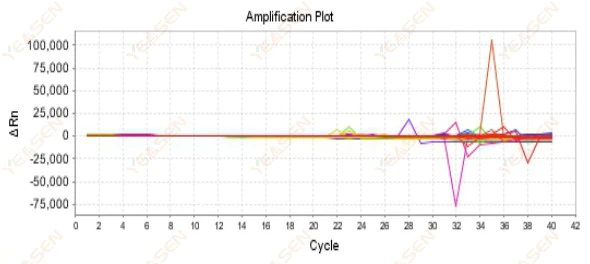
Şekil 10. Amplifikasyon Grafiği
Olası nedenler:
Rox konsantrasyonu ile model arasındaki uyumsuzluk.
Çözümler:
Cihazdaki referans boya ayarını ROX'tan NONE'a getirin ve amplifikasyon eğrisinin normale dönüp dönmediğine bakın.
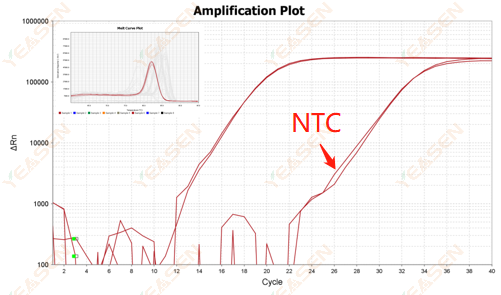
2.10 NTC Tepe Noktası
2.10.1 Ct>35, erime eğrisi Tm değeri <80℃
Şekil 11. Amplifikasyon Grafiği
Olası nedenler:
Primer dimerizasyon sonuçları.
Çözümler:
Optimize edilmiş primerler.
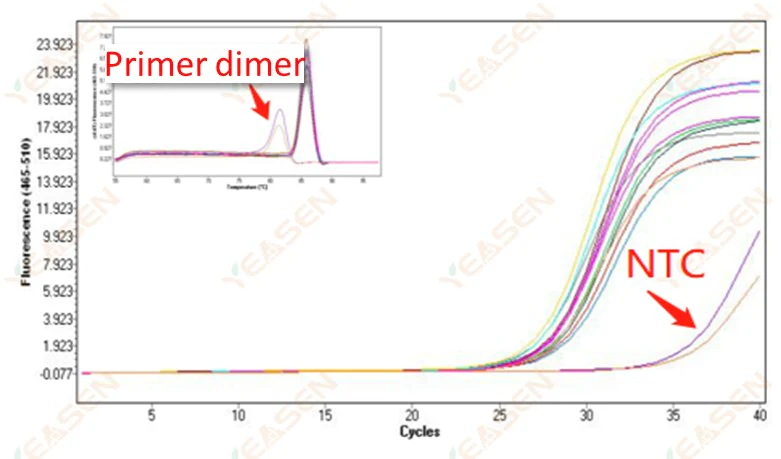
2.10.2 Ct değeri <35, NTC erime eğrisi ve gen erime eğrisi tepe şekli örtüşmesi
Şekil 12. Amplifikasyon Grafiği
Olası nedenler:
Reaksiyon sisteminin kirlenmesi.
Çözümler:
Kirlilik kaynaklarını tek tek kontrol edin.
3. Anormal qPCR erime eğrisi
3.1 Tek tepe erime eğrisi var ama keskin değil
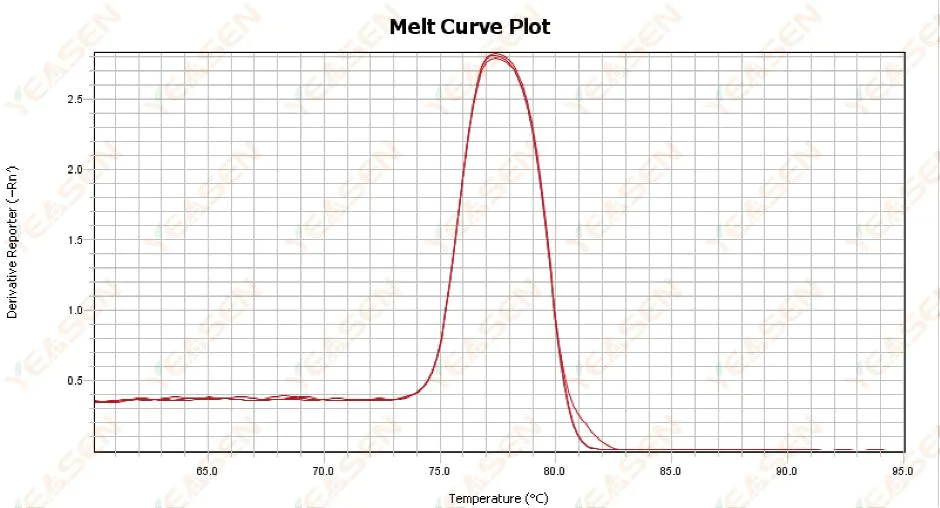
Şekil 13. Erime Eğrisi Grafiği
Olası nedenler:
1) Reaktif bileşimi ve cihaz modeli ile ilgilidir.
2) Benzer büyüklükteki parçaların spesifik olmayan amplifikasyonunun varlığı.
Çözümler:
1) Pik başlangıcından pik sonuna kadar sıcaklık aralığı 7°C'den yüksek değildir. Sonuçlar kullanılabilir, yani tek pik olarak kabul edilir.
2) Tayini kolaylaştırmak için yüksek konsantrasyonlu agaroz elektroforezi (örneğin %3 agaroz) yapıldı.
3.2 Erime eğrisi çift tepelidir ve alt tepe Tm 80°C'den öncedir
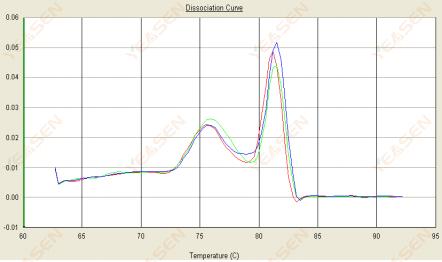
Şekil 14. Ayrışma Eğrisi
Olası nedenler:
Primer dimerlerin varlığı.
Çözümler:
Tavlama sıcaklığını artırın, primer konsantrasyonunu azaltın veya primerleri yeniden tasarlayın.
3.3 Erime eğrisi çift tepelidir ve en düşük tepe Tm 80°C'den sonradır
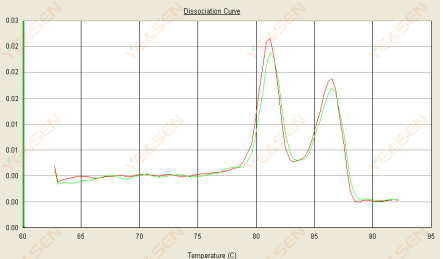
Şekil 15. Ayrışma Eğrisi
Olası nedenler:
1) Primer özgüllüğünün düşük olması, özgül olmayan ürünlerin çoğalmasına yol açar.
2) gDNA kontaminasyonu.
Çözümler:
1) Astarın özgüllüğünü patlatarak kontrol edin, zayıfsa yeniden tasarlayın.
2) NRC negatif kontrolü ile teyit edilmesi durumunda şablonun yeniden hazırlanması gerekir.
3.4 Dağınık erime eğrisi tepeleri
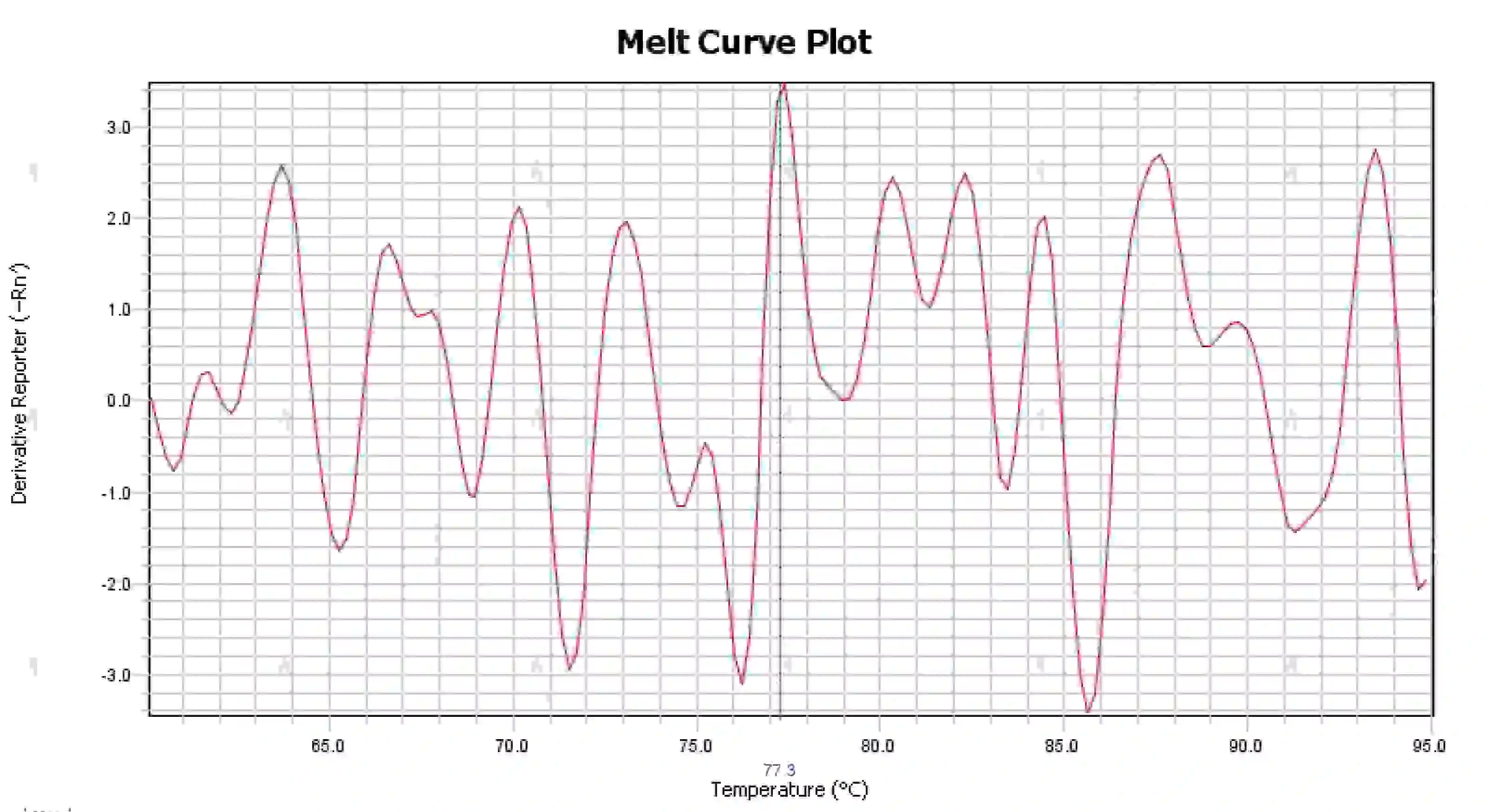
Şekil 16. Erime Eğrisi Grafiği
Olası nedenler:
1) Reaksiyon sisteminin kirlenmesi.
2) Reaktiflerin parlak ışığa veya yüksek sıcaklığa maruz kalması reaktifin bozulmasına yol açar.
3) Uzun süredir cihaz kalibre edilmemiş.
4) Sarf malzemeleri ile enstrümanlar arasında uyumsuzluk.
Çözümler:
1) Kontaminasyonu doğrulamak için NTC ve NRC sonuçları birleştirilerek, su, primerler, enzimler ve çevre kaynaklı kontaminasyonların tek tek dışlanması önerilmektedir.
2) Yeni reaktiflerle karşılaştırma deneyleri yapılması önerilir.
3) Düzenli olarak cihaz kalibrasyon bakımı yapılması önerilir.
4) Sarf malzemeleri için ilgili enstrümanın gereksinimlerini teyit edin.
3.5 Erime eğrisinin ön ucundaki sahte tepeler
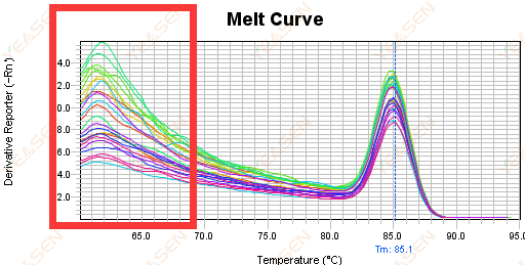
Şekil 17. Erime Eğrisi Grafiği
Olası nedenler:
Rox konsantrasyonu modele uymuyor.
Çözümler:
Erime eğrisinin normal olup olmadığını görmek için Rox düzeltmesinin iptal edilmesi önerilir.
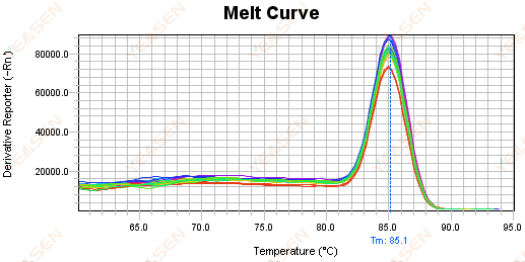
Şekil 18. Erime Eğrisi Grafiği
4. Sipariş Bilgileri
Tablo 1. Sipariş Bilgileri
| Ürün Adı | Ürün Kodu | Şartname |
| Hieff Unicon™ Universal Blue qPCR Master Mix (Boya Bazlı) | 11184ES03 | 1 ml |
| 11184ES08 | 5×1 ml | |
| 11184ES50 | 50×1ml | |
| 11184ES60 | 100×1 mL |
5. İlgili Ürünler
Yeasen’in sağladığı ürünler aşağıdaki gibidir.
Tablo 2. İlgili Ürünler
| Ürün Konumlandırma | Ürün Adı | Ürün Kodu |
| Tek adımda gDNA çıkarılması ve ters transkripsiyon | Hifair™V tek adımlı RT-gDNA sindirimi qPCR için SuperMix (Sorgu) | 11142ES |
| Yüksek Hassasiyetli Ana Karışım (gDNA çıkarma adımıyla) | Hifair™ III 1. Zincir cDNA Sentezi qPCR için SüperMix (gDNA sindirici artı) | 11141ES |
| Yüksek Hassasiyet Kiti (gDNA çıkarma adımıyla) | Hifair™ III 1. Zincir cDNA Sentez Kiti (gDNA sindirici artı) (Sorgu) | 11139ES |
| Sıradan nicel ana karışım (araştırma yöntemi) | Hieff™ qPCR TaqMan Probu Ana Karışımı (Sorgu) | 11205ES |
6. Okuma ile ilgili
DNase I ve Biyomedikal Uygulamaları
Ters Transkriptaz Seçiminin Kılavuzu
