Yeasen Biotechnology'nin Ticari HCP Reaktif Kiti, HCP tespiti için basit, son derece hassas ve objektif bir yöntemdir. Yeasen Biotechnology, numunelerdeki kalıntı HCP seviyelerini hassas bir şekilde tespit edebilen birden fazla reaktif kiti bağımsız olarak geliştirmiştir. Bu reaktif kitleri, biyofarmasötiklerin saflaştırma sürecini optimize etmek, ara proseslerdeki safsızlıkları kontrol etmek ve nihai ürünlerin serbest bırakılma testlerini yapmak için kullanılabilir. Yeasen Biotechnology'nin HCP reaktif kitlerinin biyofarmasötik üretiminizi nasıl iyileştirebileceği hakkında daha fazla bilgi edinmek ister misiniz? Okuyun makaleyi şimdi okuyun!

HCP Tespiti Kavramı ve Gerekliliği
Biyolojik ürünler genellikle konak hücrelerinde (bakteri, maya, memeli, böcek veya bitki hücreleri gibi) rekombinant teknoloji kullanılarak üretilir ve bunlara monoklonal antikorlar, rekombinant proteinler ve aşılar dahildir. Bu ürünlerin üretim ve saflaştırma süreçleri kaçınılmaz olarak konak hücre proteinlerini (HCP'ler) hem konak hücrelerin yapısal proteinlerini hem de konak hücreler tarafından salgılanan büyüme faktörlerini içeren safsızlıklar olarak ortaya çıkarır ve çeşitli fizikokimyasal ve immünolojik özelliklere sahip karmaşık bir karışım oluşturur. Gelişmiş saflaştırma tekniklerinin kullanılmasına rağmen bazı konak hücre proteinleri ara ilaç ürünlerinde hala işlemle ilgili safsızlıklar olarak kalabilir.
Bu safsızlıklar potansiyel immünojeniteye sahiptir ve biyofarmasötik ürünlerin immün yanıtını artırabilir, stabilitelerini ve etkinliklerini etkileyerek insan güvenliği için risk oluşturabilir. Bu nedenle, HCP'lerin uzaklaştırılması için uygun izleme stratejilerinin oluşturulması ve nihai üründeki HCP içeriğinin ilaç kalitesi gereksinimlerini karşılayacak şekilde kontrol edilmesi gerekir.
Sağlık Çalışanları için Düzenleyici Gereklilikler
Biyolojik ürünlerdeki HCP'lerin kalıntı içeriği genellikle ürünün kritik kalite niteliği (CQA), süreç sağlamlığı izleme için önemli bir değerlendirme endeksi ve ürünün temel kalite kontrol endeksi olarak kabul edilir. Çeşitli ülkelerdeki düzenleyici otoriteler, konak hücre protein HCP'lerini kabul edilebilir seviyelere düşürmek için biyofarmasötiklerin analizini ve saflaştırılmasını gerektiren HCP'lerle ilgili hükümlere sahiptir. HCP'lerin kabul seviyesi, belirli koşullara göre değerlendirilecek ve doz, doz sıklığı, ilaç türü ve hastalık şiddeti gibi çeşitli faktörlere bağlıdır.
Çin Farmakopesi (2020 edisyonu) şunu şart koşmaktadır: CHO hücreleri için, kalan HCP'nin <%0,05 (500 ppm'den az eşdeğer) olması gerekir; E. coli için, kalan HCP'nin <%0,01 olması gerekir.
Amerika Birleşik Devletleri Farmakopesi USP <1132> bölümü şunları belirtir: İlaçlardaki HCP'leri tespit etmek için son derece hassas bir yöntem kullanılmalı ve içerik tespit sınırının altında olmalıdır (genellikle 100 ppm'den az, yani 1 mg toplam proteindeki HCP içeriği 100 ng'den az veya %0,01'den az olmalıdır).
Avrupa Farmakopesi EP 2.6.34'te şu ifade yer almaktadır: Biyolojik ürünlerde HCP içeriği %0,1'den az olmalıdır.
İnsan Kullanımına Yönelik İlaçların Kaydına İlişkin Teknik Gereksinimlerin Uyumlaştırılmasına Dair Uluslararası Konferans (ICH) yönergeleri: ICH Q6B, kalan sağlık personeli miktarlarının izlenmesi için hassas ve doğrulanmış yöntemlerin benimsenmesi gerektiğini ve kalan miktarın genellikle 100 ppm'den az olması gerektiğini belirtmektedir.
Düzenleyici kurumların HCP'ler için oldukça tutarlı gereksinimleri olduğu görülebilir. Biyolojik ürünlerin proses geliştirmesi HCP tespitinden geçmeli, saflaştırma prosesinin HCP'leri güvenli seviyelere düşürebileceğini göstermeli ve hem Çin'de hem de Amerika Birleşik Devletleri'nde son üründeki kalıntı içeriği için önerilen sınırlar %0,01'in altındadır.
HCP Tespit Yöntemleri
Enzim Bağlantılı İmmünosorbent Testi (ELISA) şu anda HCP tespiti için en yaygın kullanılan yöntemdir. Çin Farmakopesi'nin 2020 baskısının 3412/3413/3414. Bölümlerinde belirtilen konak protein kalıntısı tespit yöntemlerinin hepsi ELISA yöntemleridir.
Amerika Birleşik Devletleri Farmakopesi USP <1132> bölümünde ayrıca elektroforez, ELISA ve LC-MS/MS gibi yöntemlerin HCP içeriğini tespit etmek için kullanılabileceği ve ELISA'nın kullanım kolaylığı, hızı, yüksek hassasiyeti ve yüksek verimi nedeniyle HCP tespiti için tercih edilen yöntem olarak önerildiği belirtilmektedir.
ELİSA:
Amaç: HCP'lerdeki toplam protein miktarını tespit eder, ürün geliştirme ve proses kontrolünde kullanılabilir ve günümüzde HCP'leri tespit etmek için yaygın olarak kullanılan bir yöntemdir.
Avantajları: Yüksek hassasiyet ve özgüllük; Yüksek verim ve otomasyon kabiliyeti; Kantitatif; Kolay ve hızlı kullanım.
Dezavantajları: Belirli antikorlar gerektirir; Bireysel HCP'leri özel olarak tanımlayıp değerlendiremez; Yöntem geliştirme karmaşıktır ve özel antijen hazırlanmasını gerektirir; Yöntemi etkileyen birçok faktör vardır, HCP kapsamının değerlendirilmesi gerekir; Türler tanımlanamaz.

Western Blot:
Amaç: Çok sayıda örneğin tutarlı bir şekilde taranması ve anti-HCP antikorlarıyla reaksiyona giren bilinmeyen proteinlerin tespiti için kullanılır. HCP'leri tespit etmek ve HCP'lerin bağıl moleküler ağırlığı hakkında yaklaşık bilgi sağlamak için uygundur.
Avantajları: Özgüllük; Sonuçlar görsel olarak sezgiseldir: Protein boyutu ve ifade seviyelerindeki farklılıkları görselleştirir; Belirli HCP'leri tespit edebilir ve miktarını belirleyebilir.
Dezavantajları: Yarı-kantitatif; Belirli proteinlerle sınırlıdır: Sadece antikorlara bağlı HCP'leri tespit edebilir; Karmaşık protein karışımları için yeterince hassas değildir; Protein SDS denatürasyonu konformasyonel epitopların kaybına yol açabilir; Duyarlılık poliklonal antikorların kalitesine bağlıdır.
İki Boyutlu Jel Elektroforezi (2-DE):

Amaç: Genellikle yukarı veya aşağı akış proses geliştirme ve karakterizasyonu için kullanılır ve tek bir jel üzerindeki farklı HCP'leri ayırt edebilir.
Avantajları: Western blotting'e gerek kalmadığı için transfer sorunları ortadan kalkar; Üründen eser miktarda HCP safsızlıkları ayrılabilir; Bağıl molekül ağırlığı ve izoelektrik nokta hakkında yaklaşık bilgi sağlar.
Dezavantajları: Aşırı protein HCP lekelerini maskeleyebilir; HCP'lerin numunedeki dağılımı gözlemlenebilir, ancak miktarı belirlenemez.

Kütle Spektrometrisi Analizi:
Amaç: Bireysel HCP'leri tanımlayarak konak hücre proteinleri için doğru tanımlama ve kantifikasyon bilgisi sağlar.
Avantajları: Yüksek çözünürlük ve doğruluk; Bireysel HCP'leri tanımlar ve izler; HCP'lerin kapsamlı spektrumlarını sağlar; Geniş bir protein yelpazesini kapsayabilir; HCP türlerini tanımlayabilir.
Dezavantajları: Yüksek ekipman ve teknik gereksinimler; Karmaşık operasyon; Yüksek maliyet; Düşük yöntem verimliliği; Karmaşık numune ön işlemi; Potansiyel matris etkileri; Özel veri analizi yetenekleri gerektirir.
ELISA, çeşitli ülkelerde farmakopeler tarafından biyolojik ürünlerdeki kalıntı HCP'leri tespit etmek için önerilen yöntemdir ve toplam HCP miktarını belirleyebilir. Ancak, HCP'lerin türlerini ve bolluğunu belirlemede sınırlamaları vardır ve diğer yöntemlerle desteklenmesi gerekir. Her tespit yönteminin avantajları ve dezavantajları vardır ve pratik uygulamalarda, daha kapsamlı ve doğru sonuçlar elde etmek için farklı yöntemlerin kullanımıyla birlikte deneysel amaçlar, örnek özellikleri, doğruluk ve operasyonel kolaylık gibi diğer faktörlere göre seçim yapılabilir.
Ek olarak, Amerika Birleşik Devletleri Farmakopesi USP <1132> ve Avrupa Farmakopesi EP 2.6.34. KONAK HÜCRE PROTEİN TESTLERİ, ürün geliştirmenin farklı aşamalarında HCP tespiti için farklı ELISA reaktiflerinin kullanılması gerektiğini belirterek, HCP tespit yöntemlerini ticari reaktifler, ürün/işlem özelinde yöntemler ve platform yöntemleri olarak kategorize eder.
USP <1132>, platform yöntemlerinin bulunmaması durumunda, ticari reaktiflerin klinik öncesi, Faz I ve Faz II klinik çalışmalarda kullanılabileceğini; Faz III klinik çalışmalarda/süreç doğrulamasında ve pazarlama sonrası üründe, ticari genel HCP tespit reaktiflerinin yetersiz antikor kapsamı gibi sınırlamalar nedeniyle, hücre tipi ve süreç özgüllüğü gibi faktörlerin dikkate alınması, yukarı akış süreç geliştirme için platform yöntemlerinin veya ürün/süreç özgül yöntemlerin kullanılması gerektiğini belirtmektedir.
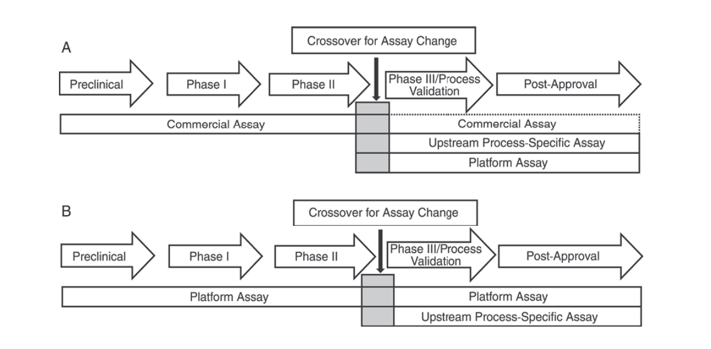
Şekil 1. USP <1132>'de, HCP'leri tespit etmek için belirli yöntemlerin kullanılması için ürün geliştirmenin farklı aşamaları önerilmektedir.
| Yöntem | Ticari Reaktif Kiti | Ürün/Süreç Spesifik Tespiti Kit | Platform Algılama Kit |
| Mevcutluk | Kolayca temin edilebilir
| Konak hücre hatlarının klonlanması da dahil olmak üzere antijenlerin hazırlanmasını gerektirir
| Çıplak veya boş vektör hücre hatları kullanılarak antijenlerin hazırlanmasını gerektirir
|
| Gelişim | Minimum hazırlık gerektirir | Antijen karakterizasyonu, aşılama ve doğrulama dahil olmak üzere tespit geliştirme genellikle en az 6 ay sürer | Antijen karakterizasyonu, aşılama ve doğrulama dahil olmak üzere tespit geliştirme genellikle en az 9 ay sürer |
| Çeşitlilik | En yaygın ifade sistemleriyle sınırlıdır | Çeşitli ifade sistemleri kullanılabilir | Çeşitli ifade sistemleri kullanılabilir |
| Özgüllük | Spesifiklik zayıf olabilir, potansiyel olarak tespit edilemeyen HCP'ler olabilir
| Spesifiklik genellikle antikor kapsamının belirli HCP modellerini hedeflemesiyle artar | Ticari tespit yöntemleriyle karşılaştırıldığında, özgüllük artırılmış, tespit performansına ilişkin anlayış geliştirilmiş ve HCP türlerinin kapsamı da artırılmıştır |
| Maliyet | Başlangıç fiyatları nispeten ucuzdur, ancak tüm alt akış arıtma süreci için geliştirme maliyetleri hızla artacaktır | Başlangıç maliyetleri daha yüksektir, ancak denge noktası genellikle 100 set reaktif kiti değerindedir | Birden fazla ürüne uygulanabilirliği nedeniyle önemli maliyet avantajlarına sahiptir |
| Bağımlılık | Belirli bir tedarikçiye bağlı olarak reaktifler ve kontrol şemaları "kara kutu" durumundadır. | Tüm reaktifler ve tamponlar üzerinde kapsamlı kontrole sahiptir, her an ayarlanabilir | Tüm reaktifler üzerinde tam mülkiyet ve kontrole sahip olarak tedarik zincirindeki riskleri ve parti karşılaştırılabilirliğini azaltır |
| Düzenleyici Gereklilikler | Pazarlamayı desteklemek için uygun değil yetkilendirme uygulamaları | Lisanslı ürünlerin erken geliştirilmesinden pazarlanmasına kadar tüm süreci desteklemek için geçerlidir | Pazarlama iznine kadar erken geliştirmeyi desteklemek için geçerlidir |
Tablo 1.Farklı HCP Reaktif Kiti Türlerinin Karşılaştırılması
Yeasen Biotech Özelleştirilmiş HCP Analiz Geliştirme Hizmeti
HCP tespitinin önemi göz önüne alındığında, Yeasen Biotech, protein antikoru kritik ham madde geliştirme platformları ve enzim immünolojik analizörleri ve 2D-WB çift yönlü jel elektroforezi-immünoblotting sistemleri gibi gelişmiş araştırma araçlarıyla donatılmış bağışıklık tespiti ürünü geliştirme için bağımsız bir laboratuvar kurmak için yüksek performanslı bir monoklonal antikor geliştirme platformuna güvenmektedir. Geliştirme platformu oldukça olgundur ve memeli hücreleri, böcek hücreleri (Sf9 gibi), bakteriler ve maya dahil olmak üzere çeşitli konak hücre kalıntıları için HCP analiz kitlerini hızla özelleştirme yeteneğine sahiptir.
Özelleştirme Zaman Çizelgesi
Konak hücre kalıntısı protein tespit kitleri için özelleştirme hizmeti genellikle 6 ila 10 ay sürer.
Antijen-Antikor Hazırlanması: HCP antijenlerinin belirlenmesi, HCP referans standartlarının oluşturulması, bağışıklık yollarının ve stratejilerinin tasarlanması, HCP antikorlarının hazırlanması vb. genellikle 4 ila 6 ay sürer.
Test Kiti Geliştirme: Antikor optimizasyonu, kapsam analizi, test kiti yöntem doğrulaması vb. genellikle 2 ila 4 ay sürer.
Yeasen Biotech HCP Antikor Kapsamı Doğrulama Hizmeti
ELISA'nın endüstride kalan HCP'yi tespit etmek için altın standart olduğu bilinmektedir, ancak bu yöntemin doğruluğu HCP'ye karşı çok klonlu antikorların kapsamına bağlıdır. Amerika Birleşik Devletleri Farmakopesi ve Avrupa Farmakopesi, HCP ELISA antikorlarını ve kapsamlarını karakterize etmek için önerilen yöntemler olarak immünopürifikasyon ve 2D-WB'den bahsetmektedir.
HCP Antikor Kapsamı Doğrulama Hizmet
2D-WB, önce iki boyutlu jel elektroforezi kullanarak proteinleri boyut ve yüke göre ayırır, ardından bu proteinleri protein baskı tespiti için HCP antikorlarıyla inkübe edilmek üzere bir membrana aktarır.
Biz CHO, E.coli, HEK293 vb. gibi konak hücrelerden alınan HCP örnekleri için antikor kapsamı doğrulama hizmetleri sağlamak üzere tam bir 2D-WB enstrümantasyon setine ve kapsamlı laboratuvar deneyimine sahiptir.
İlgili Ürün:
| Ürün | Katalog No. | Boyut |
| 36712ES | 48T/96T | |
| 36713ES | 48T/96T | |
| CHO HCP ELISA kiti (CHO-K1) | 36714ES | 48T/96T |
| E.coli HCP ELISA Kiti (Plazmid) | 36721ES | 48T/96T |
