
HCP检测的概念和必要性
生物制品通常采用重组技术在宿主细胞(如细菌、酵母、哺乳动物、昆虫或植物细胞)中生产,包括单克隆抗体、重组蛋白和疫苗。这些产品的制造和纯化过程不可避免地会引入宿主细胞蛋白 (HCP) 作为杂质,这些杂质包括宿主细胞的结构蛋白和宿主细胞分泌的生长因子,形成具有各种物理化学和免疫学特性的复杂混合物。尽管使用了先进的纯化技术,一些宿主细胞蛋白仍可能作为工艺相关杂质残留在中间药物产品中。
这些杂质具有潜在的免疫原性,可能增强生物制药产品的免疫原性反应,影响其稳定性和疗效,从而对人体安全构成风险。因此,需要制定适当的HCPs去除监控策略,控制最终产品中HCPs的含量,以满足药品质量的要求。
医疗保健人员的监管要求
生物制品中HCP的残留量通常被认为是产品的关键质量属性(CQA)、工艺稳健性监控的重要评价指标和产品的关键质量控制指标。各国监管机构对HCP都有规定,要求对生物药进行分析和纯化,以将宿主细胞蛋白HCP降低到可接受的水平。HCP的可接受水平将根据具体情况进行评估,取决于多种因素,包括剂量、给药频率、药物类型和疾病严重程度。
中国药典(2020版)规定:对于CHO细胞,残留HCP需<0.05%(相当于小于500ppm);对于大肠杆菌,残留HCP需<0.01%。
美国药典USP<1132>章节规定:应采用高灵敏度的方法来检测药物中的HCP,含量应低于检测限(通常小于100 ppm,即1 mg总蛋白中HCP含量应小于100 ng,或<0.01%)。
欧洲药典EP 2.6.34规定:生物制品中,HCPs的含量应小于0.1%。
人用药品注册技术要求国际协调会(ICH)指导原则:ICH Q6B规定应采用灵敏且经过验证的方法来监测残留的HCP,残留量通常要求低于100 ppm。
可以看出,监管机构对于HCP的要求高度一致,生物制品工艺开发必须经过HCP检测,证明纯化工艺能够将HCP降低至安全水平,且中美两国均建议最终产品中残留含量限值低于0.01%。
HCP 检测方法
酶联免疫吸附试验(ELISA)是目前最常用的HCP检测方法,2020版中国药典3412/3413/3414章中提到的宿主蛋白残留检测方法均为ELISA方法。
美国药典USP<1132>章节中也提到可采用电泳、ELISA、LC-MS/MS等方法检测HCP含量,其中ELISA由于操作简便、快速、灵敏度高、通量高等特点被推荐作为HCP检测的首选方法。
酶联免疫吸附试验(ELISA):
目的: 检测HCP中蛋白质的总量,可用于产品开发和过程控制,是目前检测HCP的常用方法。
优点: 灵敏度高、特异性强;高通量、自动化程度高;定量;操作简便、快捷。
缺点: 需要特异性抗体;无法特异性识别和评估个体HCP;方法开发复杂,需要特殊的抗原制备;该方法的影响因素很多,需要评估HCP覆盖率;无法识别物种。

蛋白质印迹法:
目的: 用于对大量样本进行一致性筛查,检测与抗 HCP 抗体反应的未知蛋白质。适用于检测 HCP 并提供有关 HCP 相对分子量的近似信息。
优点: 特异性;结果直观:可视化蛋白质大小和表达水平的差异;可以检测和量化特定的 HCP。
缺点: 半定量;仅限于特定蛋白质:只能检测与抗体结合的HCP;对于复杂的蛋白质混合物不够敏感;蛋白质SDS变性可能导致构象表位的丢失;灵敏度取决于多克隆抗体的质量。
双向凝胶电泳(2-DE):

目的: 它通常用于上游或下游工艺开发和表征,可以区分单个凝胶上的不同 HCP。
优点: 无需进行Western印迹,避免了转移问题;可以从产品中分离微量HCP杂质;提供有关相对分子量和等电点的近似信息。
缺点: 过多的蛋白质可能会掩盖 HCP 斑点;可以观察到样品中 HCP 的分布,但无法量化。

质谱分析:
目的: 识别单个 HCP,为宿主细胞蛋白质提供准确的识别和定量信息。
优点: 高分辨率和准确性;识别和监测单个 HCP;提供 HCP 的综合光谱;可覆盖多种蛋白质;可识别 HCP 种类。
缺点: 设备和技术要求高;操作复杂;成本高;方法通量低;样品预处理复杂;潜在的基质效应;需要专业的数据分析能力。
ELISA是各国药典推荐的检测生物制品中HCP残留的方法,可以测定HCP的总量,但在识别HCP种类和丰度方面存在局限性,需要与其他方法配合使用。每种检测方法都有其优缺点,实际应用中可根据实验目的、样本特点、准确度、操作便捷性等因素进行选择,结合使用不同的方法,以获得更全面、准确的结果。
此外,美国药典USP<1132>和欧洲药典EP 2.6.34. HOST-CELL PROTEIN ASSAYS指出,在产品研发的不同阶段,应使用不同的ELISA试剂进行HCP检测,将HCP检测方法分为商业化试剂、产品/工艺特定方法、平台方法等。
USP<1132>提及,在缺乏平台方法的情况下,临床前、I期、II期临床试验中可使用商业化试剂;在III期临床试验/工艺验证及产品上市后,由于商业化通用HCP检测试剂的抗体覆盖率不足等限制,应考虑细胞类型、工艺特异性等因素,采用平台方法或针对产品/工艺的方法进行上游工艺开发。
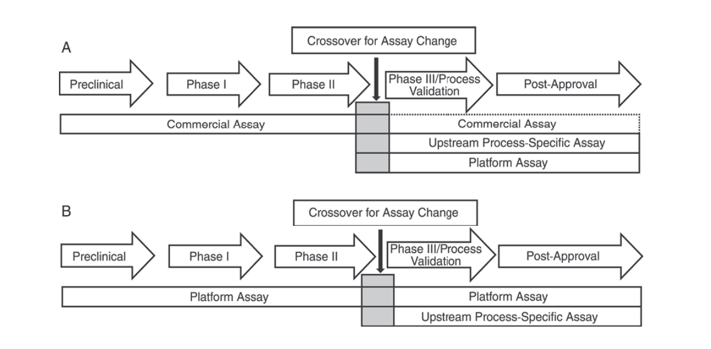
图 1. 在 USP <1132> 中,建议在产品开发的不同阶段使用特定方法检测 HCP。
| 方法 | 商业试剂盒 | 产品/工艺特定检测 成套工具 | 平台检测 成套工具 |
| 可用性 | 随时可用
| 需要制备抗原,包括克隆宿主细胞系
| 需要使用裸细胞或空载体细胞系制备抗原
|
| 发展 | 只需极少的准备 | 检测开发(包括抗原表征、免疫和确认)通常需要至少 6 个月 | 检测开发(包括抗原表征、免疫和确认)通常需要至少 9 个月 |
| 多样性 | 仅限于最常见的表达系统 | 可以使用各种类型的表达系统 | 可以使用各种类型的表达系统 |
| 特异性 | 特异性可能较差,可能存在未被发现的 HCP
| 特异性通常会增强,抗体覆盖范围针对特定的 HCP 模式 | 与商业检测方法相比,特异性有所提高,对检测性能的理解有所增强,HCP 类型的覆盖率也有所提高 |
| 成本 | 初始价格相对便宜,但整个下游净化工艺的开发成本将迅速上升 | 初始成本较高,但盈亏平衡点通常为 100 套试剂盒的价值 | 由于其适用于多种产品,具有显著的成本优势 |
| 依赖 | 依赖于特定的供应商,试剂和控制方案处于“黑箱”状态。 | 全面控制所有试剂和缓冲液,可随时调整 | 对所有试剂拥有完全的所有权和控制权,降低供应链和批次可比性的风险 |
| 监管要求 | 不适合支持营销 授权申请 | 适用于支持授权产品从早期开发到上市的整个过程 | 适用于支持早期开发直至获得上市许可 |
表 1.不同HCP试剂盒类型的比较
Yeasen 生物技术定制HCP检测开发服务
鉴于 HCP 检测的重要性,
定制时间表
宿主细胞残留蛋白检测试剂盒的定制服务通常需要6到10个月。
抗原抗体制备:确定HCP抗原、建立HCP参考标准、设计免疫途径和策略、制备HCP抗体等,一般需要4~6个月。
检测试剂盒开发:抗体优化、覆盖率分析、检测试剂盒方法验证等,一般需要2到4个月。
Yeasen 生物技术 HCP 抗体覆盖率验证服务
众所周知,ELISA是业界检测残留HCP的金标准,但该方法的准确性取决于多克隆抗体对HCP的覆盖率。美国药典和欧洲药典均将免疫纯化和2D-WB列为表征HCP ELISA抗体及其覆盖率的推荐方法。
HCP 抗体覆盖率 确认 服务
2D-WB 首先使用二维凝胶电泳根据大小和电荷分离蛋白质,然后将这些蛋白质转移到膜上,与 HCP 抗体一起孵育以检测蛋白质印迹。
我们 拥有全套2D-WB仪器设备和丰富的实验室经验,为CHO、E.coli、HEK293等宿主细胞的HCP样本提供抗体覆盖率验证服务。
相关产品:
| 产品 | 目录编号 | 尺寸 |
| 36712ES | 48吨/96吨 | |
| 36713ES | 48吨/96吨 | |
| CHO HCP ELISA 试剂盒(CHO-K1) | 36714ES | 48吨/96吨 |
| 大肠杆菌 HCP ELISA 试剂盒(质粒) | 36721ES | 48吨/96吨 |
