ماذا تفعل عندما تكون نتائج qPCR غريبة؟
قد تبدو تجارب qPCR سهلة وصعبة في بعض الأحيان. بعد اكتمال تصميم البادئ، تتم إضافة عينات qPCR خطوة بخطوة مثل PCR، ويمكن إكمال التجربة على الجهاز. هناك العديد من المشكلات الشائعة في تجارب qPCR بطريقة الصبغة، وبالنظر إلى الأسباب والحلول المحتملة، نأمل أن تتمكن من استخدامها لحل المشكلات في تجارب qPCR.
1. ما هو qPCR؟
2. منحنى تضخيم qPCR غير الطبيعي
3. منحنى ذوبان qPCR غير الطبيعي
4. معلومات الطلب
5. المنتجات ذات الصلة
6. فيما يتعلق بالقراءة
1. ما هو qPCR؟
منذ اختراع تقنية تفاعل البوليميراز المتسلسل (PCR)، ربما تكون تقنية تفاعل البوليميراز المتسلسل هي التقنية الأكثر استخدامًا على نطاق واسع في علم الأحياء الجزيئي نظرًا لبساطتها ورخصها وموثوقيتها وسرعتها وحساسيتها العالية. qPCR هي تقنية طورتها تقنية تفاعل البوليميراز المتسلسل. أثناء عملية تضخيم الحمض النووي، لا تتمتع طريقة الكشف عن الكمية الإجمالية للمنتجات بعد كل دورة تفاعل بوليميراز متسلسل باستخدام الأصباغ الفلورية بسرعة وحساسية تفاعل البوليميراز المتسلسل فحسب، بل تتمتع أيضًا بمزيد من الخصوصية والمراقبة في الوقت الفعلي والقياس الكمي المتكرر والدقيق ومزايا أخرى. qPCR هي تقنية تستخدم جهاز تضخيم تفاعل البوليميراز المتسلسل الكمي في الوقت الفعلي، وهو جهاز qPCR، لمراقبة منتجات تضخيم الأحماض النووية في الوقت الفعلي أثناء عملية تفاعل البوليميراز المتسلسل. يحقق qPCR التحليل الكمي للقالب الأولي من خلال تحليل قيمة Ct والمنحنى القياسي. في عام 1992، اقترح الياباني هيجوتشي لأول مرة "تقنية تفاعل البوليميراز المتسلسل الكمي الفلوري في الوقت الفعلي". في عام 1996، أطلقت شركة American Biological Company أول جهاز تفاعل البوليميراز المتسلسل الكمي الفلوري في العالم، والذي يتكون من نظام دورة حرارية لتضخيم تفاعل البوليميراز المتسلسل، ونظام بصري لكشف الفلورسنت، وبرنامج كمبيوتر وتطبيق. يمكنه مراقبة منتجات تضخيم الأحماض النووية في الوقت الفعلي من خلال الأصباغ الفلورية أو المجسات الفلورية. من خلال علاقة الوظيفة الرياضية، جنبًا إلى جنب مع برنامج تحليل النتائج، يتم حساب كمية القالب الأولي للعينة المراد اختبارها. لذلك، تم استخدام تقنية تفاعل البوليميراز المتسلسل الكمي الفلوري في الوقت الفعلي على نطاق واسع. تنقسم طرق وضع العلامات الفلورية لـ qPCR إلى طريقة فسيفساء الصبغة الفلورية القائمة على طريقة صبغة SYBR Green I، وطريقة المسبار الفلوري القائمة على طريقة مسبار Taqman (مسبار الدورة، Bracon الجزيئي، إلخ)، وطريقة برايمر الصبغة المطفأة.
قد تبدو تجارب qPCR سهلة وصعبة في بعض الأحيان. بعد اكتمال تصميم البادئ، تتم إضافة عينات qPCR خطوة بخطوة مثل PCR، ويمكن إكمال التجربة على الجهاز. ومع ذلك، هناك العديد من التفاصيل الصغيرة التي تحتاج إلى الاهتمام، مثل عدم وجود سائل معلق على جدار الأنبوب، وعدم وجود فقاعات في الأنبوب، والحاجة إلى تقليل الاتصال المباشر بين جدار الأنبوب وغطاء الأنبوب، وما إلى ذلك، لتقليل الأخطاء التجريبية أو النتائج التجريبية الغريبة. لقد جمعت Xiaoyi العديد من المشكلات الشائعة في تجارب qPCR بطريقة الصبغة وأعطت الأسباب والحلول المحتملة، والتي نأمل أن تتمكن من استخدامها لحل المشكلات في تجارب qPCR.
2. منحنى تضخيم qPCR غير الطبيعي
2.1 التشوهات في المرحلة الأساسية للرسم البياني اللوغاريتمي لمنحنى التضخيم
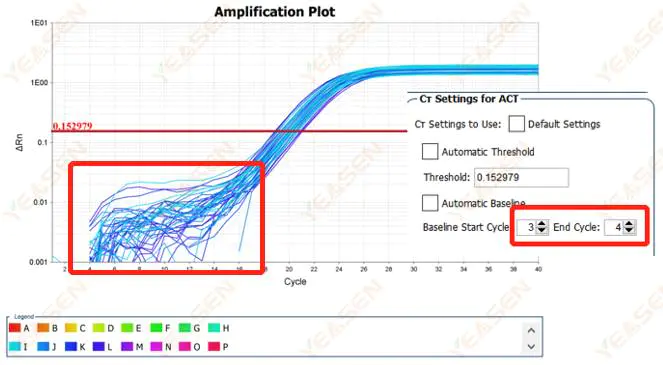
الشكل 1. مخطط التضخيم
الأسباب المحتملة:
إعداد خط الأساس غير صحيح.
الحلول:
من المستحسن زيادة قيمة النقطة النهائية للخط الأساسي.مخطط مثال التعديل هو كما يلي.

الشكل 2. مخطط التضخيم
2.2 رسم بياني لمنحنى التضخيم وتقسيم المنحنى
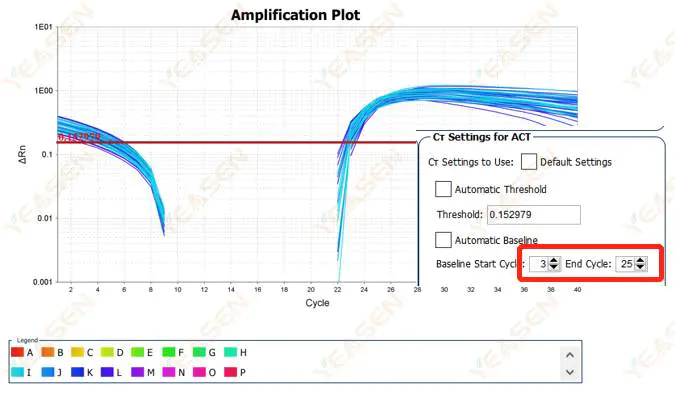
الشكل 3. مخطط التضخيم
الأسباب المحتملة:
تم تعيين خط الأساس على مستوى مرتفع للغاية.
الحلول:
يوصى بتقليل قيمة النقطة النهائية لخط الأساس. الرسم البياني لمثال التعديل هو كما يلي.
2.3 رسم خطي لمنحنى التضخيم غير السلس
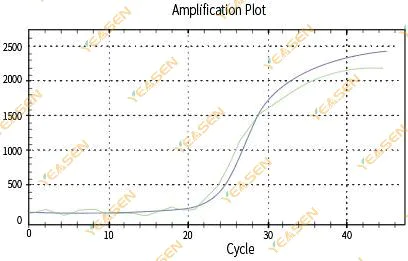
الشكل 4. مخطط التضخيم
الأسباب المحتملة:
1) لم يتم إغلاق أنبوب تفاعل PCR بشكل محكم مما أدى إلى تسرب محلول التفاعل.
2) محلول تفاعل PCR مع جدار معلق.
3) الجهاز غير معاير (بما في ذلك المعايرة التلقائية أو معايرة ROX).
4) يحتوي النظام على العديد من المثبطات، مما يؤدي إلى فلورسنت غير مستقر.
5) الإفراط في استخدام الجهاز يؤدي إلى تجميع فلورسنت غير مستقر.
الحلول:
1) اضغط على غطاء الأنبوب بإحكام.
2) قم بخلط الكاشف جيدًا، ثم ضعه بعناية في جهاز القياس الكمي بعد الطرد المركزي الكامل.
3) معايرة الجهاز.
4) تحسين نقاء الحمض النووي الريبي واختيار الكواشف النسخية العكسية المناسبة.
2.4 منحنى مضخم للرسم البياني الخطي المتعرج عند هضبة
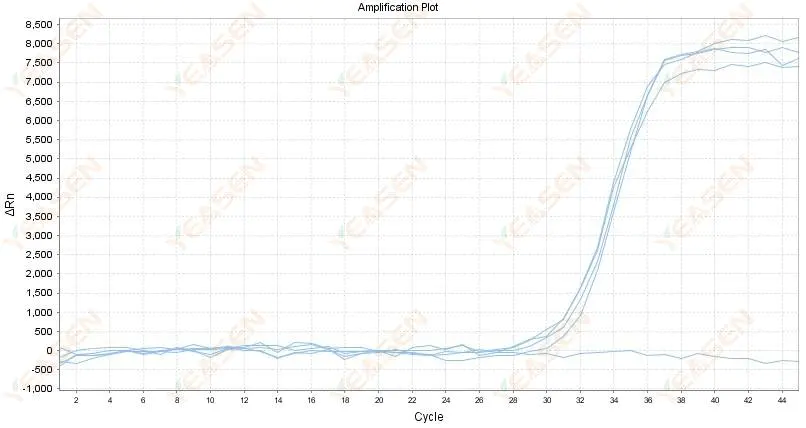
الشكل 5. مخطط التضخيم
الأسباب المحتملة:
1) نقاء الحمض النووي الريبوزي ضعيف ويحتوي على الكثير من الشوائب.
2) تم استخدام الأداة لفترة طويلة جدًا.
الحلول:
1) إعادة استخراج الحمض النووي الريبي عالي الجودة.
2) قم بتخفيف قالب RNA لتقليل تركيز الشوائب.
3) معايرة الجهاز.
2.5 فشل الرسم البياني الخطي لمنحنى التضخيم في الوصول إلى هضبة
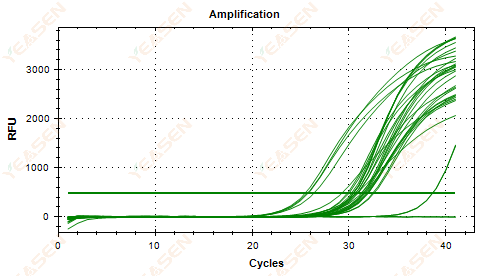
الشكل 6. مخطط التضخيم
الأسباب المحتملة:
1) تركيز القالب منخفض (قيمة Ct حوالي 35).
2) دورات التضخيم قليلة جدًا.
3) كفاءة منخفضة لتضخيم الكاشف (Ct صغير، ولكن أيضًا غير قادر على الوصول إلى الهضبة).
الحلول:
1) زيادة تركيز القالب.
2) زيادة عدد الدورات.
3) زيادة المغنيسيوم2+ تركيز.
2.6 منحنى التضخيم الرسم البياني الخطي لترهل الهضبة
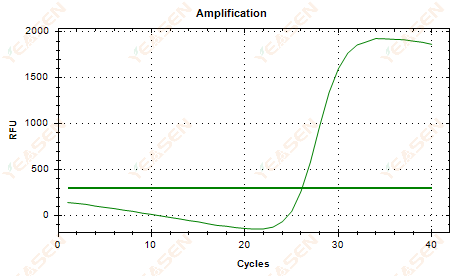
الشكل 7. مخطط التضخيم
الأسباب المحتملة:
1) وجود التدهور (تدهور منتج التضخيم، تدهور SYBR).
2) لم يتم تغطية غطاء الأنبوب بشكل صحيح وأصبح الكاشف متطايرًا.
3) تركيز cDNA مرتفع للغاية (إذا كانت قيمة Ct صغيرة للغاية، يتم رفع عتبة الفلورسنت إلى مستوى مرتفع، ويصبح الترهل أكثر حدة).
4) فقاعات هواء في الأنبوب، ثم تختفي.
الحلول:
1) تحسين نقاء النظام.
2) تقليل كمية cDNA (القالب المخفف).
3) تقليل قيمة النقطة النهائية للخط الأساسي.
2.7 قيمة كبيرة لـ Ct في منحنى التضخيم
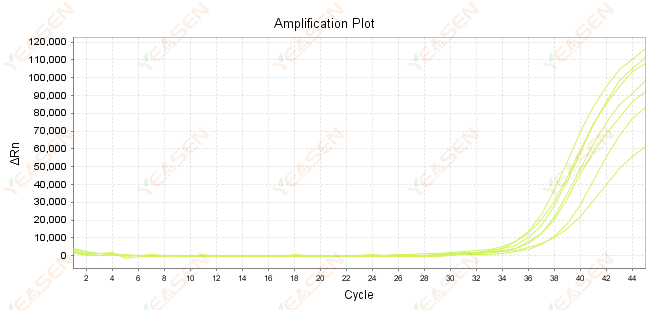
الشكل 8. مخطط التضخيم
الأسباب المحتملة:
1) كمية قليلة من القوالب.
2) كفاءة تضخيم منخفضة.
3) جزء PCR طويل جدًا.
4) وجود مثبطات في نظام التفاعل.
الحلول:
1) قم بتقليل أوقات التخفيف أو زيادة كمية القالب بحيث تقع قيمة Ct بين 15 و 30 قدر الإمكان.
2) قم بتحسين ظروف التفاعل، أو جرب إجراء تضخيم بثلاث خطوات، أو أعد تصميم البادئات.
3) تم تصميم طول منتج PCR ليكون في حدود 100 -150 زوجًا أساسيًا، ولا يوصى بتجاوز 300 زوجًا أساسيًا.
4) إعادة إنتاج قوالب ذات نقاء أعلى.
2.8 ضعف القدرة على تكرار منحنيات التضخيم
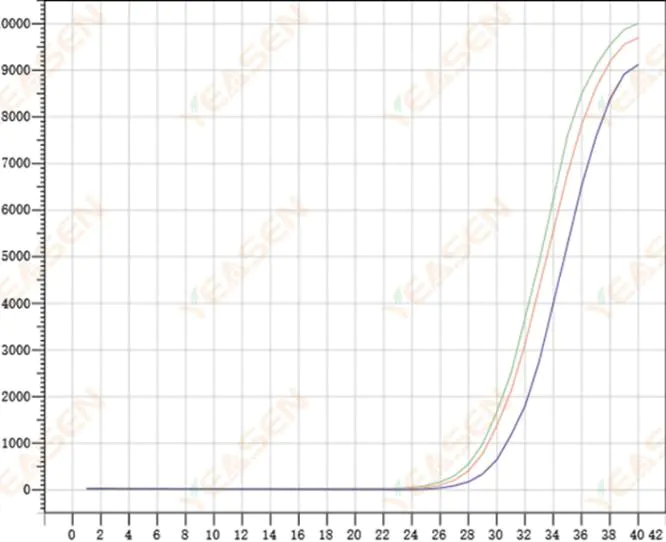
الشكل 9. مخطط التضخيم
الأسباب المحتملة:
1) أخطاء كبيرة في التصويب.
2) لا يتم خلط الكواشف والأنظمة بشكل جيد.
3) عدد نسخ cDNA منخفض.
4) لم يتم استخدام معايرة Rox.
الحلول:
1) معايرة الماصات.
2) خلط نظام التفاعل بشكل كامل.
3) يمكن التخلص من تركيز القالب المنخفض، والقدرة على التكرار الضعيفة، و4-6 فتحات مركبة، و1-2 انحراف عن القيم الأكبر بشكل مناسب.
4) من الأفضل استخدام معايرة Rox. إذا كان الكاشف المستخدم لا يحتوي على Rox، فيجب تحديد الصبغة المرجعية على None (لا شيء).
2.9 منحنيات التضخيم العشوائية
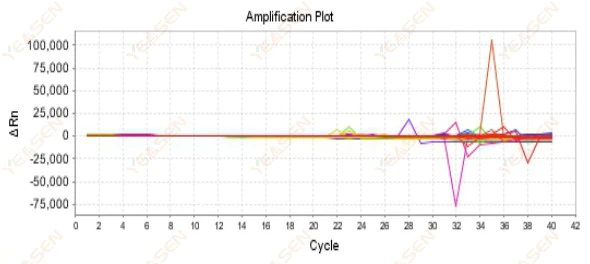
الشكل 10. مخطط التضخيم
الأسباب المحتملة:
عدم التطابق بين تركيز روكس والنموذج.
الحلول:
قم بتغيير إعداد الصبغة المرجعية على الجهاز من ROX إلى NONE وشاهد ما إذا كان منحنى التضخيم يعود إلى وضعه الطبيعي.
2.10 ذروة NTC
2.10.1 Ct>35، قيمة Tm لمنحنى الانصهار <80 درجة مئوية
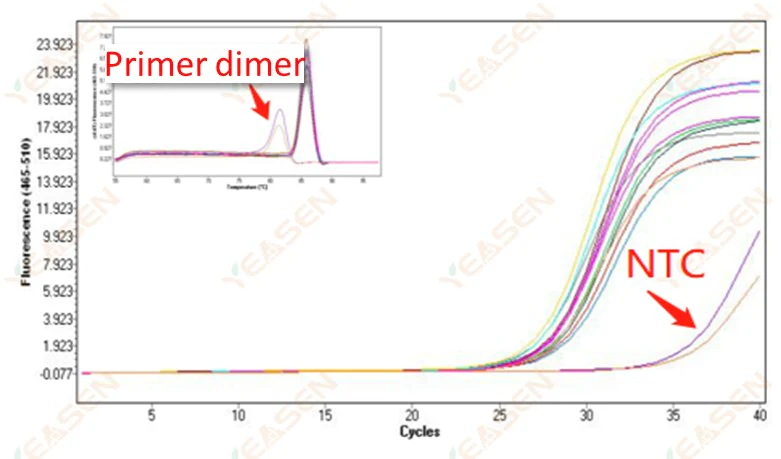
الشكل 11. مخطط التضخيم
الأسباب المحتملة:
نتائج ثنائيات البادئ.
الحلول:
تمهيدات مُحسَّنة.
2.10.قيمة 2 Ct <35، وتداخل منحنى ذوبان NTC وشكل ذروة منحنى ذوبان الجين
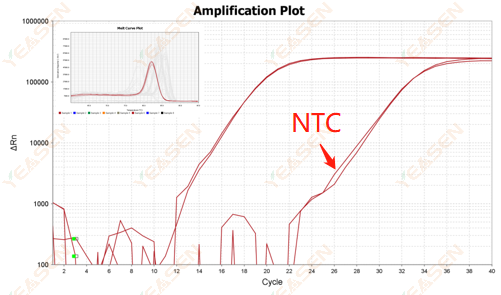
الشكل 12. مخطط التضخيم
الأسباب المحتملة:
تلوث نظام التفاعل.
الحلول:
التحقق من مصادر التلوث واحدا تلو الآخر.
3. منحنى ذوبان qPCR غير الطبيعي
3.1 منحنى ذوبان ذو قمة واحدة ولكنه ليس حادًا
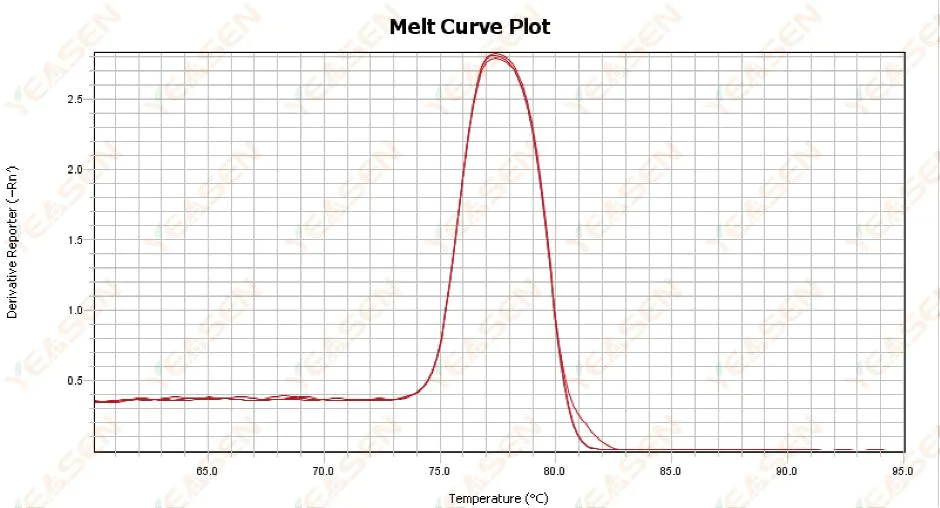
الشكل 13. رسم منحنى الذوبان
الأسباب المحتملة:
1) يتعلق الأمر بتركيب الكاشف ونموذج الجهاز.
2) وجود تضخيم غير محدد لأجزاء متشابهة الحجم.
الحلول:
1) لا يتجاوز مدى درجة الحرارة من بداية الذروة إلى نهايتها 7 درجات مئوية. وتعتبر النتائج قابلة للاستخدام، أي ذروة واحدة.
2) تم إجراء التحليل الكهربائي للأجاروز عالي التركيز (على سبيل المثال 3٪ أجاروز) للمساعدة في التحديد.
3.2 منحنى الانصهار له ذروة مزدوجة والذروة الدنيا Tm تكون قبل 80 درجة مئوية
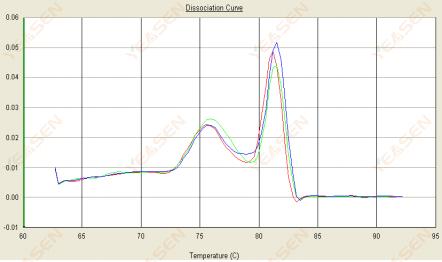
الشكل 14. منحنى التفكك
الأسباب المحتملة:
وجود ثنائيات البادئ.
الحلول:
زيادة درجة حرارة التلدين، أو تقليل تركيز البادئ، أو إعادة تصميم البادئ.
3.3 منحنى الانصهار له ذروة مزدوجة والذروة الدنيا Tm تكون بعد 80 درجة مئوية
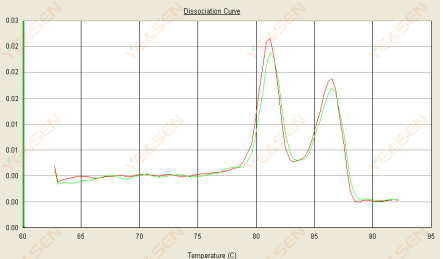
الشكل 15. منحنى التفكك
الأسباب المحتملة:
1) تؤدي خصوصية البادئ الضعيفة إلى تضخيم المنتجات غير المحددة.
2) تلوث الحمض النووي DNA.
الحلول:
1) قم بفحص مادة التفجير الأولية، وأعد تصميمها إذا كانت سيئة.
2) في حالة تأكيد الرقابة السلبية من قبل المجلس القومي للبحوث النووية، إذا وجدت، هناك حاجة إلى إعادة إعداد القالب.
3.4 قمم المنحنى الذائب الفوضوي
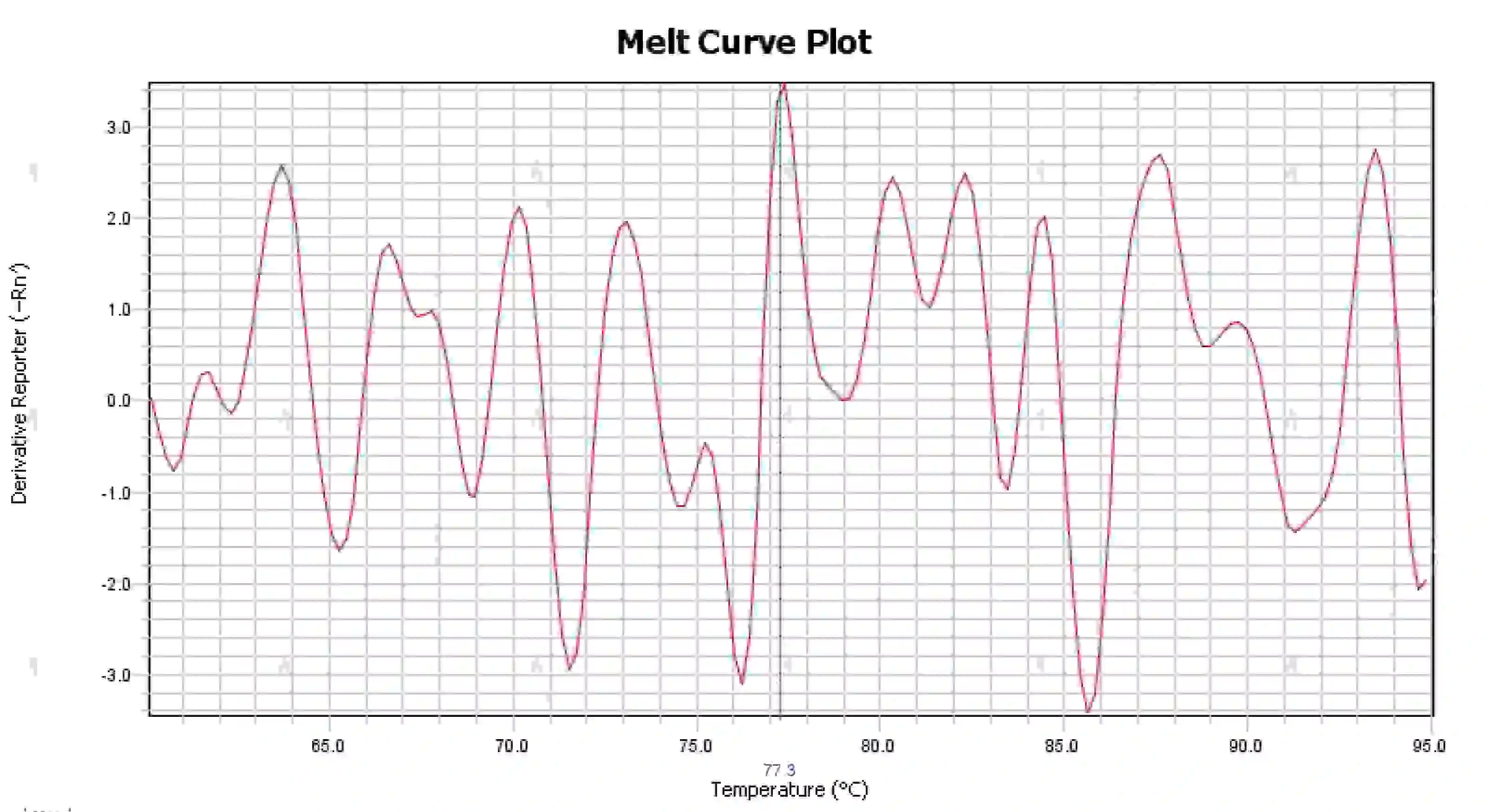
الشكل 16. رسم منحنى الذوبان
الأسباب المحتملة:
1) تلوث نظام التفاعل.
2) يؤدي تعرض الكواشف للضوء الساطع أو درجات الحرارة المرتفعة إلى فشل الكواشف.
3) لم يتم معايرة الجهاز لفترة طويلة.
4) عدم التوافق بين المواد الاستهلاكية والأجهزة.
الحلول:
1) من خلال الجمع بين نتائج NTC و NRC لتأكيد التلوث، يوصى باستبعاد التلوث من الماء، والبادئات، والإنزيمات، والبيئة واحدة تلو الأخرى.
2) من المستحسن إجراء تجارب مقارنة باستخدام الكواشف الجديدة.
3) يوصى بإجراء صيانة معايرة منتظمة للأداة.
4) تأكيد متطلبات الأداة المقابلة للمواد الاستهلاكية.
3.5 قمم زائفة في الطرف الأمامي لمنحنى الانصهار
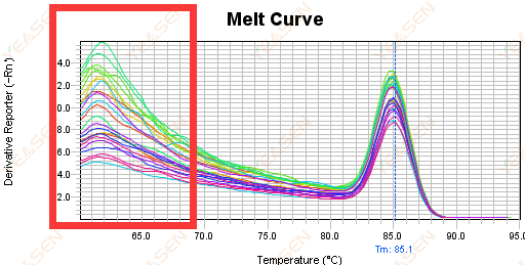
الشكل 17. رسم منحنى الذوبان
الأسباب المحتملة:
تركيز روكس لا يتطابق مع النموذج.
الحلول:
من المستحسن إلغاء تصحيح روكس لمعرفة ما إذا كان منحنى الانصهار طبيعيًا.
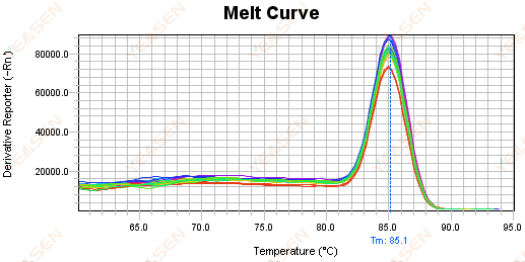
الشكل 18. رسم منحنى الذوبان
4. معلومات الطلب
الجدول 1. معلومات الطلب
| اسم المنتج | رمز المنتج | مواصفة |
| مزيج Hieff Unicon™ Universal Blue qPCR Master Mix (يعتمد على الصبغة) | 11184ES03 | 1 مل |
| 11184ES08 | 5×1 مل | |
| 11184ES50 | 50×1 مل | |
| 11184ES60 | 100×1 مل |
5. المنتجات ذات الصلة
المنتجات التي تقدمها شركة Yeasen هي كما يلي.
الجدول 2. المنتجات ذات الصلة
| تحديد موقع المنتج | اسم المنتج | رمز المنتج |
| إزالة gDNA في خطوة واحدة والنسخ العكسي | هضم Hifair™V أحادي الخطوة RT-gDNA SuperMix لـ qPCR (سؤال) | 11142ES |
| مزيج رئيسي عالي الحساسية (مع خطوة إزالة gDNA) | مزيج فائق من تركيب cDNA من السلسلة الأولى Hifair™ III لـ qPCR (جهاز هضم gDNA بالإضافة إلى ذلك) | 11141ES |
| مجموعة الحساسية العالية (مع خطوة إزالة gDNA) | طقم تركيب الحمض النووي الريبوزي منقوص الأكسجين Hifair™ III 1st Strand (جهاز هضم الحمض النووي الريبوزي منقوص الأكسجين بالإضافة إلى ذلك) (سؤال) | 11139ES |
| مزيج رئيسي كمي عادي (طريقة التحقيق) | مزيج رئيسي من مسبار TaqMan من Hieff™ qPCR (سؤال) | 11205ES |
6. فيما يتعلق بالقراءة
DNase I وتطبيقاته في الطب الحيوي
المبادئ التوجيهية لاختيار النسخ العكسي
