تعتبر مجموعة كاشف HCP التجارية من Yeasen Biotechnology طريقة بسيطة وحساسة للغاية وموضوعية للكشف عن HCP. طورت Yeasen Biotechnology بشكل مستقل مجموعات كاشف متعددة، يمكنها الكشف بحساسية عن مستويات HCP المتبقية في العينات. يمكن استخدام مجموعات الكواشف هذه لتحسين عملية تنقية المستحضرات الصيدلانية الحيوية، والتحكم في الشوائب في العمليات الوسيطة، وإطلاق اختبار المنتجات النهائية. هل تريد معرفة المزيد حول كيف يمكن لمجموعات كواشف HCP من Yeasen Biotechnology تحسين إنتاجك للمستحضرات الصيدلانية الحيوية؟ اقرأ المقال الآن!

مفهوم وضرورة الكشف عن مرضى الفشل الكلوي
تُنتج المنتجات البيولوجية عادةً باستخدام تقنية إعادة التركيب في الخلايا المضيفة (مثل البكتيريا أو الخميرة أو الثدييات أو الحشرات أو الخلايا النباتية)، بما في ذلك الأجسام المضادة وحيدة النسيلة والبروتينات المعاد تركيبها واللقاحات. تؤدي عمليات تصنيع وتنقية هذه المنتجات حتمًا إلى إدخال بروتينات الخلايا المضيفة (HCPs) كشوائب، والتي تشمل كلًا من البروتينات البنيوية للخلايا المضيفة وعوامل النمو التي تفرزها الخلايا المضيفة، مما يشكل مزيجًا معقدًا بخصائص فيزيائية وكيميائية ومناعية مختلفة. وعلى الرغم من استخدام تقنيات التنقية المتقدمة، فقد تظل بعض بروتينات الخلايا المضيفة شوائب مرتبطة بالعملية في منتجات الأدوية الوسيطة.
تتمتع هذه الشوائب بقدرة مناعة محتملة وقد تعزز الاستجابة المناعية للمنتجات الصيدلانية الحيوية، مما يؤثر على استقرارها وفعاليتها، وبالتالي يشكل مخاطر على سلامة الإنسان. لذلك، من الضروري وضع استراتيجيات مراقبة مناسبة لإزالة المواد المهدرجة، كما يجب التحكم في محتوى المواد المهدرجة في المنتج النهائي لتلبية متطلبات جودة الدواء.
المتطلبات التنظيمية لممارسي الرعاية الصحية
يعتبر المحتوى المتبقي من HCPs في المنتجات البيولوجية عمومًا سمة جودة حرجة للمنتج، ومؤشر تقييم مهم لمراقبة قوة العملية، ومؤشر رئيسي لمراقبة الجودة للمنتج. لدى السلطات التنظيمية في مختلف البلدان أحكام بشأن HCPs، تتطلب تحليل وتنقية المستحضرات الصيدلانية الحيوية لتقليل HCPs في بروتينات الخلايا المضيفة إلى مستويات مقبولة. سيتم تقييم مستوى قبول HCPs بناءً على ظروف محددة ويعتمد على عدة عوامل، بما في ذلك الجرعة وتكرار الجرعات ونوع الدواء وشدة المرض.
ينص دستور الأدوية الصيني (طبعة 2020) على ما يلي: بالنسبة لخلايا CHO، يجب أن يكون HCP المتبقي <0.05% (ما يعادل أقل من 500 جزء في المليون)؛ بالنسبة لـ E. coli، يجب أن يكون HCP المتبقي <0.01%.
ينص فصل دستور الأدوية الأمريكي USP <1132> على ما يلي: يجب استخدام طريقة شديدة الحساسية للكشف عن HCPs في الأدوية، ويجب أن يكون المحتوى أقل من حد الكشف (عادةً أقل من 100 جزء في المليون، أي أن محتوى HCP في 1 ملغ من البروتين الإجمالي يجب أن يكون أقل من 100 نانوغرام، أو <0.01٪).
ينص دستور الأدوية الأوروبي EP 2.6.34 على ما يلي: في المنتجات البيولوجية، يجب أن يكون محتوى HCPs أقل من 0.1%.
تنص إرشادات المؤتمر الدولي لتوحيد المتطلبات الفنية لتسجيل الأدوية للاستخدام البشري (ICH): ICH Q6B على أنه يجب اعتماد طرق حساسة ومُثبتة لمراقبة المواد الصيدلانية المتبقية، حيث يجب أن تكون الكمية المتبقية عادةً أقل من 100 جزء في المليون.
من الممكن ملاحظة أن الهيئات التنظيمية لديها متطلبات متسقة للغاية فيما يتعلق بمكونات HCP. يجب أن تخضع عملية تطوير المنتجات البيولوجية للكشف عن HCP، وإثبات أن عملية التنقية يمكنها تقليل HCPs إلى مستويات آمنة، وأن الحدود الموصى بها للمحتوى المتبقي في المنتج النهائي أقل من 0.01٪ في كل من الصين والولايات المتحدة.
طرق الكشف عن HCP
يُعد اختبار الممتز المناعي المرتبط بالإنزيم (ELISA) حاليًا الطريقة الأكثر شيوعًا المستخدمة للكشف عن HCP. إن طرق الكشف عن بقايا البروتين المضيف المذكورة في الفصول 3412/3413/3414 من طبعة 2020 من دستور الأدوية الصيني هي كلها طرق ELISA.
يذكر فصل دستور الأدوية الأمريكي USP <1132> أيضًا أنه يمكن استخدام طرق مثل الرحلان الكهربائي، وELISA، وLC-MS/MS للكشف عن محتوى HCP، ويوصى باستخدام ELISA كطريقة مفضلة للكشف عن HCP نظرًا لسهولة تشغيلها وسرعتها وحساسيتها العالية وإنتاجيتها العالية.
إليزا:
غاية: يكتشف الكمية الإجمالية للبروتينات في HCPs، ويمكن استخدامه لتطوير المنتجات والتحكم في العملية، وهو حاليًا طريقة شائعة للكشف عن HCPs.
المميزات: حساسية عالية وخصوصية؛ قدرة عالية على الإنتاج والأتمتة؛ كمية؛ تشغيل سهل وسريع.
العيوب: يتطلب أجسامًا مضادة محددة؛ لا يمكنه تحديد وتقييم HCPs الفردية على وجه التحديد؛ تطوير الطريقة معقد ويتطلب تحضير مستضد خاص؛ هناك العديد من العوامل المؤثرة على الطريقة، ويجب تقييم تغطية HCP؛ لا يمكن تحديد الأنواع.

النقل الغربي:
غاية: يُستخدم في الفحص المتسق لأعداد كبيرة من العينات واكتشاف البروتينات غير المعروفة التي تتفاعل مع الأجسام المضادة لـ HCP. مناسب لاكتشاف الأجسام المضادة لـ HCP وتوفير معلومات تقريبية عن الوزن الجزيئي النسبي لـ HCPs.
المميزات: الخصوصية؛ النتائج بديهية بصريًا: تصور الاختلافات في حجم البروتين ومستويات التعبير؛ يمكن اكتشاف وتحديد كمية البروتينات الهيكلية المحددة.
العيوب: شبه كمي؛ يقتصر على بروتينات محددة: يمكنه فقط اكتشاف البروتينات البروتينية المرتبطة بالأجسام المضادة؛ غير حساس بدرجة كافية لمخاليط البروتين المعقدة؛ قد يؤدي تحلل بروتين SDS إلى فقدان النمط الظاهري التكويني؛ تعتمد الحساسية على جودة الأجسام المضادة المتعددة النسائل.
التحليل الكهربائي للهلام ثنائي الأبعاد (2-DE):

غاية: يتم استخدامه بشكل شائع لتطوير وتوصيف العمليات السابقة أو اللاحقة، ويمكنه التمييز بين HCPs المختلفة على هلام واحد.
المميزات: لا حاجة إلى النقل الغربي، مما يتجنب مشاكل النقل؛ يمكن فصل كميات ضئيلة من شوائب HCP من المنتج؛ يوفر معلومات تقريبية عن الوزن الجزيئي النسبي ونقطة التساوي الكهربائي.
العيوب: قد يؤدي البروتين الزائد إلى إخفاء بقع HCP؛ ويمكن ملاحظة توزيع HCPs في العينة، ولكن لا يمكن تحديد كميتها.

تحليل مطياف الكتلة:
غاية: يقوم بتحديد البروتينات الفردية في الخلايا المضيفة، مما يوفر معلومات دقيقة حول التعريف والقياس الكمي لبروتينات الخلايا المضيفة.
المميزات: دقة عالية ووضوح؛ يحدد ويراقب البروتينات الهيكلية الفردية؛ يوفر أطيافًا شاملة للبروتينات الهيكلية؛ يمكن أن يغطي مجموعة واسعة من البروتينات؛ يمكن تحديد أنواع البروتينات الهيكلية.
العيوب: متطلبات عالية من المعدات والتقنية؛ عملية معقدة؛ تكلفة عالية؛ إنتاجية منخفضة للطريقة؛ معالجة معقدة للعينة؛ تأثيرات المصفوفة المحتملة؛ يتطلب قدرات تحليل بيانات متخصصة.
إن اختبار ELISA هو الطريقة الموصى بها للكشف عن بقايا HCPs في المنتجات البيولوجية من خلال دساتير الأدوية في مختلف البلدان، وهو قادر على تحديد الكمية الإجمالية من HCPs. ومع ذلك، فإن هذا الاختبار له حدود في تحديد أنواع ووفرة HCPs ويحتاج إلى استكماله بأساليب أخرى. كل طريقة كشف لها مزاياها وعيوبها، وفي التطبيقات العملية، يمكن إجراء الاختيار بناءً على الأغراض التجريبية وخصائص العينة والدقة والراحة التشغيلية، من بين عوامل أخرى، جنبًا إلى جنب مع استخدام أساليب مختلفة للحصول على نتائج أكثر شمولاً ودقة.
بالإضافة إلى ذلك، يشير دستور الأدوية الأمريكي USP <1132> ودستور الأدوية الأوروبي EP 2.6.34. اختبارات بروتين الخلية المضيفة إلى أنه يجب استخدام كواشف ELISA مختلفة للكشف عن HCP في مراحل مختلفة من تطوير المنتج، وتصنيف طرق الكشف عن HCP إلى كواشف تجارية، وطرق خاصة بالمنتج/العملية، وطرق منصة.
يذكر USP <1132> أنه في حالة عدم وجود طرق منصة، يمكن استخدام الكواشف التجارية في التجارب السريرية قبل السريرية والمرحلة الأولى والمرحلة الثانية؛ في التجارب السريرية/التحقق من العملية للمرحلة الثالثة والمنتج بعد التسويق، بسبب القيود مثل التغطية غير الكافية للأجسام المضادة لكواشف الكشف العامة التجارية HCP، يجب النظر في عوامل مثل نوع الخلية وخصوصية العملية، باستخدام طرق المنصة أو طرق المنتج/العملية المحددة لتطوير العملية الأولية.
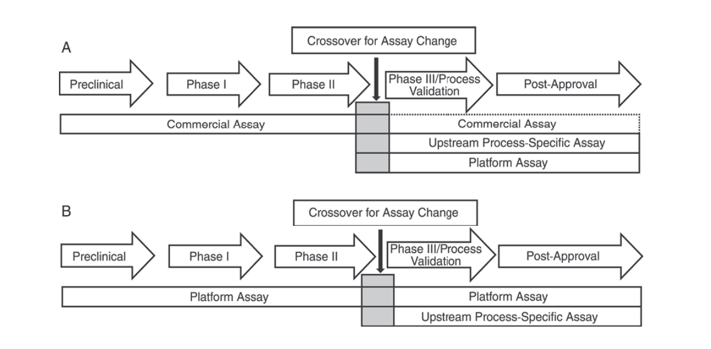
الشكل 1. في USP <1132>، تم اقتراح مراحل مختلفة من تطوير المنتج لاستخدام طرق محددة للكشف عن HCPs.
| طريقة | مجموعة الكواشف التجارية | الكشف عن المنتج/العملية المحددة عدة | اكتشاف المنصة عدة |
| التوفر | متاح بسهولة
| يتطلب تحضير المستضدات، بما في ذلك استنساخ سلالات الخلايا المضيفة
| يتطلب تحضير المستضدات باستخدام خطوط الخلايا المتجهة العارية أو الفارغة
|
| تطوير | يتطلب الحد الأدنى من التحضير | يستغرق تطوير الكشف بما في ذلك تحديد خصائص المستضد والتحصين والتأكيد عادةً 6 أشهر على الأقل | يستغرق تطوير الكشف بما في ذلك تحديد خصائص المستضد والتحصين والتأكيد عادةً 9 أشهر على الأقل |
| تنوع | يقتصر على أنظمة التعبير الأكثر شيوعًا | يمكن استخدام أنواع مختلفة من أنظمة التعبير | يمكن استخدام أنواع مختلفة من أنظمة التعبير |
| الخصوصية | قد تكون الخصوصية ضعيفة، مع احتمالية عدم اكتشاف مقدمي الرعاية الصحية
| عادةً ما يتم تعزيز الخصوصية، مع تغطية الأجسام المضادة التي تستهدف أنماط HCP المحددة | بالمقارنة مع طرق الكشف التجارية، يتم تحسين الخصوصية، وتعزيز فهم أداء الكشف، كما يتم أيضًا زيادة تغطية أنواع مقدمي الرعاية الصحية |
| يكلف | الأسعار الأولية رخيصة نسبيًا، لكن تكاليف التطوير سترتفع بسرعة لعملية التنقية الكاملة | التكاليف الأولية أعلى، ولكن نقطة التعادل تكون عادةً بقيمة 100 مجموعة من أدوات الكواشف | نظرًا لإمكانية تطبيقه على منتجات متعددة، فإنه يتمتع بمزايا كبيرة من حيث التكلفة |
| التبعية | اعتمادًا على مورد محدد، تكون الكواشف ومخططات التحكم في حالة "الصندوق الأسود". | يتمتع بالتحكم الشامل في جميع الكواشف والمخازن، ويمكن تعديله في أي وقت | يتمتع بالملكية الكاملة والسيطرة على جميع الكواشف، مما يقلل من المخاطر في سلسلة التوريد ومقارنة الدفعات |
| المتطلبات التنظيمية | غير مناسب لدعم التسويق طلبات الترخيص | ينطبق على دعم العملية بأكملها من التطوير المبكر إلى تسويق المنتجات المرخصة | ينطبق على دعم التطوير المبكر حتى الحصول على ترخيص التسويق |
الجدول 1.مقارنة بين أنواع مختلفة من أطقم الكواشف HCP
خدمة تطوير اختبار HCP المخصص من Yeasen Biotech
نظرًا لأهمية اكتشاف HCP، ياسين تعتمد شركة Biotech على منصة تطوير أجسام مضادة أحادية النسيلة عالية الأداء لإنشاء منصات تطوير المواد الخام الحيوية للأجسام المضادة البروتينية ومختبر مستقل لتطوير منتجات الكشف المناعي، ومجهز بأدوات بحثية متقدمة مثل أجهزة تحليل المناعة الإنزيمية وأنظمة التحليل الكهربائي الهلامي ثنائي الاتجاه 2D-WB-Immonoblotting. منصة التطوير ناضجة للغاية وقادرة على تخصيص مجموعات اختبار HCP بسرعة لمختلف بقايا الخلايا المضيفة بما في ذلك الخلايا الثديية وخلايا الحشرات (مثل Sf9) والبكتيريا والخميرة.
الجدول الزمني للتخصيص
تستغرق خدمة التخصيص لمجموعات الكشف عن بروتين بقايا الخلايا المضيفة عادةً من 6 إلى 10 أشهر.
تحضير المستضد/الأجسام المضادة: تحديد مستضدات HCP، وإنشاء معايير مرجعية لـ HCP، ووضع مسارات واستراتيجيات المناعة، وإعداد أجسام مضادة لـ HCP، وما إلى ذلك، يستغرق عادةً من 4 إلى 6 أشهر.
تطوير مجموعة التحليل: يستغرق تحسين الأجسام المضادة، وتحليل التغطية، والتحقق من صحة طريقة مجموعة التحليل، وما إلى ذلك، عادةً من شهرين إلى أربعة أشهر.
ياسين خدمة التحقق من تغطية الأجسام المضادة من Biotech HCP
من المعروف أن اختبار ELISA هو المعيار الذهبي للكشف عن HCP المتبقي في الصناعة، ولكن دقة هذه الطريقة تعتمد على مدى تغطية الأجسام المضادة متعددة النسخ لـ HCP. يذكر دستور الأدوية الأمريكي ودستور الأدوية الأوروبي تنقية المناعة و2D-WB كطرق موصى بها لتوصيف أجسام مضادة ELISA لـ HCP وتغطيتها.
تغطية الأجسام المضادة لـ HCP تَحَقّق خدمة
يقوم 2D-WB أولاً بفصل البروتينات بناءً على الحجم والشحنة باستخدام الرحلان الكهربائي ثنائي الأبعاد، ثم ينقل هذه البروتينات إلى غشاء للحضانة مع أجسام مضادة لـ HCP للكشف عن بصمة البروتين.
نحن تتمتع بمجموعة كاملة من أجهزة 2D-WB وخبرة معملية واسعة لتوفير خدمات التحقق من تغطية الأجسام المضادة لعينات HCP من الخلايا المضيفة مثل CHO و E.coli و HEK293 وما إلى ذلك.
المنتج ذو الصلة:
| منتج | رقم الكتالوج | مقاس |
| 36712ES | 48 طن/96 طن | |
| 36713ES | 48 طن/96 طن | |
| مجموعة ELISA CHO HCP (CHO-K1) | 36714ES | 48 طن/96 طن |
| طقم اختبار ELISA لـ E.coli HCP (بلازميد) | 36721ES | 48 طن/96 طن |
