Beskrivelse
Replikationskompetent Lentivirus (RCL) Detection Kit anvendes at kvantitativt detektere replikerende lentivirus, der kan forekomme i en forskellige celleprodukter forbundet med lentiviral vektorer potentielle risici.
Dette sæt designer specifikke primere til VSV-G-gensekvens af lentivirale kappeproteiner. Og det vedtager taqman fluorescerende probe og polymerasekædereaktionsmetoden (PCR), som har 1 kopi/μL niveaudetektionsgrænse og kan specifikt og hurtigt opdage den replikationskompetente lentivirusrisiko. Sættet har brug for skal bruges sammen med Residual DNA Sample Preparation Kit (kat. nr. 18461ES).
Komponenter
| Komponenter nr. | Navn | 41311ES50 | 41311ES60 |
| 41311-A | RCL qPCR Mix | 0,75 ml | 1.5 ml |
| 41311-B | RCL Primer & Probe Mix | 200 μL | 400 μL |
| 41311-C | DNA Fortynding Buffer | 2×1,8 ml | 4×1,8 ml |
| 41311-D | RCL DNA-kontrol (5×10E8 kopier/μL)) | 25 μL | 50 μL |
| 41311-E | IC* | 50 μL | 100 μL |
* IC: Indre kontrollere.
Opbevaring
Dette produkt skal opbevares ved -25~-15℃ for 2 år.
Både 41311-A og 41311-B skal opbevares beskyttet mod lys.
Gældende instrument modeller
Inkluder, men ikke begrænset til: Bio-Rad: CFX96 optisk modul; Thermo Scientific: ABI 7500; ABI Quant Studio 5; ABI Step OnePlus.
Instruktioner
- RCL DNA Standard fortynding og Standard kurve forberedelse
RCL DNA-kontrollen blev gradientfortyndet ved hjælp af den DNA-fortyndingsbuffer, der medfølger i sættet* og fortyndingen koncentrationen er 5×10E7 kopier/μL, 5×10E6 kopier/μL, 5×10E5 kopier/μL, 5×10E4 kopier/μL, 5×10E3 kopier/μL, 5×10E2 kopier/μL, 5×10E1 kopier/μL.
Se detaljerede instruktioner nedenfor:
1) Optø RCL DNA-kontrollen og DNA-fortyndingsbufferen på is. Efter helt optøet, vortex forsigtigt til blande, og centrifuger ved lav hastighed i 10 sek.
2) Tag syv rene 1,5 ml rør, mærket med Std0, Std1, Std2, Std3, Std4, Std5, Std6.
3) Tilføj 90 μL DNA-fortyndingsbuffer og 10 μL RCL DNA-kontrol til 1,5 mL mikrofugerøret mærket Std0, nemlig fortyndes til 5×10E7 kopier/μL. Bland og centrifuger derefter i 10 sek. Underpak den fortyndede DNA-standard og det kan være opbevares på kort sigt (ikke mere end 3 måneder) ved -25~-15℃** . Undgå gentagne frys-optøninger.
4) Tilføj 90 μL DNA-fortyndingsbuffer i andre rør*** , og følg derefter nedenstående procedure for de serielle fortyndinger**** .
| Rør | Fortyndingsforhold | Standardkoncentration |
| Std1 | 10 μL Std0 + 90 μL DNA Fortynding Buffer | 5×10E6 kopier/μL |
| Std2 | 10 μL Std1 + 90 μL DNA Fortynding Buffer | 5×10E5 kopier/μL |
| Std3 | 10 μL Std2 + 90 μL DNA Fortynding Buffer | 5×10E4 kopier/μL |
| Std4 | 10 μL Std3 + 90 μL DNA Fortynding Buffer | 5×10E3 kopier/μL |
| Std5 | 10 μL Std4 + 90 μL DNA Fortynding Buffer | 5×10E2 kopier/μL |
| Std6 | 10 μL Std5 + 90 μL DNA Fortynding Buffer | 5×10E1 kopier/μL |
Tabel 1 Standard gradientfortynding
*Tre replikere brønde er påkrævet for hver koncentration.Den opdagelse rækkevidde er 5×10E1 kopier/μL~5×10E6 kopier/μL og denne rækkevidde kan være udvides om nødvendigt.
** Til reducere de antal af gentage fryse-tø og undgå forurening, det er anbefales til butik de DNA kontrollere i alikvoter på -25~-15℃ for de først tid.
*** Engang optøet, DNA fortynding buffer kunne være gemt på 2-8°C for 7 dage, hvis ikke brugt for -en lang tid, tak butik på -25~-15℃ .
**** Lave sikker de skabelon er fuldstændig blandet, forsigtigt ryste de blanding for 15 sek til 1 min for hver gradient fortynding.
- Ekstraktionsgendannelse Kontrollere (ERC) forberedelse
Indstil koncentrationen af RCL-DNA i ERC efter behov (ERC-prøven blev forberedt med 5×10E4 kopierer RCL DNA som et eksempel), som følger:
1) Tilføj 100 μL testprøve i et rent 1,5 ml rør, og tilsæt derefter 10 μL 5×10E3 kopier/μL RCL DNA Standard (Std4) og bland godt, markeret som ERC.
2) Udfør DNA-ekstraktion af ERC-prøven sammen med testprøverne for at forberede den oprensede ERC-prøve.
- Negativ kontrol Løsning (NCS) forberedelse
Indstil den negative kontrol i eksperimentet, de specifikke operationstrin er som følger:
1) Tilføj 100 μL prøvematrix (eller DNA-fortyndingsbuffer) i et rent 1,5 ml rør, derefter markeret som NCS.
2) Udfør DNA-ekstraktion af NCS prøve sammen med testprøverne for at forberede den oprensede NCS prøve.
- Ingen skabelon Kontrollere (NTC) forberedelse
Indstil ingen skabelonkontrol i eksperimentet, de specifikke operationstrin er som følger:
1) NTC kræver ingen prøveforbehandling og kan konfigureres på stadiet af qPCR-detektion af resterende DNA tilfreds.
2) NTC-prøven i hvert rør eller brønd er 20 μL blanding (dvs. 15 μL RCL qPCR Mix + 4 μL RCL Primer og sonde Bland + 1 μL IC) + 10 μL DNA-fortyndingsbuffer. Det anbefales at konfigurere tre replikatbrønde.
- PCR reaktion system
| Komponent | Volumen (μL) |
| RCL qPCR Mix* | 15 |
| RCL Primer & Probe Mix | 4 |
| IC | 1 |
| DNA skabelon | 10 |
| Total bind** | 30 |
Tabel 2 Reaktionssystem
* Beregne de total PCR reaktion bind ved de antal af reaktioner: qPCR Blande =(den antal af reaktioner+2) × (15+4+1) μL (inklusive de tab af to reaktionsbrønde). Mere end tre replikater for hver prøve anbefales i eksperimentet.
** Efter afdækning de rør eller forsegling de plade, centrifuge de reaktion rør eller plade på lav hastighed for 10 sek. Efter tilstrækkelig ryster og blanding for 5 sekunder, gentag centrifuge til samle de flydende fra de låg eller væg til de bund. Undgå bobler under operation.
Se nedenstående tabel for den anbefalede pladeopsætning:
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| EN | NTC |
| TS 1 | TS 1 | TS 1 |
| Std 1 | Std 1 | Std 1 |
|
|
|
| B | NTC |
| TS 2 | TS 2 | TS 2 |
| Std 2 | Std 2 | Std 2 |
|
|
|
| C | NTC |
| TS 3 | TS 3 | TS 3 |
| Std 3 | Std 3 | Std 3 |
|
|
|
| D |
|
|
|
|
|
| Std 4 | Std 4 | Std 4 |
|
|
|
| E | NCS |
| ERC 1 | ERC 1 | ERC 1 |
| Std 5 | Std 5 | Std 5 |
|
|
|
| F | NCS |
| ERC 2 | ERC 2 | ERC 2 |
| Std 6 | Std 6 | Std 6 |
|
|
|
| G | NCS |
| ERC 3 | ERC 3 | ERC 3 |
|
|
|
|
|
|
|
| H |
|
|
|
|
|
|
|
|
|
|
|
|
Tabel 3 Computer-on reference bestyrelse
Pladelayoutet inkluderer: 6 Std (standardkurven med 6 standardkoncentrationer), 1 NTC (ingen skabelonkontrol), 1 NCS (negativ kontrolopløsning), 3 TS (testprøver), 3 ERC (ekstraktionsgenvindingskontrol).Tre replikatbrønde til hver prøve.
- Retningslinjer for opsætning for -en PCR Instrument
Følgende instruktioner gælder kun for Termo ABI 7500 qPCR instrument (Software version 2.0). Hvis du bruger en andet instrument, se den relevante instrumentvejledning for opsætningsvejledninger.
1) Generer et nyt eksperiment, vælg skabelonen for absolut kvantificering eller brugerdefineret.
2) Opret 1 detektionsprobe, kaldet "RCL-DNA", vælg reporterfluorofor som "FAM" og quench fluorofor som "ingen"; opret 1 mere detektionsprobe, navngiv "IC" og vælg reporterfluoroforen som "CY5" og slukning fluorofor som "ingen". Referencefluorescensen er ROX" (referencefluorescensen kan være baseret på instrumentmodel osv., vælg om du skal tilføje det).
3) I 'Sampler'-ruden, tilføj alle prøveoplysningerne efter tur. Vælg derefter brøndene, vælg målet og prøverne tilsvarende. Sæt opgaven med RCL DNA standard som standard, og tildele værdier 5000000, 500000, 50000, 5000, 500, 50 (enheden for DNA-koncentration i hver brønd er kopier/μL) i kolonnen Mængde, og navngiv brønde Std 1, Std 2, Std 3, Std 4, Std 5, Std 6, tilsvarende. Indstil NTC's opgave som NTC. Indstil NCS, TS og ERC som Ukendt, og navngivet dem i henhold til ovenstående pladelayout tilsvarende. Klik derefter på næste.
4) Indstil amplifikationsprogrammet: Indstil reaktionsvolumenet til 30 μL.
| Cyklustrin | Temperatur (℃) | Tid | Cykler |
| Forurenet fordøjelse | 37℃ | 5 min | 1 |
| Indledende denaturering | 95℃ | 5 min | 1 |
| Denaturering | 95℃ | 15 sek |
45 |
| Udglødning/forlængelse (Fluorescenssamling) | 60℃ | 30 sek |
Tabel 4 Amplifikationsprocedure
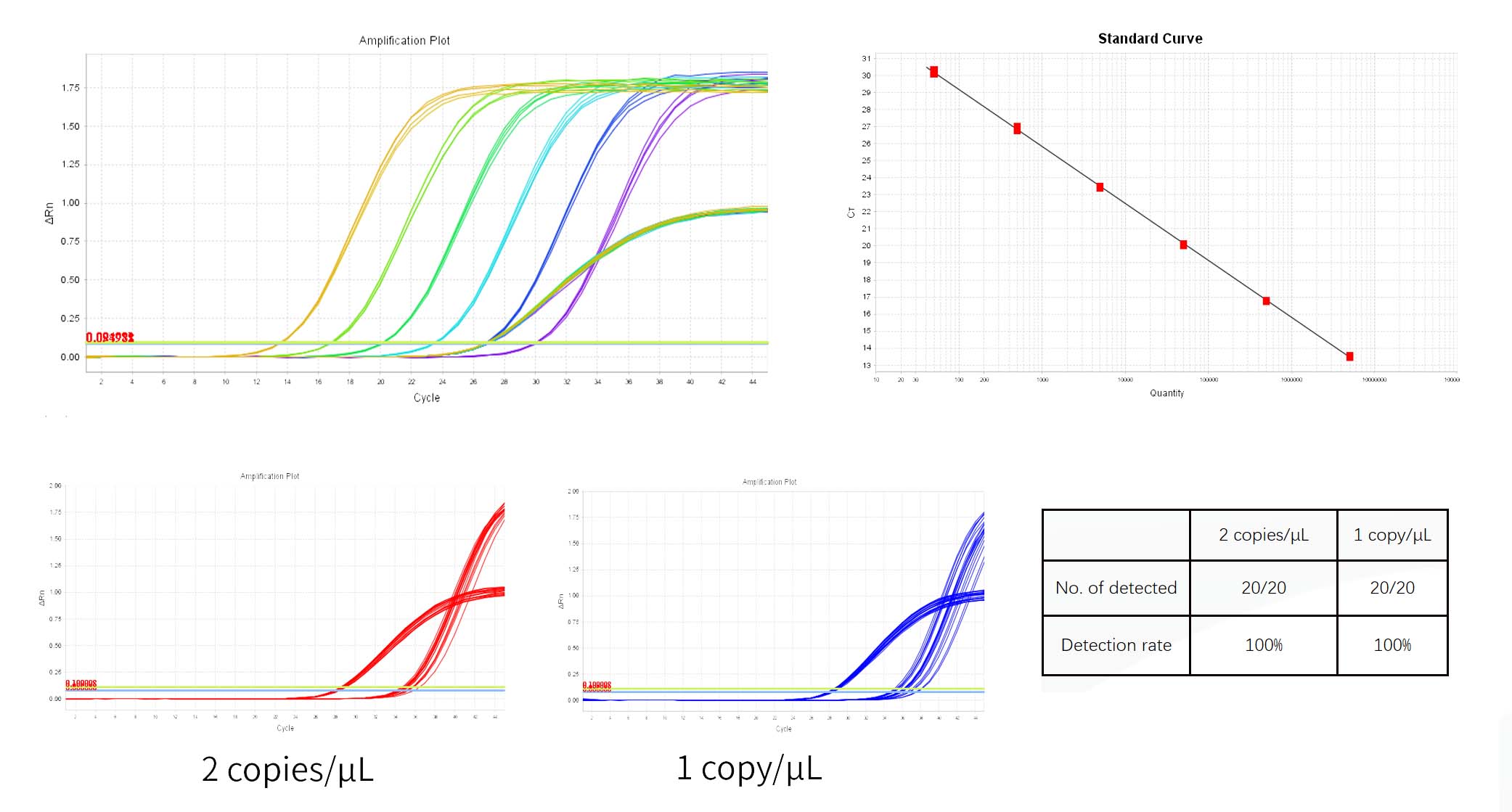
- Analyse af qPCR resultater
1) Systemet vil automatisk give Tærsklen i Forstærkning Plot panel af Analyse. Den givne tærskel af systemet er nogle gange for tæt på basislinjen, hvilket resulterer i en stor forskel i Ct mellem replikatbrønde. Du kan justere manuelt tærsklen til en passende position og klik Analysere. Så kan du i første omgang tjekke om amplifikationskurven er normal i Multicomponent Plot.
2) I Resultatet Analyse-fanen, gennemgå standardkurve-plottet. Bekræft værdier for R2, Effektivitet, Hældning og Y-afskæring. For en normal standardkurve, R²>0,99, 90%≤Eff%≤110%, -3,6≤Slope≤-3,1.
3) I 'Udsigt brøndbordsrude ind Analyse, koncentrationerne af hver prøve er vist i mængde, enheden er kopier/μL, kan enhederne konverteres i analyserapporten.
4) Parameterindstillingerne for Resultatanalysen skal være baseret på den specifikke model og softwaren version bruges, og kan generelt automatisk fortolkes af instrumentet.
5) Beregn spidsgenvindingshastigheden baseret på testresultaterne af prøven TS der skal måles, og prøvespidsen recovery ERC, inddrivelsesgraden af spidser er påkrævet at være mellem 50% ~ 150%. Målerformel med spiked recovery rate:
Genopretning (%) = {Sample spiked assay (eg.copies/μL) - Sample assay (eg.copies/μL)} x Elueringsvolumen (μL) / Teoretisk værdi af DNA-tilsætningsmængde (f.eks. kopier) x 100 %.
6) Ct værdi af den negative kontrol NCS skal være større end gennemsnittet af den laveste koncentration Ct af de standard.
7) Skabelon fri kontrol NTC skulle være ubestemt eller Ct værdi ≥38.
Noter
- Dette produkt er kun til forskningsbrug.
- Arbejd venligst med laboratoriefrakker og engangshandsker for din sikkerhed.
3. Læs venligst denne manual omhyggeligt før brug dette reagens, og forsøget bør standardiseres, herunder prøvehåndtering, klargøring af reaktionssystem og prøvetilsætning.
4.Sørg for, at hver komponent er fuldstændig vortexiseret og centrifugeret ved lav hastighed før brug.
Betaling og sikkerhed
Dine betalingsoplysninger behandles sikkert. Vi gemmer ikke kreditkortoplysninger og har heller ikke adgang til dine kreditkortoplysninger.
Forespørgsel
Du kan også lide
FAQ
Produktet er kun til forskningsformål og er ikke beregnet til terapeutisk eller diagnostisk brug hos mennesker eller dyr. Produkter og indhold er beskyttet af patenter, varemærker og ophavsrettigheder ejet af Yeasen Biotechnology. Varemærkesymboler angiver oprindelseslandet, ikke nødvendigvis registrering i alle regioner.
Visse applikationer kan kræve yderligere tredjeparts intellektuelle ejendomsrettigheder.
Yeasen er dedikeret til etisk videnskab og mener, at vores forskning bør adressere kritiske spørgsmål og samtidig sikre sikkerhed og etiske standarder.