کیت معرف HCP تجاری Yeasen Biotechnology یک روش ساده، بسیار حساس و عینی برای تشخیص HCP است. Yeasen Biotechnology به طور مستقل کیت های معرف متعددی را توسعه داده است که می تواند سطوح باقیمانده HCP را در نمونه ها به دقت تشخیص دهد. این کیتهای معرف را میتوان برای بهینهسازی فرآیند تصفیه بیوداروها، کنترل ناخالصیها در فرآیندهای میانی و آزادسازی آزمایش محصولات نهایی استفاده کرد. آیا میخواهید درباره اینکه چگونه کیتهای معرف HCP شرکت Yeasen Biotechnology میتوانند تولید بیودارویی شما را بهبود بخشند، بیشتر بدانید؟ بخوانید مقاله در حال حاضر!

مفهوم و ضرورت تشخیص HCP
محصولات بیولوژیکی معمولاً با استفاده از فناوری نوترکیب در سلولهای میزبان (مانند سلولهای باکتری، مخمر، پستانداران، حشرات یا گیاهان) از جمله آنتیبادیهای مونوکلونال، پروتئینهای نوترکیب و واکسنها تولید میشوند. فرآیندهای تولید و خالص سازی این محصولات به ناچار پروتئین های سلول میزبان (HCP) را به عنوان ناخالصی معرفی می کنند که هم پروتئین های ساختاری سلول های میزبان و هم فاکتورهای رشد ترشح شده توسط سلول های میزبان را شامل می شود و مخلوط پیچیده ای را با خواص فیزیکوشیمیایی و ایمونولوژیکی مختلف تشکیل می دهد. علیرغم استفاده از تکنیک های تصفیه پیشرفته، برخی از پروتئین های سلول میزبان ممکن است همچنان به عنوان ناخالصی های مربوط به فرآیند در محصولات دارویی میانی باقی بمانند.
این ناخالصی ها ایمنی زایی بالقوه ای دارند و ممکن است پاسخ ایمنی زایی محصولات بیودارویی را افزایش دهند و بر پایداری و کارایی آنها تأثیر بگذارند و در نتیجه خطراتی را برای ایمنی انسان ایجاد کنند. بنابراین، استراتژیهای نظارتی مناسب برای حذف HCPها باید ایجاد شود و محتوای HCP در محصول نهایی باید کنترل شود تا الزامات کیفیت دارو را برآورده کند.
الزامات نظارتی برای HCP
محتوای باقیمانده HCPs در محصولات بیولوژیکی به طور کلی یک ویژگی کیفیت بحرانی (CQA) محصول، یک شاخص ارزیابی مهم برای نظارت بر استحکام فرآیند، و یک شاخص کلیدی کنترل کیفیت محصول در نظر گرفته میشود. مقامات نظارتی در کشورهای مختلف مقرراتی در مورد HCPها دارند که نیازمند تجزیه و تحلیل و خالص سازی بیوداروها برای کاهش HCPهای پروتئین سلول میزبان به سطوح قابل قبول هستند. سطح پذیرش HCP بر اساس شرایط خاص ارزیابی می شود و به عوامل مختلفی از جمله دوز، فرکانس دوز، نوع دارو و شدت بیماری بستگی دارد.
فارماکوپه چینی (ویرایش 2020) تصریح می کند: برای سلول های CHO، HCP باقیمانده باید <0.05٪ (معادل کمتر از 500 ppm) باشد. برای E. coli، HCP باقیمانده باید <0.01٪ باشد.
فصل USP <1132> داروسازی ایالات متحده تصریح می کند: برای تشخیص HCP در داروها باید از یک روش بسیار حساس استفاده کرد و محتوای آن باید کمتر از حد تشخیص باشد (معمولاً کمتر از 100 ppm، یعنی محتوای HCP در 1 میلی گرم پروتئین کل باید کمتر از 100 نانوگرم یا <0.01٪ باشد).
فارماکوپه اروپا EP 2.6.34 مشخص می کند: در محصولات بیولوژیکی، محتوای HCPs باید کمتر از 0.1٪ باشد.
دستورالعمل های کنفرانس بین المللی هماهنگ سازی الزامات فنی برای ثبت داروها برای استفاده انسانی (ICH): ICH Q6B بیان می کند که روش های حساس و معتبر باید برای نظارت بر HCP های باقیمانده اتخاذ شود، با مقدار باقیمانده که معمولاً کمتر از 100 ppm لازم است.
مشاهده می شود که آژانس های نظارتی الزامات بسیار سازگاری برای HCP دارند. فرآیند توسعه محصولات بیولوژیکی باید تحت تشخیص HCP قرار گیرد، نشان می دهد که فرآیند تصفیه می تواند HCP ها را به سطوح ایمن کاهش دهد، و محدودیت های توصیه شده برای محتوای باقیمانده در محصول نهایی زیر 0.01٪ در چین و ایالات متحده است.
روش های تشخیص HCP
در حال حاضر روش ایمونوسوربنت متصل به آنزیم (ELISA) رایج ترین روش برای تشخیص HCP است. روشهای تشخیص باقیمانده پروتئین میزبان ذکر شده در فصلهای 3412/3413/3414 نسخه 2020 فارماکوپه چینی، همه روشهای الایزا هستند.
فصل USP <1132> داروسازی ایالات متحده همچنین اشاره می کند که روش هایی مانند الکتروفورز، الایزا و LC-MS/MS را می توان برای تشخیص محتوای HCP استفاده کرد و الایزا به دلیل سهولت کار، سرعت، حساسیت بالا و توان عملیاتی بالا به عنوان روش ترجیحی برای تشخیص HCP توصیه می شود.
الایزا:
هدف: مقدار کل پروتئین ها را در HCP ها تشخیص می دهد، می تواند برای توسعه محصول و کنترل فرآیند استفاده شود و در حال حاضر یک روش رایج برای تشخیص HCP است.
مزایا: حساسیت و ویژگی بالا؛ توان عملیاتی و اتوماسیون بالا؛ کمی؛ عملکرد آسان و سریع.
معایب: به آنتی بادی های خاص نیاز دارد. نمی تواند به طور خاص HCP های فردی را شناسایی و ارزیابی کند. توسعه روش پیچیده است، نیاز به آماده سازی آنتی ژن خاصی دارد. بسیاری از عوامل موثر بر روش، پوشش HCP باید ارزیابی شوند. نمی توان گونه ها را شناسایی کرد.

وسترن بلاتینگ:
هدف: برای غربالگری مداوم تعداد زیادی از نمونه ها و شناسایی پروتئین های ناشناخته ای که با آنتی بادی های ضد HCP واکنش می دهند استفاده می شود. مناسب برای تشخیص HCPs و ارائه اطلاعات تقریبی در مورد وزن مولکولی نسبی HCPs.
مزایا: ویژگی؛ نتایج از نظر بصری شهودی هستند: تفاوتها در اندازه پروتئین و سطوح بیان را تجسم میکند. می تواند HCP های خاص را شناسایی و تعیین کند.
معایب: نیمه کمی؛ محدود به پروتئین های خاص: فقط می تواند HCP های متصل به آنتی بادی ها را تشخیص دهد. به اندازه کافی برای مخلوط های پروتئینی پیچیده حساس نیست. دناتوره شدن پروتئین SDS ممکن است منجر به از دست دادن اپی توپ های ساختاری شود. حساسیت به کیفیت آنتی بادی های پلی کلونال بستگی دارد.
الکتروفورز ژل دو بعدی (2-DE):

هدف: معمولاً برای توسعه و شناسایی فرآیندهای بالادستی یا پایین دستی استفاده می شود، می تواند HCP های مختلف را روی یک ژل تشخیص دهد.
مزایا: بدون نیاز به وسترن بلات، اجتناب از مسائل انتقال. می تواند مقادیر کمی از ناخالصی های HCP را از محصول جدا کند. اطلاعات تقریبی در مورد وزن مولکولی نسبی و نقطه ایزوالکتریک ارائه می دهد.
معایب: پروتئین بیش از حد ممکن است لکه های HCP را بپوشاند. توزیع HCPs در نمونه قابل مشاهده است، اما نمی توان آن را کمی سازی کرد.

تجزیه و تحلیل طیف سنجی جرمی:
هدف: HCP های فردی را شناسایی می کند، اطلاعات شناسایی دقیق و کمی را برای پروتئین های سلول میزبان ارائه می دهد.
مزایا: وضوح و دقت بالا؛ HCP های فردی را شناسایی و نظارت می کند. طیف جامعی از HCP ها را ارائه می دهد. می تواند طیف وسیعی از پروتئین ها را پوشش دهد. می تواند گونه های HCP را شناسایی کند.
معایب: تجهیزات بالا و الزامات فنی؛ عملیات پیچیده؛ هزینه بالا؛ توان عملیاتی کم؛ پیش تصفیه نمونه پیچیده؛ اثرات ماتریس بالقوه؛ به توانایی های تخصصی تجزیه و تحلیل داده ها نیاز دارد.
ELISA روش توصیه شده برای تشخیص HCPs باقیمانده در محصولات بیولوژیکی توسط فارماکوپه در کشورهای مختلف است که قادر به تعیین مقدار کل HCPs است. با این حال، محدودیت هایی در شناسایی انواع و فراوانی HCPs دارد و نیاز به تکمیل با روش های دیگر دارد. هر روش تشخیص مزایا و معایب خود را دارد و در کاربردهای عملی میتوان بر اساس اهداف آزمایشی، ویژگیهای نمونه، دقت و راحتی عملیاتی، از جمله عوامل دیگر، انتخاب را انجام داد و با استفاده از روشهای مختلف نتایج جامعتر و دقیقتری به دست آورد.
علاوه بر این، داروسازی ایالات متحده USP <1132> و فارماکوپه اروپایی EP 2.6.34. سنجشهای پروتئین سلول میزبان نشان میدهد که معرفهای ELISA مختلف باید برای تشخیص HCP در مراحل مختلف توسعه محصول استفاده شوند، روشهای تشخیص HCP را به معرفهای تجاری، روشهای محصول/فرآیند خاص و روشهای پلت فرم دستهبندی میکنند.
USP <1132> اشاره می کند که در غیاب روش های پلت فرم، معرف های تجاری می توانند در آزمایشات بالینی پیش بالینی، فاز I و فاز II استفاده شوند. در کارآزماییهای بالینی فاز III/ اعتبار سنجی فرآیند و محصول پس از بازاریابی، به دلیل محدودیتهایی مانند پوشش ناکافی آنتیبادی از معرفهای عمومی تشخیص HCP تجاری، باید به عواملی مانند نوع سلول و ویژگی فرآیند، استفاده از روشهای پلت فرم یا روشهای خاص محصول/فرآیند برای توسعه فرآیند بالادستی توجه شود.
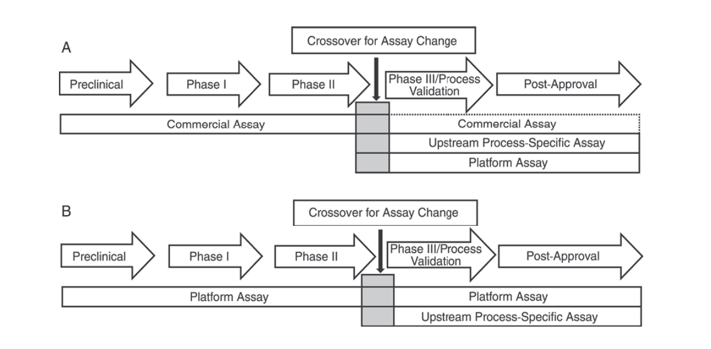
شکل 1. در USP <1132>، مراحل مختلف توسعه محصول برای استفاده از روش های خاص برای تشخیص HCP پیشنهاد شده است.
| روش | کیت معرف تجاری | تشخیص خاص محصول/فرآیند کیت | تشخیص پلت فرم کیت |
| در دسترس بودن | به راحتی در دسترس است
| نیاز به آماده سازی آنتی ژن ها از جمله شبیه سازی رده های سلولی میزبان دارد
| نیاز به تهیه آنتی ژن با استفاده از خطوط سلولی برهنه یا خالی دارد
|
| توسعه | به حداقل آمادگی نیاز دارد | توسعه تشخیص شامل شناسایی آنتی ژن، ایمن سازی و تایید معمولا حداقل 6 ماه طول می کشد | توسعه تشخیص شامل شناسایی آنتی ژن، ایمن سازی و تایید معمولا حداقل 9 ماه طول می کشد |
| تنوع | محدود به رایج ترین سیستم های بیان | انواع مختلفی از سیستم های بیانی را می توان استفاده کرد | انواع مختلفی از سیستم های بیانی را می توان استفاده کرد |
| خاص بودن | ویژگی ممکن است ضعیف باشد، با HCPهای بالقوه شناسایی نشده
| ویژگی معمولاً افزایش می یابد، با پوشش آنتی بادی که الگوهای خاص HCP را هدف قرار می دهد | در مقایسه با روشهای تشخیص تجاری، ویژگی بهبود مییابد، درک عملکرد تشخیص افزایش مییابد و پوشش انواع HCP نیز افزایش مییابد. |
| هزینه | قیمت های اولیه نسبتاً ارزان هستند، اما هزینه های توسعه به سرعت برای کل فرآیند تصفیه پایین دست افزایش می یابد | هزینه های اولیه بالاتر است، اما نقطه سربه سر معمولاً در ارزش 100 مجموعه کیت معرف است. | با توجه به کاربرد آن برای چندین محصول، مزایای هزینه قابل توجهی دارد |
| وابستگی | بسته به یک تامین کننده خاص، معرف ها و طرح های کنترل در حالت "جعبه سیاه" هستند. | دارای کنترل جامع بر روی تمام معرف ها و بافرها، قابل تنظیم در هر زمان | دارای مالکیت و کنترل کامل بر روی تمام معرف ها، کاهش خطرات در زنجیره تامین و قابلیت مقایسه دسته ای |
| الزامات نظارتی | برای حمایت از بازاریابی مناسب نیست برنامه های مجوز | قابل استفاده برای پشتیبانی از کل فرآیند از توسعه اولیه تا بازاریابی محصولات دارای مجوز | برای حمایت از توسعه اولیه تا مجوز بازاریابی قابل استفاده است |
جدول 1.مقایسه انواع کیت معرف HCP
خدمات توسعه سنجش HCP سفارشی Yeasen Biotech
با توجه به اهمیت تشخیص HCP، Yeasen Biotech بر یک پلت فرم توسعه آنتی بادی مونوکلونال با کارایی بالا برای ایجاد پلت فرم های توسعه مواد خام حیاتی آنتی بادی پروتئین و یک آزمایشگاه مستقل برای توسعه محصول تشخیص ایمنی، مجهز به ابزارهای تحقیقاتی پیشرفته مانند آنالایزرهای ایمونواسی آنزیمی و سیستم های الکتروفورز-ایمونوبلات ژل دو طرفه 2D-WB متکی است. پلت فرم توسعه بسیار بالغ است و قادر به سفارشی سازی سریع کیت های سنجش HCP برای باقی مانده های سلول میزبان مختلف از جمله سلول های پستانداران، سلول های حشرات (مانند Sf9)، باکتری ها و مخمرها است.
جدول زمانی سفارشی سازی
خدمات سفارشی سازی برای کیت های تشخیص پروتئین باقی مانده سلول میزبان معمولاً 6 تا 10 ماه طول می کشد.
آماده سازی آنتی ژن-آنتی بادی: تعیین آنتی ژن های HCP، ایجاد استانداردهای مرجع HCP، ابداع مسیرها و استراتژی های ایمنی، تهیه آنتی بادی های HCP و غیره معمولاً 4 تا 6 ماه طول می کشد.
توسعه کیت سنجش: بهینه سازی آنتی بادی، آنالیز پوشش، اعتبارسنجی روش کیت سنجش و غیره معمولاً 2 تا 4 ماه طول می کشد.
Yeasen خدمات تأیید پوشش آنتی بادی HCP بیوتک
مشخص شده است که ELISA استاندارد طلایی برای تشخیص HCP باقیمانده در صنعت است، اما دقت این روش به پوشش آنتی بادی های چند کلون به HCP بستگی دارد. فارماکوپیا ایالات متحده و داروسازی اروپایی تصفیه ایمنی و 2D-WB را به عنوان روش های توصیه شده برای مشخص کردن آنتی بادی های HCP ELISA و پوشش آنها ذکر می کنند.
پوشش آنتی بادی HCP تأیید خدمات
2D-WB ابتدا پروتئین ها را بر اساس اندازه و بار با استفاده از الکتروفورز ژل دو بعدی جدا می کند، سپس این پروتئین ها را به یک غشاء برای انکوباسیون با آنتی بادی های HCP برای تشخیص اثر پروتئین منتقل می کند.
ما مجموعه ای کامل از ابزار دقیق 2D-WB و تجربه آزمایشگاهی گسترده برای ارائه خدمات تأیید پوشش آنتی بادی برای نمونه های HCP از سلول های میزبان مانند CHO، E.coli، HEK293 و غیره دارد.
محصول مرتبط:
| محصول | شماره کاتالوگ | اندازه |
| 36712ES | 48T/96T | |
| 36713ES | 48T/96T | |
| کیت CHO HCP ELISA (CHO-K1) | 36714ES | 48T/96T |
| کیت E.coli HCP ELISA (پلاسمید) | 36721ES | 48T/96T |
