Le kit de réactifs HCP commercial de Yeasen Biotechnology est une méthode simple, très sensible et objective pour la détection des HCP. Yeasen Biotechnology a développé de manière indépendante plusieurs kits de réactifs, qui peuvent détecter de manière sensible les niveaux résiduels de HCP dans les échantillons. Ces kits de réactifs peuvent être utilisés pour optimiser le processus de purification des produits biopharmaceutiques, contrôler les impuretés dans les processus intermédiaires et valider les tests des produits finis. Vous souhaitez en savoir plus sur la manière dont les kits de réactifs HCP de Yeasen Biotechnology peuvent améliorer votre production biopharmaceutique ? Lire l'article maintenant !

Concept et nécessité de la détection des HCP
Les produits biologiques sont généralement fabriqués à l'aide de la technologie recombinante dans des cellules hôtes (telles que des bactéries, des levures, des cellules de mammifères, d'insectes ou de plantes), notamment des anticorps monoclonaux, des protéines recombinantes et des vaccins. Les processus de fabrication et de purification de ces produits introduisent inévitablement des protéines de cellules hôtes (HCP) sous forme d'impuretés, qui comprennent à la fois des protéines structurelles des cellules hôtes et des facteurs de croissance sécrétés par les cellules hôtes, formant un mélange complexe aux propriétés physicochimiques et immunologiques diverses. Malgré l'utilisation de techniques de purification avancées, certaines protéines de cellules hôtes peuvent encore rester sous forme d'impuretés liées au processus dans les produits pharmaceutiques intermédiaires.
Ces impuretés ont une immunogénicité potentielle et peuvent renforcer la réponse immunogène des produits biopharmaceutiques, affectant leur stabilité et leur efficacité, ce qui présente des risques pour la sécurité humaine. Par conséquent, des stratégies de surveillance appropriées pour l'élimination des HCP doivent être établies et la teneur en HCP du produit final doit être contrôlée pour répondre aux exigences de qualité des médicaments.
Exigences réglementaires pour les professionnels de la santé
La teneur résiduelle en HCP dans les produits biologiques est généralement considérée comme un attribut de qualité critique (CQA) du produit, un indice d'évaluation important pour la surveillance de la robustesse du processus et un indice de contrôle qualité clé du produit. Les autorités réglementaires de divers pays ont des dispositions concernant les HCP, exigeant l'analyse et la purification des produits biopharmaceutiques pour réduire les HCP des protéines des cellules hôtes à des niveaux acceptables. Le niveau d'acceptation des HCP sera évalué en fonction de circonstances spécifiques et dépend de plusieurs facteurs, notamment la dose, la fréquence de dosage, le type de médicament et la gravité de la maladie.
La pharmacopée chinoise (édition 2020) stipule : pour les cellules CHO, le HCP résiduel doit être < 0,05 % (équivalent à moins de 500 ppm) ; pour E. coli, le HCP résiduel doit être < 0,01 %.
Le chapitre USP <1132> de la pharmacopée américaine spécifie : Une méthode hautement sensible doit être utilisée pour détecter les HCP dans les médicaments, et la teneur doit être inférieure à la limite de détection (généralement inférieure à 100 ppm, c'est-à-dire que la teneur en HCP dans 1 mg de protéines totales doit être inférieure à 100 ng, ou < 0,01 %).
La Pharmacopée européenne EP 2.6.34 précise : Dans les produits biologiques, la teneur en HCP doit être inférieure à 0,1 %.
Les lignes directrices de la Conférence internationale sur l'harmonisation des exigences techniques pour l'enregistrement des produits pharmaceutiques à usage humain (ICH) : ICH Q6B stipule que des méthodes sensibles et validées doivent être adoptées pour surveiller les HCP résiduels, la quantité résiduelle devant généralement être inférieure à 100 ppm.
Il est évident que les organismes de réglementation ont des exigences très cohérentes en matière de HCP. Le développement des procédés de produits biologiques doit faire l'objet d'une détection des HCP, démontrer que le processus de purification peut réduire les HCP à des niveaux sûrs, et les limites recommandées pour la teneur résiduelle dans le produit final sont inférieures à 0,01 % en Chine et aux États-Unis.
Méthodes de détection des HCP
Le test ELISA (Enzyme-Linked Immunosorbent Assay) est actuellement la méthode la plus couramment utilisée pour la détection des HCP. Les méthodes de détection des résidus de protéines de l'hôte mentionnées dans les chapitres 3412/3413/3414 de l'édition 2020 de la Pharmacopée chinoise sont toutes des méthodes ELISA.
Le chapitre USP <1132> de la pharmacopée américaine mentionne également que des méthodes telles que l'électrophorèse, l'ELISA et la LC-MS/MS peuvent être utilisées pour détecter la teneur en HCP, et l'ELISA est recommandé comme méthode préférée pour la détection de HCP en raison de sa facilité d'utilisation, de sa vitesse, de sa haute sensibilité et de son débit élevé.
Test ELISA:
But: Détecte la quantité totale de protéines dans les HCP, peut être utilisé pour le développement de produits et le contrôle des processus, et constitue actuellement une méthode courante pour détecter les HCP.
Avantages : Haute sensibilité et spécificité ; Haut débit et capacité d'automatisation ; Quantitatif ; Fonctionnement simple et rapide.
Inconvénients : Nécessite des anticorps spécifiques ; Impossible d'identifier et d'évaluer spécifiquement les professionnels de santé individuels ; Le développement de la méthode est complexe et nécessite une préparation spéciale de l'antigène ; De nombreux facteurs influent sur la méthode, la couverture des professionnels de santé doit être évaluée ; Impossible d'identifier les espèces.

Western blot :
But: Utilisé pour le criblage cohérent d'un grand nombre d'échantillons et la détection de protéines inconnues qui réagissent avec les anticorps anti-HCP. Convient pour détecter les HCP et fournir des informations approximatives sur le poids moléculaire relatif des HCP.
Avantages : Spécificité ; Les résultats sont visuellement intuitifs : visualise les différences de taille et de niveaux d'expression des protéines ; Peut détecter et quantifier des HCP spécifiques.
Inconvénients : Semi-quantitatif ; Limité à des protéines spécifiques : ne peut détecter que les HCP liés aux anticorps ; Pas assez sensible pour les mélanges de protéines complexes ; La dénaturation des protéines SDS peut entraîner la perte d'épitopes conformationnels ; La sensibilité dépend de la qualité des anticorps polyclonaux.
Électrophorèse sur gel bidimensionnelle (2-DE) :

But: Couramment utilisé pour le développement et la caractérisation de processus en amont ou en aval, il peut distinguer différents HCP sur un seul gel.
Avantages : Pas besoin de Western blotting, évitant les problèmes de transfert ; Peut séparer les traces d'impuretés HCP du produit ; Fournit des informations approximatives sur le poids moléculaire relatif et le point isoélectrique.
Inconvénients : Un excès de protéines peut masquer les taches HCP ; la distribution des HCP dans l'échantillon peut être observée, mais ne peut pas être quantifiée.

Analyse par spectrométrie de masse :
But: Identifie les professionnels de santé individuels, fournissant des informations d’identification et de quantification précises pour les protéines des cellules hôtes.
Avantages : Haute résolution et précision ; identifie et surveille les HCP individuels ; fournit des spectres complets de HCP ; peut couvrir une large gamme de protéines ; peut identifier les espèces de HCP.
Inconvénients : Exigences techniques et d'équipement élevées ; Opération complexe ; Coût élevé ; Faible débit de méthode ; Prétraitement complexe des échantillons ; Effets de matrice potentiels ; Nécessite des capacités d'analyse de données spécialisées.
La méthode ELISA est la méthode recommandée par les pharmacopées de divers pays pour détecter les HCP résiduels dans les produits biologiques. Elle permet de déterminer la quantité totale de HCP. Cependant, elle présente des limites dans l'identification des types et des abondances de HCP et doit être complétée par d'autres méthodes. Chaque méthode de détection présente ses avantages et ses inconvénients. Dans les applications pratiques, la sélection peut être effectuée en fonction des objectifs expérimentaux, des caractéristiques de l'échantillon, de la précision et de la commodité opérationnelle, entre autres facteurs, combinés à l'utilisation de différentes méthodes pour obtenir des résultats plus complets et plus précis.
En outre, la Pharmacopée américaine USP <1132> et la Pharmacopée européenne EP 2.6.34. HOST-CELL PROTEIN ASSAYS indiquent que différents réactifs ELISA doivent être utilisés pour la détection des HCP à différentes étapes du développement du produit, en classant les méthodes de détection des HCP en réactifs commerciaux, méthodes spécifiques au produit/processus et méthodes de plate-forme.
L'USP <1132> mentionne qu'en l'absence de méthodes de plate-forme, les réactifs commerciaux peuvent être utilisés dans les essais cliniques précliniques, de phase I et de phase II ; dans les essais cliniques de phase III/validation de processus et produit post-commercialisation, en raison de limitations telles qu'une couverture d'anticorps insuffisante des réactifs commerciaux de détection générale des HCP, il convient de prendre en compte des facteurs tels que le type de cellule et la spécificité du processus, en utilisant des méthodes de plate-forme ou des méthodes spécifiques au produit/processus pour le développement du processus en amont.
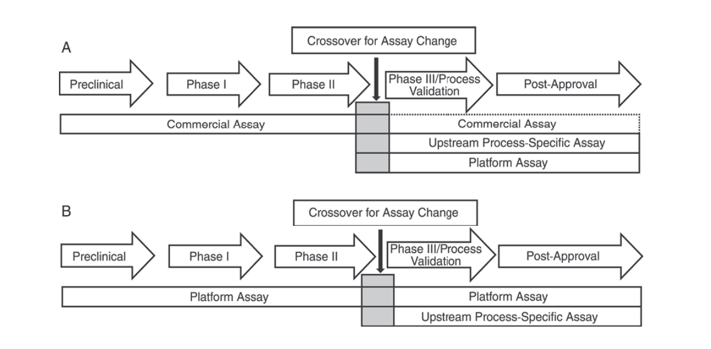
Figure 1. Dans l'USP <1132>, différentes étapes du développement du produit sont suggérées pour utiliser des méthodes spécifiques de détection des HCP.
| Méthode | Kit de réactifs commerciaux | Détection spécifique au produit/processus Trousse | Détection de plate-forme Trousse |
| Disponibilité | Facilement disponible
| Nécessite la préparation d'antigènes, y compris le clonage de lignées cellulaires hôtes
| Nécessite la préparation d'antigènes à l'aide de lignées cellulaires vectorielles nues ou vides
|
| Développement | Nécessite une préparation minimale | Le développement de la détection, y compris la caractérisation de l'antigène, l'immunisation et la confirmation, prend généralement au moins 6 mois | Le développement de la détection, y compris la caractérisation de l'antigène, l'immunisation et la confirmation, prend généralement au moins 9 mois |
| Diversité | Limité aux systèmes d'expression les plus courants | Différents types de systèmes d'expression peuvent être utilisés | Différents types de systèmes d'expression peuvent être utilisés |
| Spécificité | La spécificité peut être faible, avec des professionnels de la santé potentiellement non détectés
| La spécificité est généralement améliorée, avec une couverture d'anticorps ciblant des modèles HCP spécifiques | Par rapport aux méthodes de détection commerciales, la spécificité est améliorée, la compréhension des performances de détection est améliorée et la couverture des types de HCP est également augmentée. |
| Coût | Les prix initiaux sont relativement bon marché, mais les coûts de développement augmenteront rapidement pour l’ensemble du processus de purification en aval | Les coûts initiaux sont plus élevés, mais le seuil de rentabilité se situe généralement à la valeur de 100 ensembles de kits de réactifs | En raison de son applicabilité à de multiples produits, il présente des avantages de coût significatifs |
| Dépendance | En fonction d'un fournisseur spécifique, les réactifs et les schémas de contrôle sont dans un état de « boîte noire ». | Dispose d'un contrôle complet sur tous les réactifs et tampons, peut être ajusté à tout moment | Possède la propriété et le contrôle complets de tous les réactifs, réduisant ainsi les risques dans la chaîne d'approvisionnement et la comparabilité des lots |
| Exigences réglementaires | Ne convient pas pour soutenir le marketing demandes d'autorisation | Applicable pour soutenir l'ensemble du processus depuis le développement précoce jusqu'à la commercialisation des produits sous licence | Applicable pour soutenir le développement précoce jusqu'à l'autorisation de mise sur le marché |
Tableau 1.Comparaison des différents types de kits de réactifs HCP
Service de développement d'essais HCP personnalisés de Yeasen Biotech
Compte tenu de l’importance de la détection des HCP, Yeasen Biotech s'appuie sur une plateforme de développement d'anticorps monoclonaux hautes performances pour établir des plateformes de développement de matières premières essentielles pour les anticorps protéiques et un laboratoire indépendant pour le développement de produits de détection immunitaire, équipé d'instruments de recherche avancés tels que des analyseurs d'immuno-essais enzymatiques et des systèmes d'électrophorèse sur gel bidirectionnelle 2D-WB-immunoblotting. La plateforme de développement est très mature et capable de personnaliser rapidement les kits d'analyse HCP pour divers résidus de cellules hôtes, notamment les cellules de mammifères, les cellules d'insectes (telles que Sf9), les bactéries et les levures.
Chronologie de la personnalisation
Le service de personnalisation des kits de détection de protéines résiduelles de cellules hôtes prend généralement de 6 à 10 mois.
Préparation antigène-anticorps : la détermination des antigènes HCP, l'établissement des normes de référence HCP, la conception des voies et stratégies immunitaires, la préparation des anticorps HCP, etc. prennent généralement de 4 à 6 mois.
Développement du kit d'analyse : l'optimisation des anticorps, l'analyse de la couverture, la validation de la méthode du kit d'analyse, etc. prennent généralement de 2 à 4 mois.
Yeasen Service de vérification de la couverture des anticorps des professionnels de la santé en biotechnologie
Il est connu que l'ELISA est la référence absolue pour la détection des HCP résiduels dans l'industrie, mais la précision de cette méthode dépend de la couverture des anticorps multiclones contre les HCP. La Pharmacopée américaine et la Pharmacopée européenne mentionnent l'immunopurification et le 2D-WB comme méthodes recommandées pour caractériser les anticorps ELISA anti-HCP et leur couverture.
Couverture des anticorps HCP Vérification Service
Le 2D-WB sépare d’abord les protéines en fonction de leur taille et de leur charge à l’aide d’une électrophorèse sur gel bidimensionnelle, puis transfère ces protéines sur une membrane pour incubation avec des anticorps HCP pour la détection de l’empreinte protéique.
Nous dispose d'un ensemble complet d'instruments 2D-WB et d'une vaste expérience en laboratoire pour fournir des services de vérification de la couverture d'anticorps pour les échantillons HCP provenant de cellules hôtes telles que CHO, E.coli, HEK293, etc.
Produit associé:
| Produit | Numéro de catalogue | Taille |
| 36712ES | 48T/96T | |
| 36713ES | 48T/96T | |
| Kit ELISA CHO HCP (CHO-K1) | 36714ES | 48T/96T |
| Kit ELISA E.coli HCP (plasmide) | 36721ES | 48T/96T |
