Membrane basale Ceturegel™ - Votre premier choix
Avec l'avancement de la thérapie par cellules souches et le développement de médicaments à base d'organoïdes, la matrice de la membrane basale joue un rôle essentiel en tant que nutriment et support pour les cultures de cellules souches et les organoïdes, les cultures cellulaires 3D et d'autres applications, notamment l'angiogenèse, les expériences de tumorigenèse in vivo, etc. Les extraits de membrane basale Ceturegel™ sont extraits de tumeurs de souris Engelbreth-Holm-Swarm (EHS) riches en protéines de la matrice extracellulaire, notamment la laminine, le collagène de type IV, la nestine, etc. IGF, FGF et autres facteurs de croissance. À température ambiante, la matrice de membrane basale Ceturegel™ polymérise pour former une matrice tridimensionnelle biologiquement active. Elle peut simuler la structure, la composition, les propriétés physiques et les fonctions de la membrane basale cellulaire in vivo, ce qui est bénéfique pour la culture et la différenciation des cellules in vitro et constitue une bonne alternative au matrigel.
1. Qu’est-ce que la matrice membranaire basale Ceturegel™ ?
2. Quel est le rôle de la matrice membranaire basale Ceturegel™ ?
3. Quelles sont les caractéristiques de la matrice membranaire basale Ceturegel™ ?
4. L'application populaire de la matrice de membrane basale Ceturegel™
5. FAQ
6. Guide de sélection de la matrice de membrane basale Ceturegel™ de Yeasen
1. Qu’est-ce que la matrice membranaire basale Ceturegel™ ?
La matrice adjacente aux cellules endothéliales, aux cellules épithéliales, aux cellules musculaires et aux cellules neuronales forme une matrice extracellulaire continue et stratifiée appelée membrane basale. La membrane basale dégénère et se régénère au cours du développement et de la cicatrisation des plaies. Elle soutient non seulement les cellules et les couches cellulaires, mais joue également un rôle important dans la formation des tissus en affectant l'adhésion, la migration, la prolifération et la différenciation cellulaires, qui sont des fonctions de la membrane basale. Par conséquent, on peut dire que la membrane basale est la principale barrière à l'invasion des cellules tumorales métastatiques.
Figure 1. La matrice de la membrane basale Ceturegel™
La matrice de membrane basale Ceturegel™ développée et produite par YEASEN ne contient pas de LDEV (virus améliorant la lactate déshydrogénase) et présente une teneur en endotoxines ultra-faible. Et après la détection des mycoplasmes, pour garantir l'absence de contamination par les mycoplasmes, y compris différents types tels que la concentration de base, la concentration élevée et le faible facteur de croissance.
2. Quel est le rôle de la matrice membranaire basale Ceturegel™ ?
La matrice de membrane basale Ceturegel™ peut être utilisée pour préparer des matrices de membrane basale répondant à diverses exigences. Elle peut être utilisée pour des études de signalisation cellulaire, telles que l'étude du rôle des facteurs de croissance dans la formation des tubules rénaux par des cellules souches rénales de souris, l'étude de l'expression génétique des cellules souches épithéliales mammaires de souris et l'expérience d'invasivité tumorale de Transwell. En même temps, elle peut être utilisée pour l'étude de la morphologie cellulaire, de la fonction biochimique, de la migration, de l'infection et de l'expression génétique. La matrice de membrane basale Ceturegel™ peut aider efficacement à la fixation et à la différenciation des cellules épithéliales et d'autres types de cellules, notamment les cellules nerveuses, les cellules souches, les cellules épithéliales de mammifères, les cellules de mélanome, les cellules endothéliales vasculaires, les cellules thyroïdiennes et les cellules du follicule pileux. En même temps, la matrice de membrane basale Ceturegel™ affecte également le niveau d'expression protéique des cellules épithéliales mammaires murines et soutient la régénération des nerfs périphériques.

Figure 2.Les principales directions d'application de la matrice de membrane basale Ceturegel™
Français Migration et invasion cellulaires en détail : La migration cellulaire, également connue sous le nom de ramper, de mouvement ou de déplacement des cellules, fait référence au mouvement des cellules après avoir reçu un signal de migration ou ressenti un gradient de certaines substances. La migration cellulaire est un processus alterné d'extension des pseudopodes dans la tête cellulaire, d'établissement de nouvelles adhérences et de rétraction de la queue du corps cellulaire. La migration cellulaire est l'une des fonctions de base des cellules normales, et c'est aussi un processus physiologique de croissance et de développement normaux du corps. En tant que forme omniprésente de mouvement des cellules vivantes, elle peut participer à une variété de processus physiologiques et pathologiques collectifs. Tels que le développement embryonnaire, l'angiogenèse, la cicatrisation des plaies, la réponse immunitaire, la réponse inflammatoire, l'athérosclérose, les métastases cancéreuses, etc. Alors que l'invasion cellulaire fait référence à la capacité des cellules à migrer d'une zone à une autre à travers la matrice extracellulaire. L'invasion cellulaire est la réponse des cellules normales et des cellules cancéreuses aux stimuli chimiques et mécaniques. L'invasion cellulaire se produit souvent dans les processus de cicatrisation des plaies, d'angiogenèse, d'inflammation, de métastase des cellules tumorales et d'infiltration anormale des tissus.
3. Quelles sont les caractéristiques de la matrice membranaire basale Ceturegel™ ?
Haute sécurité:pas de LDEV (virus à la lactate déshydrogénase augmenté)
Diversité de concentration:la plage de concentration est comprise entre 8 et 20 mg/ml
Bonne stabilité du lot: processus strict d'inspection de la qualité de la production pour garantir des performances stables entre les lots
Faible teneur en endotoxines:teneur en endotoxines < 8 EU/ml
Détection de contamination:aucun résidu de mycoplasme, de bactérie et de champignon n'a été détecté
Rendement élevé de lots uniques:la production d'un seul lot est supérieure au niveau de 50 L
Compatibilité:Compatible avec tout type de milieu de culture cellulaire
4. L'application populaire de la matrice de membrane basale Ceturegel™
4.1 Essai de migration et d'invasion
La méthode expérimentale pour détecter la capacité de migration et d'invasion des cellules est l'expérience Transwell, et Transwell est également appelée expérience de perforation. La suspension cellulaire est d'abord ajoutée à la chambre car la chambre a des pores denses. Les chambres ont ensuite été placées dans une plaque à 24 puits à laquelle un milieu complet a été ajouté. Les cellules se sont déformées et sont passées à travers les trous de la chambre vers l'extérieur de la chambre plus riche en nutriments, où elles se sont collées à l'extérieur. En colorant et en comptant les cellules à l'extérieur de la chambre, la capacité de migration et d'invasion des cellules peut être jugée. Le principe de Transwell est de placer la petite chambre dans la plaque de culture, la petite chambre est appelée chambre supérieure et la plaque de culture est appelée chambre inférieure. Les couches supérieure et inférieure du liquide de culture sont séparées par une membrane en polycarbonate, la couche supérieure du liquide de culture est ajoutée à la chambre supérieure et la couche inférieure du liquide de culture est ajoutée à la chambre inférieure. Les cellules se trouvent dans la chambre supérieure et la composition du milieu inférieur affectera les cellules de la chambre supérieure en raison de la perméabilité de la membrane. De plus, les effets des composants du milieu inférieur sur la croissance et le mouvement des cellules ont été étudiés.
Opérations spécifiques de la matrice de membrane basale Ceturegel™ dans les essais de migration et d'invasion : La matrice de membrane basale Ceturegel™ diluée a été ajoutée à la chambre supérieure du Transwell, et les cellules ont été plaquées et incubées dans une solution à 37°C, 5% de CO2 incubateur pendant 24 heures, fixé dans du paraformaldéhyde à 4 % et coloré avec une solution de coloration au violet de cristal à 0,1 %. Les cellules ont été observées et comptées sous un microscope à contraste de phase inversé.
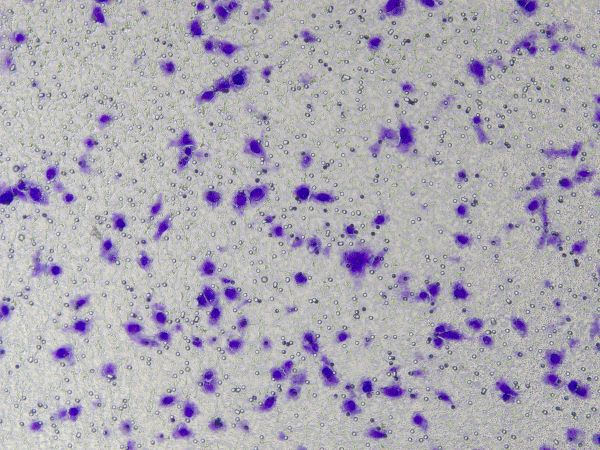
Figure 3. Résultats de la coloration au cristal violet après invasion cellulaire
4.2 Angiogenèse
1) Un jour avant l'expérience, sortez le Ceturegel™ Sortez le Matrigel du congélateur et placez-le au réfrigérateur à 4°C pendant une nuit pour le décongeler tout en pré-refroidissant les consommables utilisés.
2) Conservez toujours le Ceturegel™ Matrigel dans une glacière avant l'expérience. Ouvrez l'emballage stérile des lames angiogéniques et retirez les lames.
3) Ajoutez 10 μl de Ceturegel™ Matrigel dans chaque puits. Notez que la pointe de la pipette doit être perpendiculaire au haut du trou intérieur lors de l'ajout de Ceturegel™ Matrigel pour éviter que le Matrigel ne s'écoule à travers le trou supérieur et ne laisse un résidu de colle.
4) Couvrez d'abord la lame, préparez une boîte de Petri de 10 cm et mettez du papier absorbant imbibé d'eau pour faire une boîte humide.
5) Placez les lames dans la boîte de Petri et couvrez la boîte de Petri. Placez-la dans un CO2 incubateur, laisser reposer environ 30 minutes, attendre que le gel coagule et préparer en même temps la suspension cellulaire.
6) Préparer les cellules digérées dans une suspension cellulaire d'une densité de 2*105 cellules/ml et bien mélanger.
7) Retirer la lame de verre contenant le vaisseau sanguin qui s'est solidifié en gel. Ajouter 50 µl de la suspension cellulaire dans chaque puits, en prenant soin de maintenir la pointe de la pipette verticalement au-dessus du puits supérieur et de ne pas toucher le gel du puits inférieur.
8) Ajoutez le milieu de culture cellulaire, fermez le couvercle et laissez reposer. Après un certain temps, toutes les cellules couleront à la surface du Matrigel.
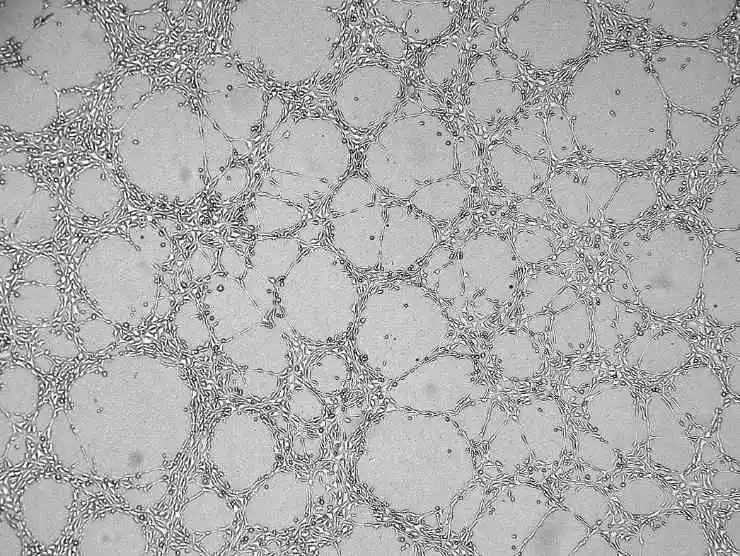
Figure 4. Graphique des résultats de l'angiogenèse
Coloration par immunofluorescence
1) Retirez soigneusement le milieu des puits sans toucher la colle ou le réseau cellulaire. Diluer la calcéine dans un milieu sans sérum jusqu'à une concentration finale de 6 à 8 µg/ml. Ajouter une solution de coloration cellulaire pour submerger complètement les cellules et incuber à température ambiante pendant 30 à 40 minutes dans l'obscurité.
2) Laver trois fois avec du PBS. Notez que le PBS doit être ajouté lentement aux puits supérieurs pour éviter d'impacter les cellules. Observation de la fluorescence en utilisant une longueur d'onde Ex = 485 nm, Em = 529 nm
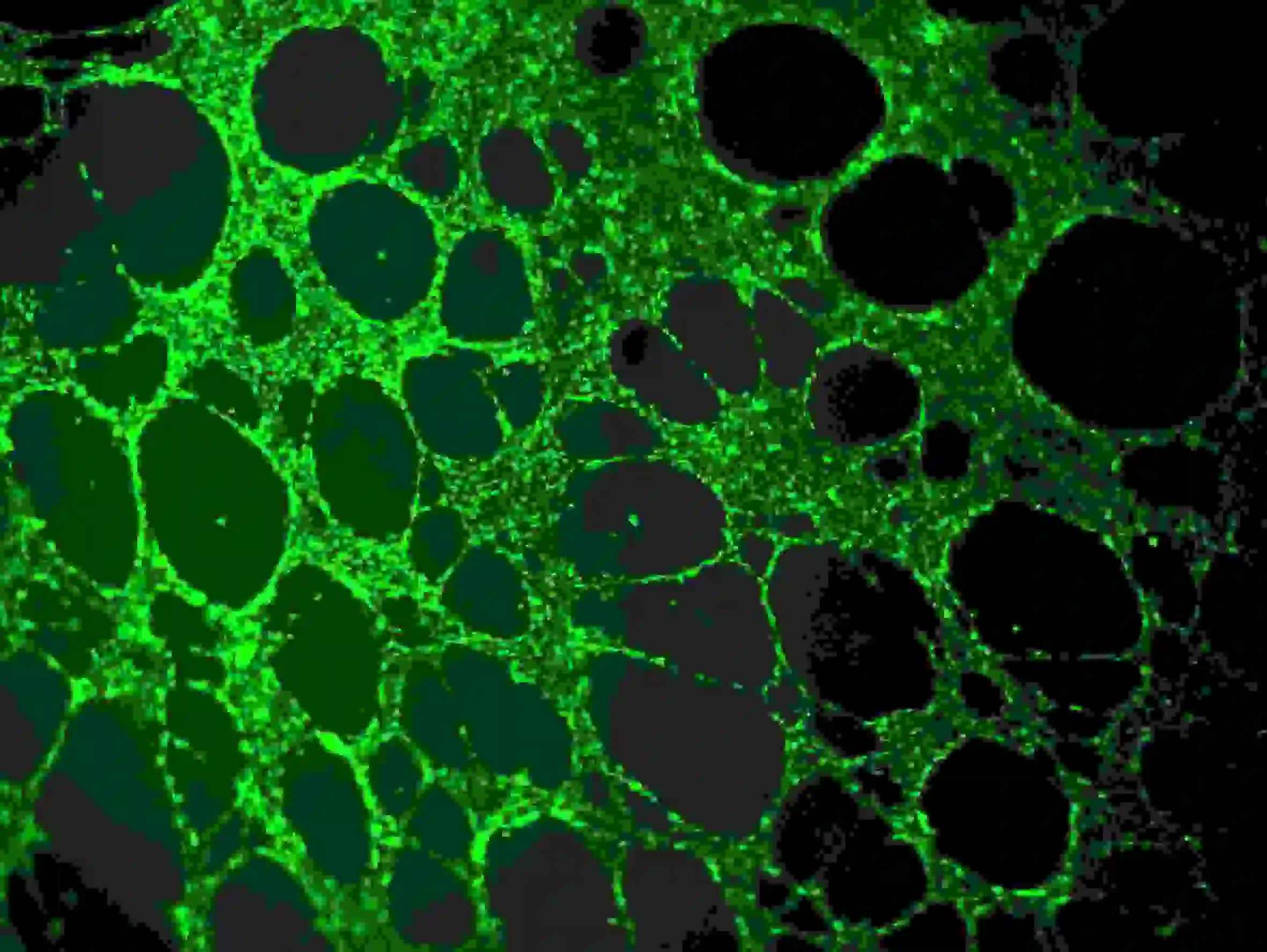
Figure 5. Coloration par immunofluorescence des vaisseaux sanguins
4.3 Culture cellulaire 3D
Contrairement à la culture cellulaire traditionnelle, la culture cellulaire 3D reproduit l'environnement in vivo des cellules. Même de simples modèles sphéroïdes peuvent compenser les défauts des cultures monocouches. Ces structures peuvent former des gradients d'oxygène, de nutriments, de métabolites et de signaux solubles, qui à leur tour forment diverses populations cellulaires. La technologie de culture cellulaire 3D peut mieux simuler l'environnement naturel dans lequel vivent les cellules des organismes, rendant les interactions entre les cellules et les réponses biochimiques et physiologiques plus réalistes. Dans un environnement 3D, les réponses des cellules aux stimuli endogènes et exogènes ressemblent davantage à leurs réponses in vivo.
Le fonctionnement spécifique de la matrice de membrane basale Ceturegel™ dans la culture cellulaire 3D est le suivant : Mélanger délicatement la matrice de membrane basale Ceturegel™ avec la concentration ajustée de suspension unicellulaire HepG2 1:1, et ajouter 50 μl de la suspension unicellulaire mélangée ci-dessus à la plaque à 24 puits pré-refroidie avec une pointe de pipette pré-refroidie pour former des gouttelettes de cellules en forme d'arche qui ont été cultivées dans un incubateur à 37°C, 5% de CO2, observées et photographiées chaque jour.
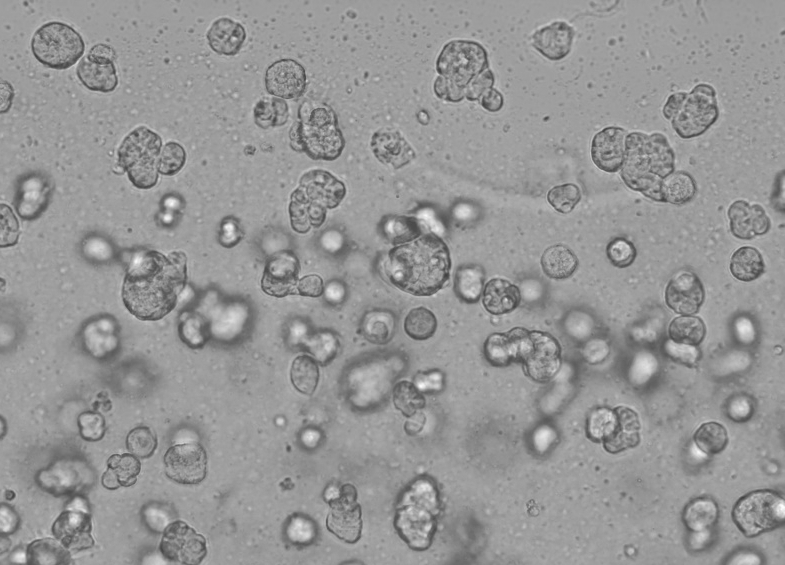
Figure 6. Résultats de la culture cellulaire 3D
Tableau 1. Matrice de membrane basale Ceturegel™ pour culture cellulaire 3D Référence d'utilisation :
| Type de plaque de culture (boîte) | Surface de culture cellulaire (cm2) | Mesure de l'utilisation (concentration ≥ 3 mg/mL)* |
|---|---|---|
| Plaque à 6 puits | 9.6 | 200 μL/cm2 |
| Plaque à 12 puits | 4.5 | 180 μL/cm2 |
| Plaque à 24 puits | 2.0 | 180 μL/cm2 |
| Plaque à 96 puits | 0,32 | 160 μL/cm2 |
| 35 mm plat | 11,78 | 200 μL/cm2 |
| 100 mm plat | 58,95 | 200 μL/cm2 |
Remarque : Différents lots de matrice de membrane basale Ceturegel™ présentent une certaine différence de concentration, le dosage recommandé est fourni à titre indicatif uniquement
4.4 Expérience de formation de tumeurs in vivo
En prenant comme exemple l'expérience de tumorigenèse sous-cutanée des cellules HepG2 chez la souris nude, la matrice de membrane basale et la suspension cellulaire Ceturegel™ ont été utilisées pour une dilution 1:1, et des souris femelles BALB/c-nu âgées de 4 à 5 semaines ont été inoculées par voie sous-cutanée. Le processus expérimental est le suivant :
♦ Préparez les cellules HepG2 avec une croissance logarithmique et une densité cellulaire d'environ 80 à 90 %, et changez le milieu frais la nuit avant la collecte des cellules.
♦ Les cellules sont digérées par la trypsine. Lorsque les cellules deviennent rondes et ne quittent pas la boîte de culture, la trypsine est retirée, le milieu sans sérum est ajouté pour réaliser la suspension cellulaire, centrifugée et nettoyée une fois, et la concentration finale est de 5 × 107 cellules/mL.
♦ Diluer la suspension cellulaire et la matrice de membrane basale Ceturegel™ dans un rapport 1:1 à 4 ℃ pour préparer une concentration finale de 5 × 107 cellules/mL.
♦ Prenez une souris nude fixée avec la main gauche et injectez-la par voie sous-cutanée au niveau de l'épaule droite de la souris nude. Lors de l'inoculation, l'aiguille est insérée par voie sous-cutanée un peu plus profondément, environ 1 cm de profondeur, pour réduire le débordement de la suspension cellulaire du chas de l'aiguille après l'injection.
Le volume d'inoculation est de 200 μ L. (Ce processus doit être terminé dans la mesure du possible en une demi-heure. En cours de route, la suspension cellulaire doit être placée sur de la glace pour ralentir l'apoptose cellulaire et éviter le phénomène de gel).
♦ Remettez les souris nues dans la cage pour continuer à les nourrir, et la tumeur peut être visible pendant environ 1 semaine à 1 mois.Selon le plan expérimental, euthanasiez les souris nues lorsque le volume de la tumeur répond aux exigences et prenez des photos.
Remarque : Le groupe témoin est la suspension du milieu de culture et des cellules, et la densité finale est la même que celle du groupe test de colle matricielle.
4.5 Culture d'organoïdes
Les organoïdes sont de minuscules tissus multicellulaires 3D différenciés à partir de cellules souches. Certaines propriétés des organes peuvent être reproduites. Les organoïdes sont multicellulaires et présentent un degré élevé d'auto-assemblage, et sont donc mieux à même de présenter des réponses et des interactions cellulaires in vivo complexes que les cultures 2D traditionnelles. Les cellules souches et/ou les cellules progénitrices d'organes provenant de tissus normaux ou malades peuvent être mélangées à la matrice de membrane basale Ceturegel™ ou au collagène. Elles forment des reins, de la thyroïde, du foie, du cerveau, des poumons, des intestins, de la prostate et d'autres micro-organes. Par exemple, pour les chercheurs effectuant des criblages génétiques, les substrats de matrice de membrane basale Ceturegel™ peuvent être utilisés comme bio-encres pour permettre une localisation et une intégration précises de cellules/organoïdes vivants dans la bio-impression 3D.
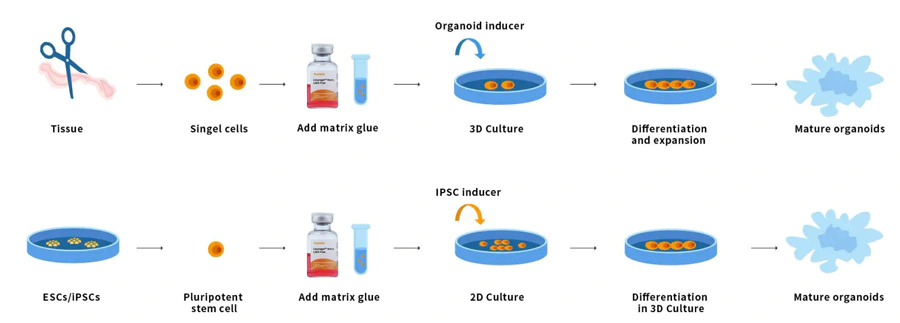
Figure 7. Processus de fonctionnement des organoïdes
Construction d'organoïdes de l'intestin grêle de la souris
Préparation de l'échantillon : Les souris ont été tuées en leur coupant le cou et la surface a été aspergée d'alcool pour la stérilisation. Découpez le tissu intestinal de 3 à 15 cm près de l'extrémité gastrique dans un environnement stérile, retirez soigneusement le mésentère et la graisse à l'extérieur du tractus intestinal avec une pince à épiler et placez-les dans la solution DPBS contenant 1 % d'anticorps double prérefroidi à 4 ℃.
Nettoyage de l'échantillon : utilisez une seringue pour rincer le tractus intestinal 2 à 3 fois, utilisez des ciseaux chirurgicaux pour couper soigneusement le tractus intestinal avec la cavité intestinale tournée vers le haut et utilisez une lame chirurgicale pour gratter doucement les villosités intestinales à la surface de la cavité intestinale, et après que les villosités intestinales soient grattées (montrant un tissu transparent), placez le tissu intestinal dans une nouvelle boîte de culture contenant du DPBS pendant 2 à 3 fois.
Traitement initial des échantillons : couper le tissu intestinal lavé en petits morceaux de 2 mm de large, puis les transférer dans un nouveau tube à centrifuger de 50 ml. Les laver délicatement 3 à 5 fois avec du DPBS pour éliminer les cellules des villosités intestinales et le tissu adipeux flottant.
Digestion d'échantillons : ajoutez 10 à 15 ml de DPBS prérefroidi contenant 3 à 5 mM d'EDTA aux fragments d'intestin grêle nettoyés pour la digestion, incubez à 4 ℃ pendant environ 30 minutes et agitez doucement le tube à centrifuger toutes les 10 minutes pendant cette période.
Après digestion, jetez le surnageant de la solution de digestion EDTA et rincez doucement les tissus avec une nouvelle solution tampon DPBS 2 à 3 fois pour éliminer l'EDTA restant.
Ajoutez 10 à 15 ml de DPBS pré-refroidi contenant 0,1 % de BSA dans les fragments de tissu de l'intestin grêle, soufflez et resuspendez les fragments de tissu à plusieurs reprises pour séparer le creux de la couche basale, puis prélevez une petite suspension pour un examen microscopique. Lorsqu'un grand nombre de structures ressemblant à des creux sont visibles, arrêtez de souffler et utilisez 70 % de la suspension de tissu soufflée. Filtrez et récupérez la suspension de tissu passant à travers le filtre.
Répétez les étapes 5 à 6 deux fois et centrifugez à 1 500 tr/min et 4 ℃ pendant 3 minutes.
Formation du mélange : Précipitation des tissus creux en suspension épaisse de colle matricielle Ceturegel™, chaque suspension de colle matricielle de 10 μL contient 200 à 600 creux. Après remise en suspension, le mélange est placé sur de la glace et utilisé dès que possible pour éviter que la colle matricielle ne forme un gel.
Remarque : le taux de dilution de la colle matricielle ≥ 50 % pour garantir la stabilité de la structure adhésive matricielle de Ceturegel™ lors du processus de culture.
Plantez la suspension mélangée au centre du fond de la plaque à 24 puits, 30 à 50 μL par puits à gauche et à droite pour éviter que la suspension n'entre en contact avec la paroi latérale de la plaque à orifice.
Placez la plaque de culture cultivée dans l'incubateur à température constante de dioxyde de carbone à 37 ℃ et incubez-la pendant environ 30 minutes jusqu'à ce que le gel de matrice se solidifie.
Attendez que Ceturegel™ soit complètement solidifié. Une fois la colle matricielle complètement solidifiée, ajoutez lentement le milieu de culture d'organes intestinaux préparé le long de la paroi, 800 μL par puits.
Placez la plaque à 24 puits dans un incubateur à dioxyde de carbone à 37 ℃ pour la culture. Remplacez le milieu frais tous les 3 jours et surveillez l'état de croissance d'un organe comme un organe. En général, les organes comme un organe de l'intestin grêle de souris se forment en 5 à 7 jours.
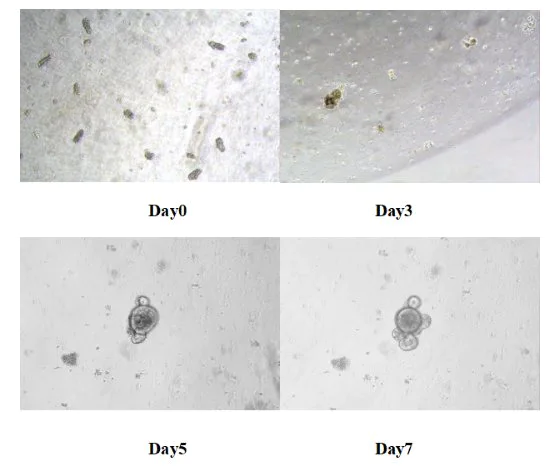
Figure 8. Résultats de la culture in vitro d'organes ressemblant à l'intestin grêle de souris
5. FAQ
1. Quelle est la raison de la différence de couleur (jaune clair à rouge foncé) du substrat obtenu ?
Pour la matrice de membrane basale Ceturegel™ contenant du rouge de phénol, cela est principalement dû à l'interaction du rouge de phénol et du bicarbonate avec le CO2, mais la différence de couleur sera réduite après l'équilibrage avec 5 % de CO2Après congélation et décongélation, agitez doucement le flacon pour disperser uniformément la matrice de membrane basale Ceturegel™.
2. À quels éléments faut-il prêter attention lors du fonctionnement de la matrice de membrane basale Ceturegel™ ?
Toutes les opérations doivent être effectuées dans un environnement stérile et une pipette pré-refroidie doit être utilisée pour garantir que la matrice de la membrane basale Ceturegel™ est homogénéisée.
3. Comment congeler et conserver la matrice de membrane basale Ceturegel™ avant utilisation ?
La matrice de membrane basale Ceturegel™ sans LDEV congelée et décongelée peut être distribuée dans plusieurs petits tubes. Toutes les distributions doivent être effectuées dans des cryotubes pré-refroidis, qui doivent être rapidement congelés et stockés pour éviter de multiples congélations et décongélations. Tous les éléments concernés doivent être pré-refroidis avant utilisation. Utilisez des pipettes, des embouts et des petits tubes pré-refroidis pour manipuler la matrice de membrane basale Ceturegel™.
6. Guide de sélection de la matrice de membrane basale Ceturegel™ de Yeasen
Différents types de matrice de membrane basale Ceturegel™ ont différentes applications. Les concentrations standard de matrice de membrane basale Ceturegel™ peuvent être utilisées pour les cultures de cellules polaires, telles que les cellules épithéliales. Elle peut favoriser la différenciation de diverses cellules et être utilisée pour les expériences de migration et d'invasion de cellules tumorales. Les concentrations élevées de matrice de membrane basale Ceturegel™ sont largement utilisées in vivo et peuvent être utilisées pour les expériences de formation de tubules. La fonction principale du faible facteur de croissance (GFR) est d'éliminer l'interférence des facteurs de croissance dans l'expérience, et elle convient aux études avec des exigences élevées en matière de préparation de la membrane basale. La matrice de membrane basale Ceturegel™ sans rouge de phénol peut éliminer l'interférence de l'indicateur rouge de phénol et convient aux expériences de développement de couleurs, telles que la colorimétrie et la détection de fluorescence. La matrice de membrane basale Ceturegel™ de qualité culture de cellules souches embryonnaires humaines est spécialement utilisée pour la culture de cellules souches embryonnaires humaines, la culture de cellules souches pluripotentes induites sans nourrisseur. Yeasen propose de nombreux types de matrices de membrane basale Ceturegel™, vous pouvez les choisir en fonction de vos expériences.
Tableau 2. Guide de sélection de la matrice Ceturegel™
| Type de produit | N° de chat. | Nom du produit | Matrigel Cat N° | Indications de candidature |
| Concentration basique (8-12 mg/ml) | 40183ES | 356234/ 354234 | S'adapte aux expériences de culture, d'invasion et de migration 2D et 3D, et peut également être utilisé pour des expériences tumorales in vivo | |
| 40184ES | 356237 | Principalement utilisé pour la détection des couleurs telles que les expériences de détection de fluorescence, etc. | ||
| Réduction du facteur de croissance
| 40185ES | 354230 | Essentiellement pour exclure l'interférence des facteurs de croissance sur l'expérience. Appliqué à la recherche connexe sur les facteurs de croissance, les voies de signalisation, etc. | |
| 40186ES | 356231 | |||
| Forte concentration (≥18mg/ml) | 40187ES | 354248 | Principalement utilisé dans des expériences telles que l'angiogenèse, l'embolisation sur gel et la formation de tumeurs in vivo (pour l'angiogenèse, il est recommandé que la concentration finale de la matrice de membrane basale Ceturegel™ soit ≥ 10 mg/ml) | |
| 40189ES (enquête) | Ceturegel™ Matrix Haute concentration, GFR, sans LDEV | 354263 | ||
| 40188ES | Ceturegel™ Matrix Haute concentration, sans rouge de phénol, sans LDEV | 354262 | ||
| Pour les cellules souches | 40190ES | 354277 | Principalement utilisé pour la culture de cellules souches telles que hESC, iPSC, etc. | |
| Organoïde spécifique | 40191ES (enquête) | Matrice Ceturegel™ pour la culture d'organoïdes, sans rouge de phénol, sans LDEV | 356255 | Matrice de membrane basale Ceturegel™ pour la culture d'organoïdes |
