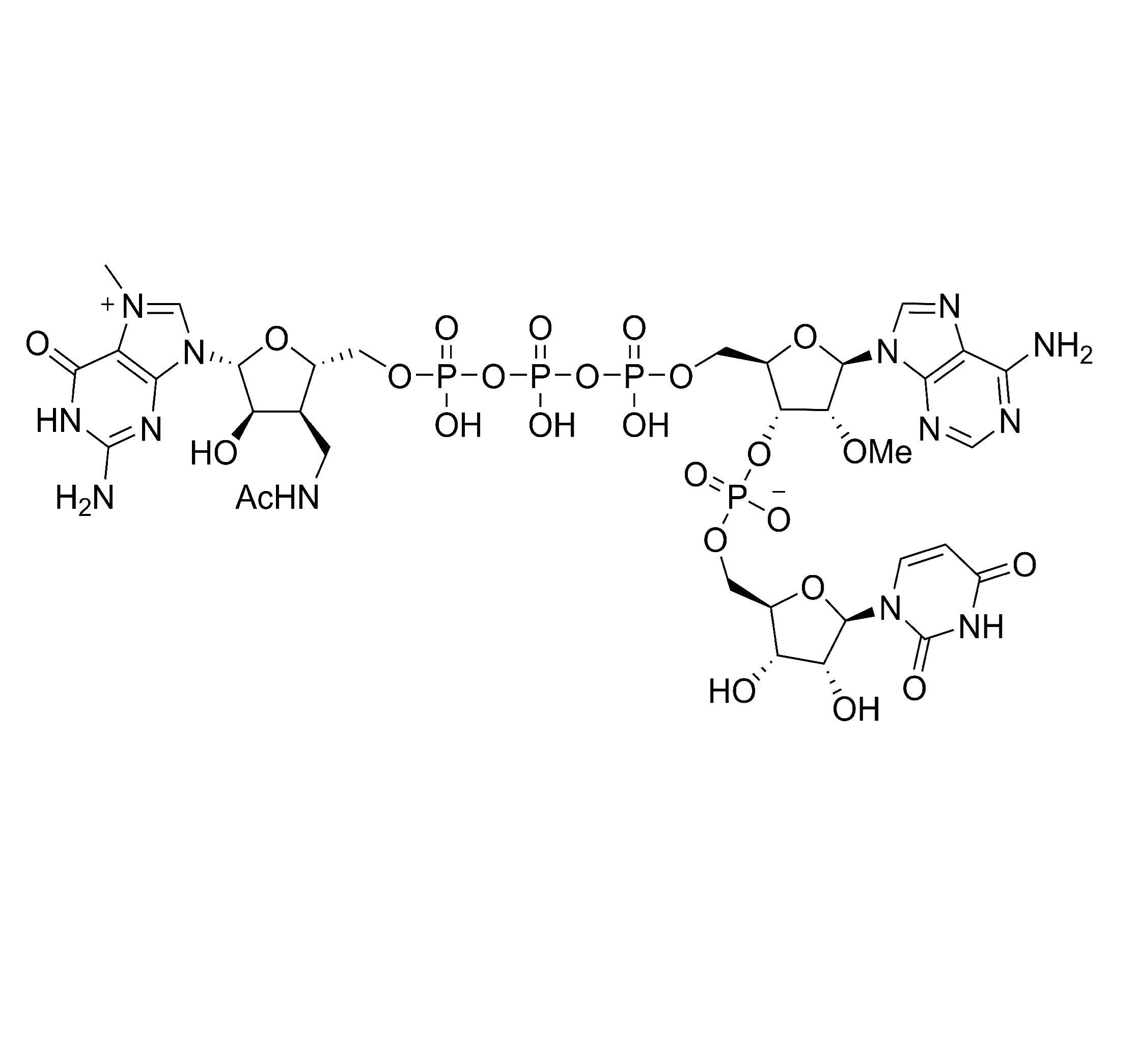
Description
LZCap AU (3'Acm) est un analogue de cap1. Le produit est utilisé pour la transcription avec la séquence initiale de 5'AU3', et la structure naturelle cap1 est produite par le capping de transcription Cap1. Par rapport au Cap0 produit par la méthode de capping traditionnelle, la structure cap1 produite par CapAU (3'Acm) permet au SaRNA d'avoir une activité et une efficacité de traduction plus élevées in vivo.
Brevet américain approuvé.
Composants
| N° de chat. | Nom | Taille |
| 10685 | LZCap AU (3'Acm) (100 mM) | 100 μL |
| 1 ml |
Détails du produit
| Formule moléculaire | C34H47N13O25P4 (Acide libre) |
| Poids moléculaire | 1161,71 (acide libre) |
| Concentration | 100± 3 mM |
| Pureté | HPLC ≥ 95 % |
Capuchon LZ® Modèle de conception d'ADN
Capuchon LZ®AU(3'Acm) est adapté aux séquences initiées par AG. Comme le montre la figure ci-dessous, le promoteur T7 (souligné) suivi de la séquence AG peut initier efficacement la transcription.

Protocole
1. Décongeler les composants nécessaires à l'expérience sur la glace.
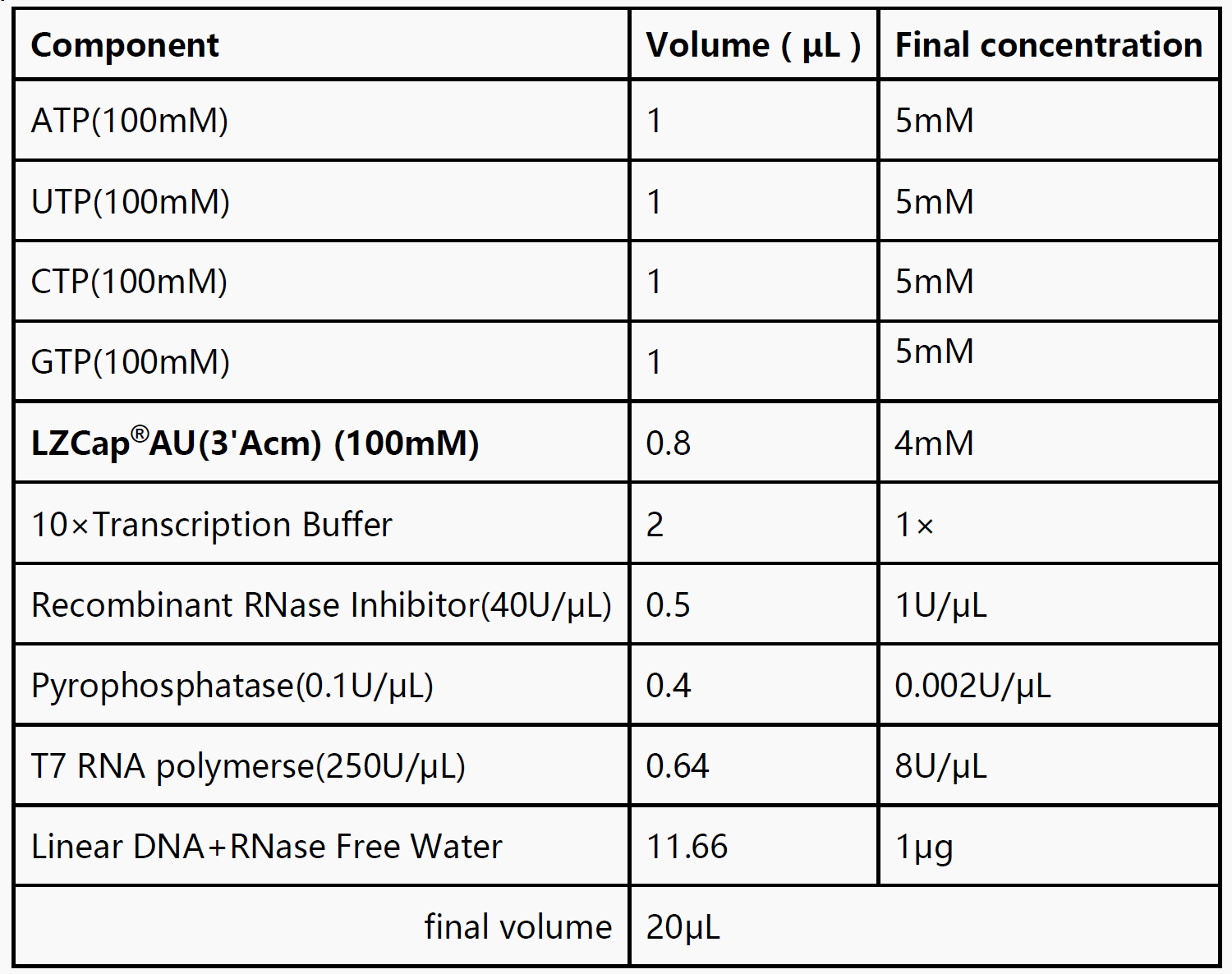
2. Reportez-vous au système de réaction suivant pour configurer le système de transcription à température ambiante.
Le N1-Me-pUTP modifié peut être utilisé à la place de l'UTP de type sauvage. Le N1-Me-pUTP modifié réduit l'immunogénicité de l'ARNm. Henovcom peut également fournir le nucléotide modifié N1-Me-pUTP (Cat. No. : HN1002).
Remarques :
1) Capuchon LZ®AU(3'Acm) convient au vecteur de transcription du promoteur T7 avec 5 séquences initiées par 'AU 3', ce qui doit être pris en compte lors de la construction du vecteur.
2) Les réactifs, consommables et conteneurs utilisés dans l’expérience sont exempts de contamination par la RNase.
3) Il est recommandé d'utiliser un modèle d'ADN linéarisé pour la transcription.
4) Lorsque des nucléotides modifiés ont été utilisés à la place des nucléotides de type sauvage, la concentration finale de la réaction est restée inchangée.
5) Si le produit PCR est utilisé comme modèle d’ADN d’initiation de la transcription, la quantité de modèle d’ADN peut être réduite de moitié.
3. Mélanger la solution de réaction préparée, centrifuger brièvement et incuber à 37°C pendant 2 à 3 heures. Si la longueur de la transcription est inférieure à 100 nt, augmenter le temps de réaction à 4 à 8 heures.
Profil de sécurité générale
| Résultat et Conclusion | |
| Cytotoxicité Test | Non cytotoxicité était observé avec le modifié nucléoside dans multiple cellule lignes |
| Polymérase Inhibition Étude | Le modifié nucléoside est ni l'un ni l'autre un inhibiteur ni un substrat de humain ARN et ADN polymérases et est donc pas intégré dans le génome |
| Amès Test* | Non génotoxicité était observé dans le Amès test |
Stockage
Ce produit peut être stocké à -25~-15 ℃ pendant deux ans.
Précautions
- Pour votre sécurité et votre santé, veuillez porter un équipement de protection individuelle (EPI), tel que des blouses de laboratoire et des gants jetables, lorsque vous utilisez ce produit.
- À usage de recherche uniquement.
Questions et réponses
1. Comment concevez-vous le LZCap ?
Les enzymes ont une reconnaissance relativement « spécifique » des substrats. Par conséquent, lors de la conception d'une nouvelle structure de coiffe, d'une part, nous avons besoin de nouvelles modifications structurelles à des fins de brevet, mais d'autre part, nous nous efforçons de maintenir autant que possible la similitude avec les structures naturelles/connues. La structure naturelle a un ribose 3' OH, qui peut être modifié (par exemple, méthylation). Sur la base de cette considération, nous avons choisi d'ajouter un carbone en position 3' pour la nouveauté du brevet, suivi d'un NH pour imiter la liaison hydrogène de OH, puis d'un groupe acétyle pour réduire la basicité de NH et améliorer sa capacité de liaison hydrogène. LzCap est meilleur que le méthylatecasquette naturelle ed, probablement en raison d'une augmentation des liaisons hydrogène. Comparé aux groupes méthyle et méthoxy, le groupe amino acétyl peut également augmenter les interactions de van der Waals entre le substrat (cap) et le facteur initiateur (enzyme).
2. Le groupe amino acétyl est-il stable ?
Le groupe amino acétyl est déjà suffisamment stable. Il est beaucoup plus stable que la position 7-méthylée et la liaison phosphodiester, qui sont les parties les moins stables de la coiffe.
Veuillez nous contacter pour plus de détails sur la licence LZCap.
Paiement et sécurité
Vos informations de paiement sont traitées en toute sécurité. Nous ne stockons pas les détails de la carte de crédit ni accès aux informations de votre carte de crédit.
Enquête
Vous pouvez aussi aimer
FAQ
Le produit est destiné à des fins de recherche uniquement et n'est pas destiné à un usage thérapeutique ou diagnostique chez l'homme ou l'animal. Les produits et le contenu sont protégés par des brevets, des marques déposées et des droits d'auteur appartenant à Yeasen Biotechnology. Les symboles de marque indiquent le pays d'origine, pas nécessairement l'enregistrement dans toutes les régions.
Certaines applications peuvent nécessiter des droits de propriété intellectuelle tiers supplémentaires.
Yeasen se consacre à la science éthique, estimant que nos recherches doivent répondre à des questions cruciales tout en garantissant la sécurité et les normes éthiques.