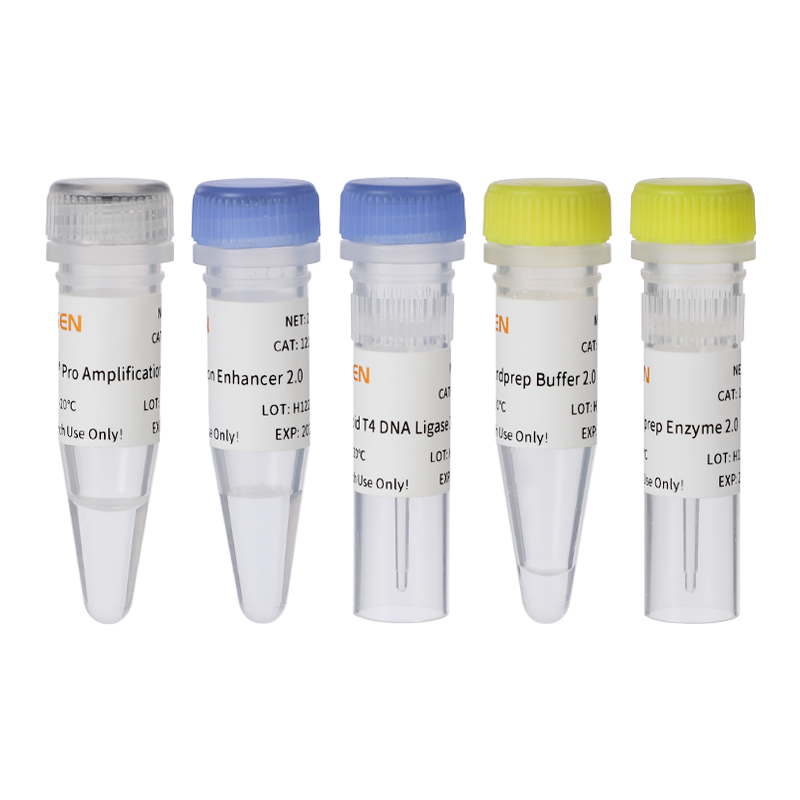
Description
Hieff NGSMT DNA Library Prep Kit est un kit de construction de bibliothèque de nouvelle génération spécialement développé et conçu pour Illumina® et MGI® plateforme de séquençageBasé sur la génération précédente de kit de construction de bibliothèque, ce produit présente une efficacité supérieure à celle des versions précédentes en matière de réparation des extrémités, de dA-tailing et de ligature des adaptateurs. L'enzyme haute fidélité améliore considérablement l'uniformité et la fidélité de l'amplification. Ce kit est compatible avec la plupart des types d'échantillons d'ADN, notamment l'ADN génomique standard d'animaux, de plantes et de micro-organismes, les échantillons FFPE, l'ADN cfDNA et l'ADN ChIP.
Caractéristiques
| N° de cat. | 12927ES08 / 12927ES24 / 12927ES96 |
| Taille | 8 rxn / 24 rxn / 96 rxn |
Composants
| Composants n° | Nom | 12927ES08 | 12927ES24 | 12927ES96 |
| 12927-UN | 56 μL | 168 μL | 672 μL | |
| 12927-B | Enzyme de préparation finale | 24 μL | 72 μL | 288 μL |
| 12927-C | activateur de ligature | 240 μL | 720 μL | 3×960 μL |
| 12927-D | Rapide ADN ligase T4 | 80 μL | 240 μL | 2×480 μL |
| 12927-E | CanaceMT Mixage d'amplification professionnel | 200 μL | 600 μL | 3×800 μL |
Stockage
Ce produit doit être conservé à -25~-15℃ pendant 1 année.
Remarques
1. À propos de l'opération
1. Veuillez travailler avec des blouses de laboratoire et des gants jetables,pour votre sécurité.
2. Décongeler les composants à température ambiante. Après décongélation, bien mélanger au vortex, faire tourner brièvement le tube et le placer sur de la glace pour une utilisation ultérieure.
3. Lors de la préparation de la solution réactionnelle de chaque étape, il est recommandé d'utiliser une pipette pour bien mélanger ou d'agiter doucement. Une agitation vigoureuse peut entraîner une diminution du rendement de la bibliothèque.
4. Il est fortement recommandé d'utiliser des embouts de pipette filtrés pour éviter toute contamination croisée. Veillez à changer d'embout de pipette lors du traitement de différents échantillons.
5. Des opérations incorrectes peuvent très probablement entraîner des contaminations par aérosols, affectant la précision des résultats. Il est recommandé d'isoler physiquement les zones de mélange des réactions PCR et de purification des produits PCR. L'équipement doit être équipé de pipettes spécialisées pour la constitution de bibliothèques.Effectuez un nettoyage de routine pour chaque zone en essuyant les surfaces avec 0,5 % d'hypochlorite de sodium ou 10 % d'eau de Javel.
6. Ce produit est destiné à la recherche uniquement.
2. Fragmentation de l'ADN
1. Ce kit est compatible avec l'ADN fragmenté mécaniquement ou l'ADN fragmenté enzymatiquement.
2. Le kit est compatible avec 100 pg à 1 000 ng d'ADN d'entrée. Il est fortement recommandé d'utiliser de l'ADN d'entrée de haute qualité avec un rapport A260/A280 = 1,8-2,0. Le tableau 1 indique la quantité d'ADN d'entrée recommandée.
Tableau 1 Quantité recommandée d'ADN d'entrée
| Application | Types d'échantillons | Entrée d'ADN |
| WGS | Génome complexe | 50 ng-1000 ng |
| Séquençage de capture ciblé | Génome complexe | 10 ng-1000 ng |
| WGS, séquençage ciblé | ADN FFPE | 50 ng-1000 ng |
| Séquençage ciblé | ADNcf/ADNct | ≥ 500 pg |
| WGS | génomes microbiens | ≥ 1 ng |
| WGS (sans PCR) | ADN d'entrée de haute qualité | ≥ 50 ng |
Note:Lorsque l'ADN d'entrée est de mauvaise qualité ou qu'une sélection de la taille de l'ADN est nécessaire, la quantité d'ADN d'entrée doit être augmentée en conséquence.
3. « ADN d’entrée » fait spécifiquement référence aux échantillons d’ADN prêts pour la réparation finale/la queue dA.
4. Une étape de purification et de sélection de la taille des billes est recommandée après la fragmentation si l'échantillon d'ADN d'entrée contient de fortes concentrations de sels, comme l'agent chélateur des métaux. Ces sels peuvent affecter l'efficacité des réactions suivantes, notamment la réparation des extrémités et la formation de queues dA.Veuillez éluer les échantillons d'ADN dans un tampon TE plutôt que dans de l'eau ultra-pure stérilisée pour la fragmentation si vous utilisez la méthode de fragmentation mécanique. Si vous utilisez la méthode de fragmentation enzymatique sans effectuer de nettoyage des billes ni de sélection de taille avant de procéder à la préparation de la bibliothèque, veuillez vous assurer que le tampon d'arrêt utilisé ne contient pas d'agent chélateur de métaux en excès. Sinon, veuillez nettoyer ou sélectionner la taille des échantillons fragmentés et les éluer dans un tampon TE ou de l'eau ultra-pure stérilisée (≤ 50 μL) avant de procéder à la préparation de la bibliothèque.
3. Ligature de l'adaptateur
1. Les kits d'adaptateurs longs (adaptateurs à code-barres) et les kits d'adaptateurs courts Illumina ou MGI sont disponibles pour que les clients puissent choisir en fonction de leurs besoins expérimentaux.
2. Il a été recommandé de sélectionner des adaptateurs commerciaux de haute qualité. Si vous optez pour des adaptateurs fabriqués par vos soins, veuillez faire appel à une entreprise expérimentée dans la synthèse d'amorces NGS et veiller à un contrôle strict de la contamination. De plus, il est recommandé de préparer la solution d'hybridation de l'ADN sur une paillasse propre et d'utiliser un seul type d'adaptateur à la fois afin d'éviter toute contamination croisée.
3. Veuillez décongeler les adaptateurs sur la glace ou à 4°C ; en fonctionnement à température ambiante, la température du laboratoire ne doit pas dépasser 25°C pour éviter la dénaturation des adaptateurs.
4. La qualité et la concentration des adaptateurs influencent directement l'efficacité de la ligature et le rendement de la bibliothèque. Une concentration trop élevée favorise la formation de dimères, tandis qu'une concentration trop faible réduit le taux de ligature et le rendement de la bibliothèque. Dilutions correspondantes avec le tampon TE en fonction de la quantité d'ADN d'entrée lors de l'utilisation de l'adaptateur. Tableau 2. -5 répertorie les méthodes de dilution d'adaptateur recommandées pour différentes quantités d'ADN d'entrée à l'aide de ce kit.
Tableau 2 L'Illumina™ recommandé quantité d'adaptateur pour différents ADN d'entrée
| Entrée d'ADN | Dilution de l'adaptateur (volume de l'adaptateur : volume total) | Concentration |
| 0,1 ng ~ 1 ng | 150 fois (1 : 150) | 0,1 μM |
| 1 ng ~ 10 ng | 75 fois (1 : 75) | 0,2 μM |
| 10 ng ~ 25 ng | 15 fois (1 : 15) | 1 μM |
| 25 ng ~ 100 ng | 7,5 fois (1 : 7.5) | 2 μM |
| 100 ng ~ 1000 ng | 3 fois (1 : 3) | 5 μM |
Tableau 3 Le MGI™ recommandé quantité d'adaptateur pour différents ADN d'entrée
| Entrée d'ADN | Dilution de l'adaptateur (volume de l'adaptateur : volume total) | Concentration |
| 0,1 ng ~ 1 ng | 100-Fold (1 : 100) | 0,1 μM |
| 1 ng ~ 10 ng | 50-Plier (1 : 50) | 0,2 μM |
| 10 ng ~ 25 ng | 10-Plier (1 : 10) | 1 μM |
| 25 ng ~ 100 ng | 5 fois (1 : 5) | 2 μM |
| 100 ng ~ 1000 ng | 2-Plier (1 : 2) | 5 μM |
Tableau 4 L'Illumina™ recommandé Quantité d'adaptateur UMI pour différentes entrées ADN
| Entrée d'ADN | Dilution de l'adaptateur (volume de l'adaptateur : volume total) | Concentration |
| 0,1 ng ~ 1 ng | 150 fois (1 : 150) | 0,1 μM |
| 1 ng ~ 10 ng | 75 fois (1 : 75) | 0.2 μM |
| 10 ng ~ 25 ng | 15 fois (1 : 15) | 1 μM |
| 25 ng ~ 100 ng | 7,5 fois (1 : 7,5) | 2 μM |
| 100 ng ~ 1000 ng | 3 fois (1 : 3) | 5 μM |
Tableau 5 Le MGI™ recommandé Quantité d'adaptateur UMI pour différentes entrées ADN
| Entrée d'ADN | Dilution de l'adaptateur (volume de l'adaptateur : volume total) | Concentration |
| 5 ng ~ 25 ng | 50-Fold (1 : 50) | 0,2 μM |
| 25 ng ~ 100 ng | 10-Plier (1 : 10) | 1 μM |
| 100 ng ~ 1000 ng | 4-Plier (1 : 4) | 2,5 μM |
4. Nettoyage et sélection de la taille de l'ADN à base de billes
1. La sélection de la taille de l'ADN peut être effectuée avant la réparation de l'extrémité/la queue dA, après la ligature de l'adaptateur ou après l'amplification.
2. Il est recommandé d'effectuer une sélection de taille juste après la ligature de l'adaptateur si la quantité d'ADN d'entrée est supérieure à 50 ng; sinon, veuillez effectuer la sélection de taille après l'amplification.
3. L'activateur de ligature contient une forte concentration de PEG, ce qui peut avoir un impact significatif sur la précision de la sélection de la taille. Par conséquent, si la sélection de la taille doit être effectuée immédiatement après la ligature de l'adaptateur, il est fortement recommandé d'ajouter une étape de nettoyage des billes avant la sélection. Cette étape peut être réalisée directement si elle est effectuée avant la réparation terminale/l'affinage dA ou après. l'amplification de la bibliothèque.
4. Les billes magnétiques doivent être équilibrées à température ambiante avant utilisation, sinon le rendement diminuera et l'effet de sélection de taille sera affecté.
5. Les billes magnétiques doivent être bien mélangées au vortex ou par pipetage avant utilisation.
6. N'aspirez pas les billes lors du transfert du surnageant, même des traces de billes peuvent avoir un impact sur les réactions suivantes.
7. L'éthanol à 80 % doit être fraîchement préparé, sinon cela affectera l'efficacité de la récupération.
8. Pour une sélection précise de la taille, il est recommandé de commencer avec un volume supérieur à 100 μL. Si le volume est inférieur, il est recommandé d'augmenter le volume à 100 μL avec de l'eau ultra-pure.
9. Les billes magnétiques doivent être séchées à température ambiante avant l'élution du produit. Une sécheresse insuffisante peut facilement entraîner la présence d'éthanol résiduel, ce qui peut affecter les réactions ultérieures ; une sécheresse excessive peut provoquer la fissuration des billes magnétiques et réduire le rendement de la purification. En général, un séchage à température ambiante de 3 à 5 minutes suffit pour permettre aux billes de sécher complètement.
10. Si nécessaire, les échantillons d'ADN purifiés ou sélectionnés en fonction de la taille sont élués dans 0,1× Le tampon TE peut être conservé à 4°C pendant 1 à 2 semaines ou à -20°C pendant un mois.
5. Amplification de la bibliothèque
1. La nécessité d'une amplification de la bibliothèque dépend de la quantité d'ADN entrant, du type d'adaptateurs, des applications de séquençage, etc. L'amplification est obligatoire en cas d'utilisation d'adaptateurs partiels. En cas d'utilisation d'adaptateurs pleine longueur, si l'ADN entrant est inférieur à 200 ng, il est recommandé de procéder à une amplification ; sinon, l'amplification n'est pas nécessaire.
2. Le nombre de cycles d'amplification doit être strictement contrôlé. Une amplification insuffisante peut entraîner un faible rendement de la banque ; une suramplification peut entraîner une augmentation des biais, des erreurs, des lectures dupliquées et des produits chimériques. Tableau 6 répertorie les numéros de cycles recommandés ciblant le rendement de la bibliothèque de 1 μg.
Tableau 6 Nombre de cycles recommandé pour générer 1 000 ng de rendement de la bibliothèque
| Entrée d'ADN | Nombre de cycles nécessaires pour générer 1 μg de rendement de bibliothèque |
| 1000 ng | 2 - 4 |
| 500 ng | 2 - 4 |
| 250 ng | 4 - 6 |
| 100 ng | 5 - 7 |
| 50 ng | 7 - 9 |
| 10 ng | 9 - 11 |
| 5 ng | 10 - 12 |
| 1 ng | 12 - 15 |
| 100 pages | 16 - 18 |
Note:
1.Table 6 montre le nombre de paramètres de boucle en utilisant des tests d'ADN d'entrée de haute qualité d'environ 200 pb. La qualité de l'ADN FFPE varie considérablement et lorsque la qualité de l'ADN est médiocre ou que la longueur de la bibliothèque est longue, le nombre de cycles doit être augmenté de manière appropriée pour obtenir des bibliothèques suffisantes.
2.jeSi la sélection de la taille est requise pendant le processus de construction de la bibliothèque, un nombre de cycles plus élevé pour l'amplification de la bibliothèque est recommandé ; sinon, un nombre de cycles inférieur est recommandé.
3.jeSi des adaptateurs incomplets sont utilisés, au moins 2 cycles doivent être amplifiés pour former un adaptateur complet.
6. Analyse de la qualité de la bibliothèque
1. La qualité des bibliothèques construites est généralement analysée en mesurant les concentrations et les distributions de taille.
2. Les concentrations des bibliothèques peuvent être mesurées par des méthodes basées sur la fluorescence telles que Qubit et PicoGreen ou qPCR.
3. Il n'est PAS recommandé d'utiliser des méthodes de quantification basées sur l'absorbance telles que NanoDrop.
4. Il est recommandé d'utiliser la méthode qPCR pour la quantification des bibliothèques : les méthodes fluorescentes telles que Qubit et PicoGreen ne permettent pas de différencier les structures d'ADN double brin incomplètes (inserts sans adaptateur ou dont une seule extrémité est ligaturée avec un adaptateur) des bibliothèques complètes. La méthode qPCR n'amplifie et ne mesure que les bibliothèques complètes dont les deux extrémités sont ligaturées avec des adaptateurs (bibliothèques séquencables), offrant ainsi une mesure plus précise pour le chargement.
5.La distribution de taille des bibliothèques peut être analysée à l'aide d'Agilent Bioanalyzer ou d'autres appareils basés sur les principes de l'électrophorèse capillaire ou de la microfluidique.
7. Autres matériaux
1. Billes magnétiques de purification d'ADN : Hieff NGSMT Billes de sélection d'ADN (
2. Adaptateurs : Adaptateur complet pour Illumina:
3. Analyse de qualité de bibliothèque : Agilent 2100 Bioanalyzer DNA 1000 Chip/High Sensitivity Chip ou autres produits équivalents ; réactifs quantitatifs de bibliothèque.
4. Autres matériaux : éthanol absolu, eau ultra pure stérile, pointes de pipette à faible rétention, tube PCR, supports magnétiques, thermocycleur, etc.
Instructions
Étape 1. Réparation finale/dA-Taling
1. Dégel les réactifs mentionnés dans le tableau 7 Retournez pour bien mélanger les réactifs et placez-les sur de la glace pour une utilisation ultérieure.
2. Assembler les réactifs selon le tableau 7 sur la glace.
Tableau 7 Système de réaction de réparation d'extrémité/dA-Tailing
| Composants | Volume (μL) |
| ADN fragmenté | x |
| Tampon de préparation finale | 7 |
| Enzyme de préparation finale | 3 |
| ddH2O | Jusqu'à 60 |
3. Mélanger délicatement en pipetant ou en secouant, centrifuger brièvement pour faire descendre la solution.
4. Placer le tube dans un thermocycleur et régler le programme selon le tableau 8.
Tableau 8 Réparation d'extrémité/dA-Tailing programme de réaction
| Température | Temps |
| Chauffer le couvercle pour 105 °C | Sur |
| 30 °C | 30 min |
| 72 °C | 30 min |
| 4 °C | Prise |
Étape 2. Ligature de l'adaptateur
1. Diluer l'adaptateur à la concentration appropriée conformément au tableau 2-5.
2. Dégel les réactifs mentionnés dans le tableau 9 Retournez pour bien mélanger les réactifs et placez-les sur de la glace pour une utilisation ultérieure.
3. Assembler les réactifs selon le tableau 9 sur la glace.
Tableau 9 Ligature de l'adaptateur système réactionnel
| Composants | Volume (μL) |
| ADN à queue dA(Produit de l'étape 1) | 60 |
| activateur de ligature | 30* |
| Adaptateur ADN | 5** |
| Rapide ADN ligase T4 | 10 |
| ddH2O | 5 |
| Total | 110 |
Note: *L'activateur de ligature est visqueux. Bien mélanger en inversant ou en formant une vertex. centrifuger brièvement avant utilisation.
**La concentration originale de l'IlluminaMT L'adaptateur de YEASE est de 15 μM. Veuillez diluer l'adaptateur en fonction de la quantité injectée. et fixer le volume de l'adaptateur à 5 μL.
**La concentration originale du MGIMT l'adaptateur de YEASE est 10 μM. Veuillez diluer l'adaptateur en fonction de la quantité injectée. et fixer le volume de l'adaptateur à 5 μL.
4. Bien mélanger en pipetant doucement de haut en bas, puis centrifuger brièvement pour recueillir tout le liquide des parois du tube.
5. Incuber l'échantillon dans un thermocycleur préchauffé comme indiqué dans le tableau 10 et effectuez la réaction de connexion de l'adaptateur.
Tableau 10 Programme de réaction de ligature de l'adaptateur
| Température | Temps |
| Chauffer le couvercle à 105°C | Désactivé |
| 20°C | 15 minutes |
| 4°C | Prise |
Étape 3. Nettoyage ou sélection de taille après ligature de l'adaptateur
Cette étape consiste à purifier ou à sélectionner la taille du produit de l'étape 2 avec des billes magnétiques. La purification permet d'éliminer les adaptateurs résiduels, les dimères d'adaptateurs ou autres produits inutilisables.
Cléan de l'ADN ligaturé par adaptateur
1. Préparation : passer le Hieff NGSMT Sortez les billes de sélection d'ADN du réfrigérateur et laissez-les à température ambiante pendant au moins 30 minutes. Préparez de l'éthanol à 80 % fraîchement préparé.
2. Bien mélanger les billes en les retournant ou en les vertexant.
3. Ajouter 88 μL Hieff NGSMT Billes de sélection d'ADN (0,8×, Billes : ADN = 0,8:1) dans le tube contenant le produit ligaturé par adaptateur, secouez et mélangez bien, puis incubez à température ambiante pendant 5 minutes.
4. Centrifuger brièvement pour faire descendre la solution, puis placer le tube à centrifuger sur le support magnétique. Une fois les billes magnétiques complètement adsorbées (environ 5 minutes), retirer délicatement le liquide.
5. Maintenez le tube sur le support magnétique, Ajouter directement 200 μL d'éthanol à 80 % fraîchement préparé dans le tube. Incuber à température ambiante pendant 30 secondes et retirer délicatement le liquide.
6. Répéter étape 5 à nouveau.
7. Maintenez le tube sur le support magnétique, ouvrez le bouchon et séchez les billes jusqu'à ce qu'elles soient juste fissurées (pas plus de 5 minutes).
8. Retirez le tube du support magnétique pour l'élution et éluer l'ADN
1). Si le produit n'a pas besoin d'être sélectionné en fonction de la taille, ajoutez 21 μL ddH2O directement. Bien mélanger par vortex ou pipetage 10 fois. Incuber à température ambiante pendant 5 minutes. Centrifuger brièvement le tube et le placer sur un support magnétique. Lorsque la solution est limpide (environ 5 minutes), transférer 20 μL de surnageant dans un nouveau tube PCR avec précaution, sans toucher les billes magnétiques.
2). Si le produit doit être sélectionné en fonction de sa taille, ajoutez 102 μL ddH2O directement. Bien mélanger par vortex ou pipetage 10 fois. Incuber à température ambiante pendant 5 minutes. Centrifuger brièvement le tube et le placer sur un support magnétique. Lorsque la solution est limpide (environ 5 minutes), transférer 100 μL de surnageant dans un nouveau tube PCR avec précaution, sans toucher les billes magnétiques.
Note:Si le produit purifié doit être stocké, il peut être élué avec le tampon TE.
Sélection de la taille de l'ADN ligaturé par adaptateur
1. Préparation : passer le Hieff NGSMT Sortez les billes de sélection d'ADN du réfrigérateur et laissez-les à température ambiante pendant au moins 30 minutes. Préparez de l'éthanol à 80 % fraîchement préparé.
2. Bien mélanger les billes en les retournant ou en les vertexant.
3. En fonction des tailles ciblées, ajoutez la première série de billes aux 100 μL de matrices d'ADN purifiées conformément au tableau 11Mélanger soigneusement en vortexant ou en pipetant 10 fois.
Tableau 11 Rapports perles/ADN recommandés pour la sélection de la taille des perles
| Taille de la bibliothèque d'ADN insérée | 150 - 250 pb | 200-300 pb | 300-400 pb | 400-500 pb |
| Taille finale de la bibliothèque d'ADN | 250-350 pb | 350-450 pb | 450-550 pb | 550-650 pb |
| Rapport volumique dans le 1 St rond (Perles:ADN) | 0,80× | 0,70× | 0,60× | 0.55× |
| Rapport volumique dans le 2 nd rond (Perles:ADN) | 0,20× | 0,20× | 0,20× | 0,15× |
NoteLe symbole « × » dans le tableau indique le volume de l'échantillon d'ADN. Par exemple, si la longueur de l'insert de la banque est de 250 pb et le volume de l'échantillon d'ADN de 100 μL, le volume de billes magnétiques utilisé lors du premier tri est de 0,7 × 100 μL = 70 μL ; le volume de billes magnétiques utilisé lors du second tri est de 0,20 × 100 μL = 20 μL. Le volume de billes recommandé dans le tableau concerne l'ADN ligaturé par adaptateur. Si la sélection de la taille est effectuée avant la ligature, veuillez vous référer aux protocoles de fabrication de Hieff NGS.MT Billes de sélection d'ADN (Cat#12601).
4. Incuber à température ambiante pendant 5 minutes.
5. Centrifuger brièvement le tube et le placer sur un support magnétique. Lorsque la solution est limpide (environ 5 minutes), transférer le surnageant dans un nouveau tube PCR.
6. Ajoutez la deuxième série de billes de sélection à l'échantillon de l'étape 5 selon le tableau 11Mélanger soigneusement en vortexant ou en pipetant de haut en bas au moins 10 fois.
7. Incuber à température ambiante pendant 5 minutes.
8. Centrifuger brièvement pour faire descendre la solution, puis placer le tube à centrifuger sur le support magnétique. Une fois les billes magnétiques complètement adsorbées (environ 5 minutes), retirer délicatement le liquide.
9. Maintenez le tube sur le support magnétique, Ajouter directement 200 μL d'éthanol à 80 % fraîchement préparé dans le tube. Incuber à température ambiante pendant 30 secondes et retirer délicatement le liquide.
10. Répéter étape 9 encore.
11. Maintenez le tube sur le support magnétique, ouvrez le bouchon et séchez les billes jusqu'à ce qu'elles soient juste fissurées (pas plus de 5 minutes).
12. Retirez le tube du support magnétique pour l'élution, et ajouter directement 21 μL ddH2O. Bien mélanger au vortex ou à la pipette et incuber à température ambiante pendant 5 minutes. (Remarque : si le produit purifié doit être conservé, éluer dans du tampon TE.) Centrifuger brièvement le tube et le placer sur un support magnétique jusqu'à ce que le liquide devienne clair (environ 5 minutes). Transférer délicatement 20 µl de surnageant dans un nouveau tube PCR sans toucher les billes.
Étape 4 Amplification de la bibliothèque
Cette étape peut enrichir les produits purifiés ou sélectionnés en fonction de la taille par amplification PCR.
1. Décongelez les réactifs listés dans le tableau 12, retournez-les et mélangez-les soigneusement, puis placez-les sur de la glace pour une utilisation ultérieure.
2. Assemblez la réaction suivante dans un tube PCR stérilisé.
Tableau 12 réaction PCR d'ADN ligaturé par adaptateur système
| Composants | Volume (μL) |
| Adaptateur ADN ligaturé | 20 |
| CanaceMT Mixage d'amplification professionnel | 25 |
| Mélange d'apprêt* | 5 |
| Total | 50 |
[Note]: * si l'adaptateur complet a été utilisé, Hieff NGSMT Mélange d'apprêt (
3. Mélanger délicatement en pipetant ou en secouant, puis centrifuger brièvement pour obtenir la solution.
4. Placez le tube dans un thermocycleur et configurez le programme selon le tableau 13 pour démarrer l'amplification.
Tableau 13 Programme de réaction d'amplification PCR
| Température | Temps | Faire du vélo |
| Chauffer le couvercle à 105°C | Sur | - |
| 98°C | 45 seconde | 1 |
| 98°C | 15 seconde | Voir le tableau 6 |
| 60°C | 30 secondes | |
| 72°C | 30 secondes | |
| 72°C | 1 min | 1 |
| 4°C | Prise | - |
Étape 5 Nettoyage post-amplification/sélection de la taille
Le propre les étapes ascendantes font référence à étape 3. Hieff NGSMT Des billes de sélection d'ADN (0,9×, billes : ADN = 0,9:1) sont utilisées pour purifier le produit PCR. Si une sélection de taille est nécessaire, veuillez consulter étape 3.
Étape 6 Contrôle de la qualité des bibliothèques finales
La qualité de la bibliothèque construite est généralement évaluée en mesurant la concentration et la distribution granulométrique. Pour plus de détails, veuillez consulter la note 6.
Paiement et sécurité
Vos informations de paiement sont traitées en toute sécurité. Nous ne stockons pas les détails de la carte de crédit ni accès aux informations de votre carte de crédit.
Enquête
Vous pouvez aussi aimer
FAQ
Le produit est destiné à des fins de recherche uniquement et n'est pas destiné à un usage thérapeutique ou diagnostique chez l'homme ou l'animal. Les produits et le contenu sont protégés par des brevets, des marques déposées et des droits d'auteur appartenant à Yeasen Biotechnology. Les symboles de marque indiquent le pays d'origine, pas nécessairement l'enregistrement dans toutes les régions.
Certaines applications peuvent nécessiter des droits de propriété intellectuelle tiers supplémentaires.
Yeasen se consacre à la science éthique, estimant que nos recherches doivent répondre à des questions cruciales tout en garantissant la sécurité et les normes éthiques.