Tinjauan Umum tentang T4 DNA Ligase
Enzim apa yang digunakan ilmuwan untuk mengikat gen baru? Tak perlu dikatakan lagi, DNA ligase termasuk di dalamnya. Jadi mengapa DNA ligase begitu penting dalam DNA rekombinan? Karena DNA ligase bertanggung jawab untuk meligasi fragmen target ke vektor, yang merupakan salah satu elemen kunci yang menentukan keberhasilan percobaan. Sebagai salah satu jenis DNA ligase, apa peran DNA ligase T4 dalam percobaan kloning molekuler? Bagaimana cara kerjanya? DNA ligase T4 akan diperkenalkan secara menyeluruh selanjutnya.
1. Apa itu T4 DNA Ligase?
2. Apa fungsi DNA ligase T4?
3.
4. Panduan pemilihan untuk
1. Apa itu T4 DNA Ligase?
DNA ligase T4 merupakan ligase yang bergantung pada ATP yang mengkatalisis reaksi ligasi antara molekul DNA. Enzim ini terutama membentuk fosfodiester dengan menghubungkan ujung 3'-hidroksil dan 5'-fosfat. DNA ligase terlibat dalam proses replikasi dan perbaikan DNA pada semua organisme. DNA ligase T4 yang dikodekan oleh fag diproduksi selama infeksi fag T4 pada E. coli.
Ligase yang digunakan dalam rekayasa genetika terutama adalah ligase DNA E. coli dan ligase DNA T4, yang terakhir lebih banyak digunakan saat ini. Ligase DNA T4 dapat memperbaiki torehan untai tunggal pada DNA untai ganda, RNA untai ganda, atau untai hibrida DNA/RNA untuk menghubungkan dua nukleotida yang berdekatan, dan memainkan peran penting dalam perbaikan dan rekombinasi DNA.
Dalam proses konstruksi plasmid rekombinan, ligase DNA T4 dapat digunakan bersama dengan enzim restriksi untuk melengkapi eksperimen konstruksi plasmid rekombinan. Ia dapat mengkatalisis pembentukan ikatan fosfodiester antara ujung 5'-P dan ujung 3'-OH dari DNA untai ganda dan memiliki efisiensi penyambungan yang baik untuk penyambungan ujung lengket dan penyambungan ujung tumpul.
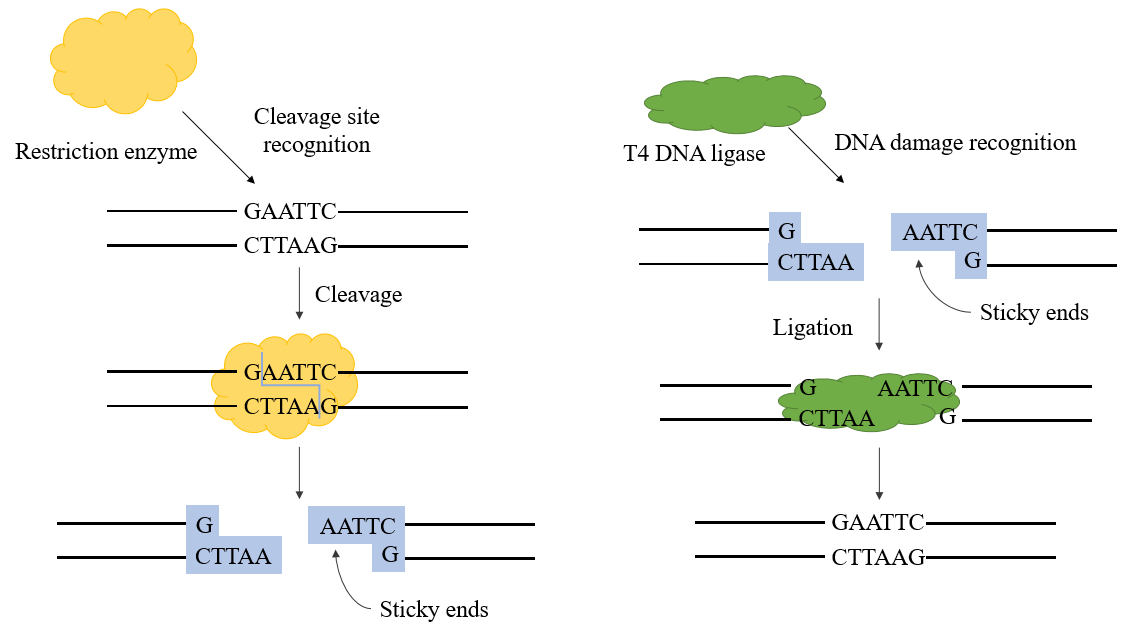
Gambar 1. Mekanisme ligase DNA T4
2. Apa fungsi DNA ligase T4?
2.1 Konstruksi Vektor
Dalam percobaan konstruksi vektor, enzim restriksi yang berbeda dapat menghasilkan jenis ujung yang berbeda. Untuk ujung yang berbeda, ligase DNA T4 akan memiliki strategi ligasi yang berbeda.
2.1.1 Kloning dengan enzim restriksi, ujung lengket dihasilkan oleh pencernaan tunggal
Selama konstruksi vektor, jika endonuklease restriksi yang sama digunakan untuk memotong fragmen DNA gen target dan molekul vektor dapat menghasilkan ujung lengket yang sama, ligase DNA T4 dapat langsung melakukan koneksi rekombinasi. Namun, karena ujung lengketnya sama, gen target dapat disisipkan ke dalam vektor dalam arah maju atau mundur, yang akan dengan mudah meningkatkan beban kerja penyaringan untuk klon rekombinan yang benar. Pertimbangkan untuk menggunakan metode pencernaan enzim ganda untuk konstruksi vektor.
Selain itu, ujung kohesif vektor yang disiapkan dengan pencernaan enzim tunggal juga dapat dipasangkan, dan kemudian ikatan fosfodiester terbentuk antara nukleotida di bawah aksi ligase DNA T4, yang menghasilkan ligasi sendiri vektor. Penggunaan alkali fosfatase untuk menangani vektor yang dicerna dapat menghilangkan gugus fosfat pada ujung 5' vektor sehingga vektor tidak dapat menyelesaikan ligasi sendiri. Dengan demikian, di bawah aksi ligase DNA T4, vektor dan fragmen target dihubungkan untuk menyelesaikan konstruksi vektor rekombinan.
2.1.2 Kloning dengan enzim restriksi, ujung lengket dihasilkan oleh pencernaan ganda
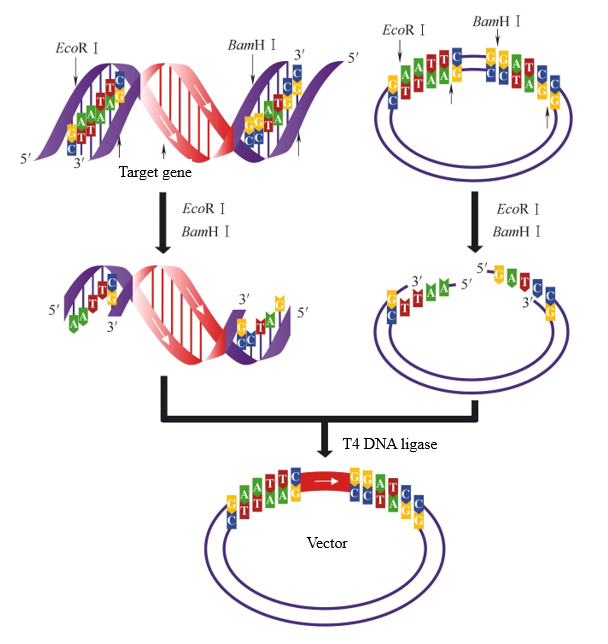
Dalam proses konstruksi vektor, jika dua enzim restriksi dengan ujung lengket yang berbeda digunakan untuk mencerna fragmen target dan vektor secara berurutan, dua ujung lengket yang berbeda dapat dihasilkan. Pada titik ini, ligase DNA T4 dapat secara selektif meligasi ujung lengket yang sama untuk memastikan bahwa fragmen target dimasukkan ke dalam vektor pada arah yang benar. Ketika fragmen target dan vektor pada Gambar 2 dicerna dengan EcoR I dan BamH I pada saat yang sama, ujung lengket yang sama dapat dihubungkan. Hanya ada satu arah ligasi antara fragmen target dan vektor.

Gambar 2. Ligasi ujung lengket yang dihasilkan oleh pencernaan enzim ganda[1]
2.1.3 Kloning fragmen restriksi, ujung tumpul
Beberapa endonuklease restriksi juga dapat menghasilkan ujung tumpul selama pembelahan enzimatik, seperti Sma I dan lainnya. Ligase DNA T4 dapat secara langsung membentuk ikatan fosfodiester antara vektor dan sisipan, dan tidak perlu berpasangan antar basa. Namun, metode ini memiliki efisiensi ligasi yang rendah dan rentan terhadap ligasi vektor sendiri. Umumnya, ujung tumpul dapat diubah menjadi ujung lengket dan kemudian diligasi. Misalnya, menambahkan basa poli A dan poli T komplementer ke ujung fragmen target dan vektor serta ujung komplementer yang lengket secara artifisial masing-masing meningkatkan efisiensi koneksi oleh deoksinukleotidil transferase terminal.
2.1.4 Kloning TA
Vektor T yang digunakan dalam kloning TA memiliki T-overhang di ujung 3'. Ketika urutan DNA dari fragmen target tidak jelas, fragmen gen target dapat dihubungkan ke vektor T melalui kloning TA, dan gen target dapat ditentukan melalui pengurutan. DNA polimerase Taq yang digunakan dalam PCR memiliki aktivitas transferase terminal dan dapat menambahkan nukleotida "A" ke ujung 3' dari fragmen DNA. DNA ligase T4 dapat secara langsung menghubungkan produk yang diperkuat oleh DNA polimerase Taq ke vektor T, dan produk yang diperkuat PCR dapat mencapai tujuan kloning yang efisien tanpa menambahkan adaptor buatan.
Gambar 3. Alur kerja kloning TA[2]
2.2 Ligasi adaptor NGS
Selama pembangunan pustaka sekuensing generasi berikutnya, perlu untuk menghubungkan adaptor buatan ke produk PCR sebelum dapat diperbaiki pada sel aliran pada chip sekuensing untuk menyelesaikan sekuensing. Bangunan pustaka penghubung ligasi kloning TA merupakan cara teknis yang sangat umum, dan prinsipnya mirip dengan kloning TA yang disebutkan di atas. Setelah fragmen DNA yang akan diurutkan difosforilasi pada ujung 5' dan "A" ditambahkan pada ujung 3', ia saling melengkapi dan dipasangkan dengan adaptor dengan ujung lengket "T". Untai ganda lengkap kemudian dibentuk dan diurutkan oleh mesin.
Selama ligasi TA, jenis sampel yang berbeda atau kompleksitas struktur fragmen asam nukleat akan memengaruhi efisiensi ligasi, sehingga adaptor platform yang berbeda juga akan berdampak pada hasil pustaka akhir.
Misalnya, adaptor Bubble pada platform MGI memiliki struktur sekunder khusus dan memerlukan efisiensi ligasi yang sangat tinggi untuk ligase DNA T4, dan pengurangan efisiensi ligasi secara langsung memengaruhi keluaran pustaka.
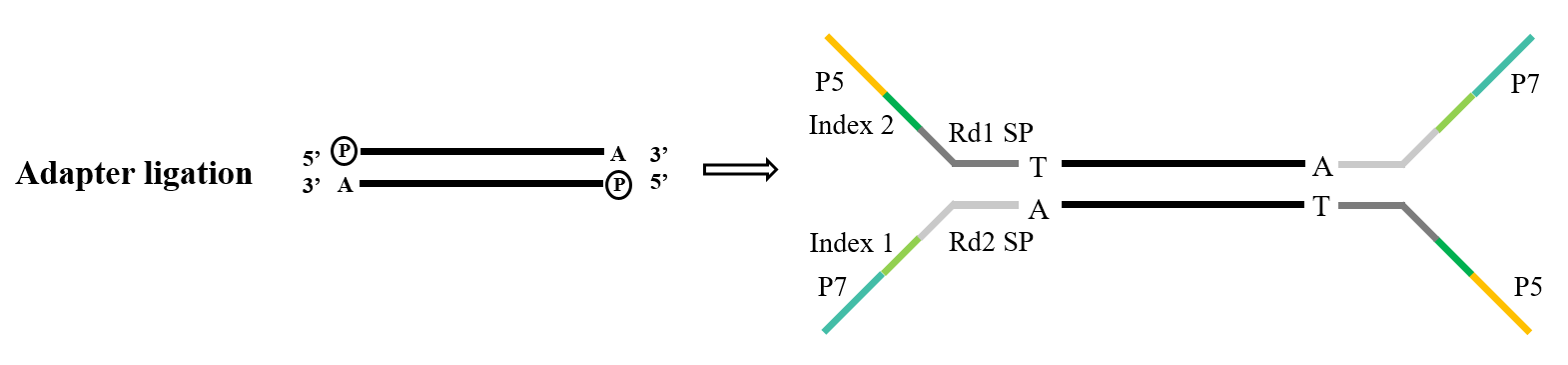
Gambar 4. Proses ligasi adaptor umum
3. Yeasen Biotech T4 DNA ligase dapat digunakan untuk ligasi adaptor NGS
3.1 Yeasen Biotech Fast T4 DNA ligase dengan efisiensi ligasi yang sangat tinggi
Menggunakan
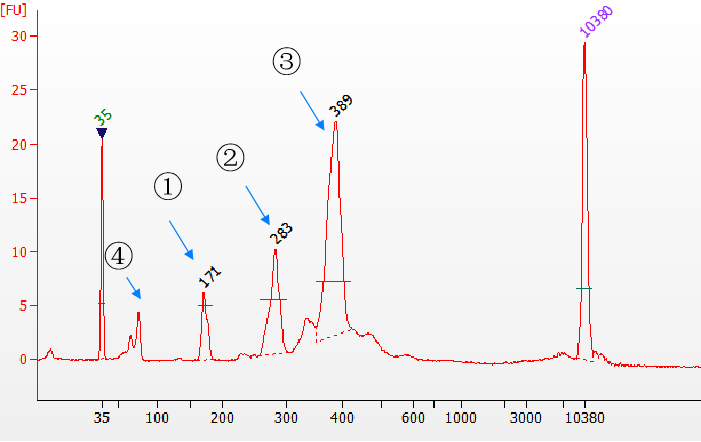
Gambar 5. Berbagai jenis produk ligasi yang dideteksi oleh Agilent 2100
3.2 Yeasen Biotech Fast T4 DNA ligase dengan hasil perpustakaan yang sangat baik
Menggunakan ligase DNA T4 Cepat untuk berbagai jenis konstruksi perpustakaan, dibandingkan dengan ligase DNA T4 lainnya, hasil perpustakaan lebih baik.
Tabel 1. Perpustakaan menghasilkan berbagai jenis sampel
| Jenis-jenis sampel | Mikrobiota usus gDNA | DNA-Cf | DNA FFPE HD200 | |||
| T4 DNA ligase (unit yang sama) | | N* | | N* | | N* |
| Masukan DNA (ng) | 10 | 10 | 50 | |||
| Nomor siklus amplifikasi | 10 | 10 | 8 | |||
| Hasil rata-rata (μg) Platform ilumina | 3.3 | 2.8 | 2.7 | 2.2 | 3 | 2.5 |
| Hasil rata-rata (μg) Platform MGI | 2.7 | 0.9 | 2.0 | 0.7 | 2.3 | 0.8 |
4. Panduan pemilihan untuk Yeasen Bioteknologi T4 DNA ligase
Tabel 2: Produk terkait
| Posisi produk | Nama Produk | Kucing# | Aplikasi |
| Universal | Hieff™ Gold T4 DNA Ligase (Menanyakan) | 10300ES | Kloning molekular. |
| Universal | 10301ES | Pembangunan perpustakaan NGS. | |
| Efisiensi ligasi tinggi dan E. coli host rendah sisa-sisa | 10299ES | Konstruksi pustaka NGS, sangat cocok untuk deteksi patogen, deteksi NIPT, dll. | |
| Sensitivitas tinggi | 10298ES | Konstruksi pustaka NGS, sangat cocok untuk konstruksi pustaka sampel cfDNA. |
Referensi
[1] W. Yuan. Rekayasa Genetika[M]. Pers Industri Kimia, 2019.
[2] Clark DP, Pazdernik NJ, Mcgehee M R. Kloning Gen untuk Biologi Sintetis - ScienceDirect[J]. Biologi Molekuler (Edisi Ketiga), 2019:199-239.
[3] Tomkinson AE, Vijayakumar S, Pascal JM, dkk. DNA Ligase: Struktur, Mekanisme Reaksi, dan Fungsi[J]. Tinjauan Kimia, 2006, 106(2):687-699.
[4] Shuman S. DNA Ligases: Kemajuan dan Prospek[J]. Jurnal Kimia Biologi, 2009, 284(26):17365-17369.
