Descrizione
Hieff NGSTM OnePot Pro DNA Library Prep Kit V3 è un kit di preparazione di librerie basato sulla frammentazione enzimatica di nuova generazione appositamente sviluppato e progettato per Illumina &Piattaforma di sequenziamento MGI. Rispetto ai metodi tradizionali di costruzione di librerie, questo prodotto impiega enzimi di frammentazione di alta qualità, eliminando il macchinoso processo ultrasonico. Semplifica l'operazione combinando i moduli di frammentazione e riparazione delle estremità in uno. Inoltre, gli enzimi e il tampone per il modulo di legatura sono premiscelati, riducendo significativamente i tempi e i costi di costruzione delle librerie. Ciò lo rende più adatto per la costruzione automatizzata delle librerie. Questo kit di preparazione delle librerie ha un'eccellente velocità di conversione delle librerie ed è applicabile a campioni provenienti da tutti gli animali, piante, microrganismi, ecc. comuni, nonché ai campioni FFPE. Sulla base della precedente generazione di kit di costruzione di librerie, questo prodotto mostra una maggiore efficienza nella frammentazione, end repair, dA-tailing e adapter ligation rispetto alle versioni precedenti. L'enzima ad alta fedeltà migliora significativamente l'uniformità e la fedeltà dell'amplificazione.
Specifiche
| N. di cat. | 12194ES08 / 12194ES24 / 12194ES96 |
| Misurare | 8 Il / 24 T / 96 T |
Componenti
| Componenti n. | Nome | 12194ES08 | 12194ES24 | 12194ES96 |
| 12194-A | SbavaturaTM Respingente 3.0 | 80 microlitri | 240 microlitri | 960 microlitri |
| 12194-B | SbavaturaTM Enzima 3.0 | 80 microlitri | 240 microlitri | 960 microlitri |
| 12194-C | Miscela pronta per legatura | 200 microlitri | 600 microlitri | 3×800 microlitri |
| 12194-D | 2× Ultima HF Mix di amplificazione | 200 microlitri | 600 microlitri | 3×800 microlitri |
[Nota]: I componenti del kit sono compatibili con entrambi Illumina &MGI piattaforma di sequenziamento, se l'adattatore completo è stato utilizzato, Hieff NGSTM Se necessario, Primer Mix (Yeasen Cat#12190 o Cat#12191).
Magazzinaggio
Questo prodotto deve essere conservato a -25~-15℃ per 1 anno.
Appunti
1. Informazioni sull'operazione
1. Si prega di operare con camici da laboratorio e guanti monouso,per la tua sicurezza.
2. Scongelare i componenti a temperatura ambiente. Dopo lo scongelamento, mescolare accuratamente con il vortex, far girare brevemente la provetta e riporla nel ghiaccio per un uso successivo.
3. Quando si prepara la soluzione di reazione di ogni passaggio, si raccomanda di usare una pipetta per mescolare bene o agitare delicatamente. Un'agitazione vigorosa può causare una diminuzione dell'output della libreria.
4. Si raccomanda vivamente di utilizzare puntali per pipette filtrati per evitare contaminazioni incrociate. Assicurarsi di cambiare i puntali per pipette quando si elaborano campioni diversi.
5. Operazioni improprie possono molto probabilmente causare contaminazioni da aerosol, influenzando l'accuratezza del risultato. Si raccomanda l'isolamento fisico obbligatorio delle regioni di miscelazione della reazione PCR e delle regioni di analisi della purificazione del prodotto PCR. Dotato di attrezzature come pipette specializzate per la costruzione di librerie. Eseguire la pulizia di routine per ogni area pulendo le superfici con ipoclorito di sodio allo 0,5% o candeggina al 10%
6. Questo prodotto è destinato esclusivamente alla ricerca.
2. Frammentazione del DNA
1. Il kit è compatibile con 100 pg - 1000 ng di DNA di input. Si consiglia vivamente di utilizzare DNA di input di alta qualità con A260/A280 = 1,8-2,0.
2. Gli esperimenti successivi potrebbero essere influenzati se alte concentrazioni di sali come l'agente chelante del metallo venissero introdotte con il DNA di input. Raccomandiamo di eluire il campione di DNA in ddH2Lo per frammentazione.
3. Fare riferimento alla tabella 6 per il tempo di frammentazione di campioni di DNA standard. Il kit ha un basso bias di frammentazione e fornisce una copertura GC uniforme per campioni di DNA con un'ampia gamma di composizioni GC. Adattare il tempo di frammentazione in base alle esigenze sperimentali.
4. Per una frammentazione accurata, preparare la reazione sul ghiaccio.
3. Legatura dell'adattatore
1. I kit Illumina o MGI Long Adapter (Barcoded Adapter) e short Adapter sono disponibili tra cui i clienti possono scegliere in base alle proprie esigenze sperimentali.
2. Si raccomanda di selezionare adattatori commerciali di alta qualità. Se si selezionano adattatori fatti in casa, si prega di affidarsi a un'azienda con esperienza nella sintesi di primer NGS e di sottolineare la necessità di un rigoroso controllo della contaminazione. Inoltre, si raccomanda di preparare la soluzione di annealing del DNA in un banco pulito e di utilizzare un solo tipo di adattatore alla volta per evitare la contaminazione incrociata.
3. Si prega di scongelare gli adattatori sul ghiaccio o a 4°C; quando si utilizza a temperatura ambiente, la temperatura del laboratorio non deve superare i 25°C per evitare che gli adattatori si denaturano.
4. La qualità e la concentrazione degli adattatori influenzeranno direttamente l'efficienza della legatura e la resa della libreria. Una concentrazione troppo elevata di adattatori favorisce la formazione di dimeri di adattatori, mentre una concentrazione troppo bassa di adattatori riduce la velocità di legatura e la resa della libreria. Diluizioni corrispondenti con TE Buffer in base alla quantità di DNA in ingresso quando si utilizza Adapter.Tabella 1-2 elenca i metodi di diluizione consigliati per gli adattatori convenzionali e UMI per diverse quantità di DNA di input utilizzando questo kit per le piattaforme di sequenziamento Illumina o MGI.
Tavolo 1 L'Illumina consigliata quantità adattatore per input diversi Il DNA
| Ingresso Il DNA | Crapporto di diluizione dell'adattatore convenzionale | Concentrazione | Rapporto di diluizione dell'adattatore UMI | Concentrazione |
| <1 ng | 7,5 volte | 2 micron | 15 volte | 1 micron |
| 1 non ~ 10 ng | 3 volte | 5 micron | 3 volte | 5 micron |
| 10 non ~ 200 non | 1,5 volte | 10 micron | 2 volte | 7,5 micron |
| >200 ng | 0 volte | 15 micron | 0 volte | 15 micron |
Tavolo 2 Il consigliato MGI quantità adattatore per input diversi Il DNA
| Ingresso Il DNA | Crapporto di diluizione dell'adattatore convenzionale | Concentrazione | Rapporto di diluizione dell'adattatore UMI | Concentrazione |
| <1 ng | 5 volte | 2 micron | 10 volte | 1 micron |
| 1 non ~ 10 ng | 2 volte | 5 micron | 2 volte | 5 micron |
| 10 non ~ 200 non | 0 volte | 10 micron | 1.25 volte | 8 micron |
| >200 ng | 0 volte | 10 micron | 0 volte | 10 micron |
4. Pulizia del DNA basata su microsfere e selezione delle dimensioni
1. La selezione delle dimensioni del DNA può essere eseguita prima della riparazione dell'estremità/dA-tailing, dopo la legatura dell'adattatore o dopo l'amplificazione.
2. Si raccomanda di eseguire la selezione delle dimensioni subito dopo la legatura dell'adattatore se la quantità di DNA in ingresso è superiore a 50 ng; in caso contrario, eseguire la selezione delle dimensioni dopo l'amplificazione.
3. Il Ligation Enhancer contiene un'elevata concentrazione di PEG, che può avere un impatto significativo sulla selezione accurata delle dimensioni. Pertanto, se la selezione delle dimensioni deve essere eseguita subito dopo la legatura dell'adattatore, si consiglia vivamente di aggiungere una fase di pulizia delle perle prima della selezione delle dimensioni. La fase di selezione delle dimensioni può essere eseguita direttamente se eseguita prima della riparazione finale/dA-tailing o dopo l'amplificazione della libreria.
4. Le sfere magnetiche devono essere portate a temperatura ambiente prima dell'uso, altrimenti la resa diminuirà e l'effetto di selezione delle dimensioni sarà compromesso.
5. Prima dell'uso, le sfere magnetiche devono essere mescolate bene tramite vortex o pipettaggio.
6. Non aspirare le microsfere durante il trasferimento del surnatante, anche tracce di microsfere potrebbero influire sulle reazioni successive.
7. L'etanolo all'80% deve essere preparato fresco, altrimenti l'efficienza del recupero ne risentirà.
8. Per una selezione accurata delle dimensioni, si consiglia di iniziare con un volume superiore a 100 μL. Se inferiore, si consiglia di portare il volume fino a 100 μL con acqua ultra-pura.
9. Le perle magnetiche devono essere asciugate a temperatura ambiente prima di eluire il prodotto. Una secchezza insufficiente causerà facilmente l'alterazione delle reazioni successive da parte dei residui di etanolo; una secchezza eccessiva causerà la rottura delle perle magnetiche e ridurrà la resa di purificazione. Normalmente, l'essiccazione a temperatura ambiente per 3-5 minuti è sufficiente per consentire alle perle di asciugarsi completamente.
10. Se necessario, i campioni di DNA purificati o selezionati in base alle dimensioni vengono eluiti in 0,1× Il tampone TE può essere conservato a 4°C per 1-2 settimane o a -20°C per un mese.
5. Amplificazione della libreria
1. L'esecuzione o meno dell'amplificazione della libreria dipende dalla quantità di DNA in ingresso, dai tipi di adattatori, dalle applicazioni dei dati di sequenziamento, ecc. La fase di amplificazione è richiesta se si utilizzano adattatori parziali. Quando si utilizzano adattatori a lunghezza intera, se il DNA in ingresso è <200 ng, si consiglia di eseguire l'amplificazione; in caso contrario, l'amplificazione non è necessaria.
2. I numeri dei cicli di amplificazione devono essere rigorosamente controllati. Un'amplificazione insufficiente può portare a una bassa resa della libreria; una sovra-amplificazione può introdurre un aumento di bias, errori, letture duplicate e prodotti chimerici. Tabella 3 elenca i numeri di cicli consigliati per ottenere una resa della libreria di 1 μg.
Tavolo 3 Il numero di cicli consigliato per generare 1.000 ng di resa della libreria
| Inserisci DNA | Numero di cicli necessari per generare 1 μg di resa della libreria |
| 1000-2000 non | 2 - 4 |
| 500 ng | 2 - 4 |
| 250 ng | 4 - 6 |
| 100 ng | 5 - 7 |
| 50 ng | 7 - 9 |
| 10 ng | 9 - 11 |
| 5 ng | 10 - 12 |
| 1 ng | 12 - 15 |
| 100 pag. | 16 - 18 |
Nota
1.Tabella 3 mostra il numero di parametri del loop utilizzando test del DNA di input di alta qualità di circa 200 bp. La qualità del DNA FFPE varia notevolmente e quando la qualità del DNA è scarsa o la lunghezza della libreria è elevata, il numero di cicli deve essere opportunamente aumentato per ottenere librerie sufficienti.
2. Se durante il processo di creazione della libreria è richiesta la selezione delle dimensioni, si consiglia un numero di cicli più elevato per l'amplificazione della libreria; in caso contrario, si consiglia un numero di cicli più basso.
3. Se si utilizzano adattatori incompleti, è necessario amplificare almeno 2 cicli per formare un adattatore completo.
6. Analisi della qualità della biblioteca
1. La qualità delle librerie costruite viene generalmente analizzata misurando le concentrazioni e le distribuzioni dimensionali.
2. Le concentrazioni delle librerie possono essere misurate mediante metodi basati sulla fluorescenza come Qubit e PicoGreen o qPCR.
3. NON è consigliato utilizzare metodi di quantificazione basati sull'assorbanza come NanoDrop.
4. Si raccomanda di utilizzare il metodo qPCR per la quantificazione delle librerie: i metodi basati sulla fluorescenza come Qubit e PicoGreen non possono differenziare le strutture dsDNA incomplete (inserti senza adattatore o con solo una delle estremità legata con adattatore) dalle librerie complete. Il metodo qPCR amplificherà e misurerà solo le librerie complete con entrambe le estremità legate con adattatori (le librerie sequenziabili), fornendo così una misurazione più accurata per il caricamento.
5. La distribuzione dimensionale delle librerie può essere analizzata utilizzando Agilent Bioanalyzer o altri dispositivi basati sui principi dell'elettroforesi capillare o della microfluidica.
7. Altri materiali
1. Perle magnetiche per la purificazione del DNA: Hieff NGSTM Perle di selezione del DNA (Yeasen Cat#12601) o AMPure® Perline XP (A63880) o altri prodotti equivalenti.
2.Adattatori: Adattatore completo per Illumina: Yeasen Cat#13519-13520; 384 Primer Dual CDI: Yeasen Cat#12412~Cat#12413; 384 Primer a doppio indice univoco (UDI): Sììì Cat#12312~Cat#12315; Adattatori UMI UDI: Yeasen Cat#13370~Cat#13371; Adattatore completo per MGI: Yeasen Cat#13360-13362. Miscela di primer del DNA:Cat#12190 O Cat#12191.
3. Analisi della qualità della libreria: Agilent 2100 Bioanalyzer DNA 1000 Chip/High Sensitivity Chip o altri prodotti equivalenti; reagenti quantitativi della libreria.
4. Altri materiali: etanolo assoluto, acqua ultrapura sterile, punte per pipette a bassa ritenzione, provetta per PCR, supporti magnetici, termociclatore, ecc.
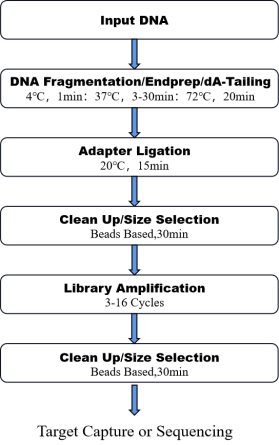
8. Flusso di lavoro
Figura 1. Il flusso di lavoro di Una pentola Professionista Il DNA Kit di preparazione alla biblioteca
Cifre
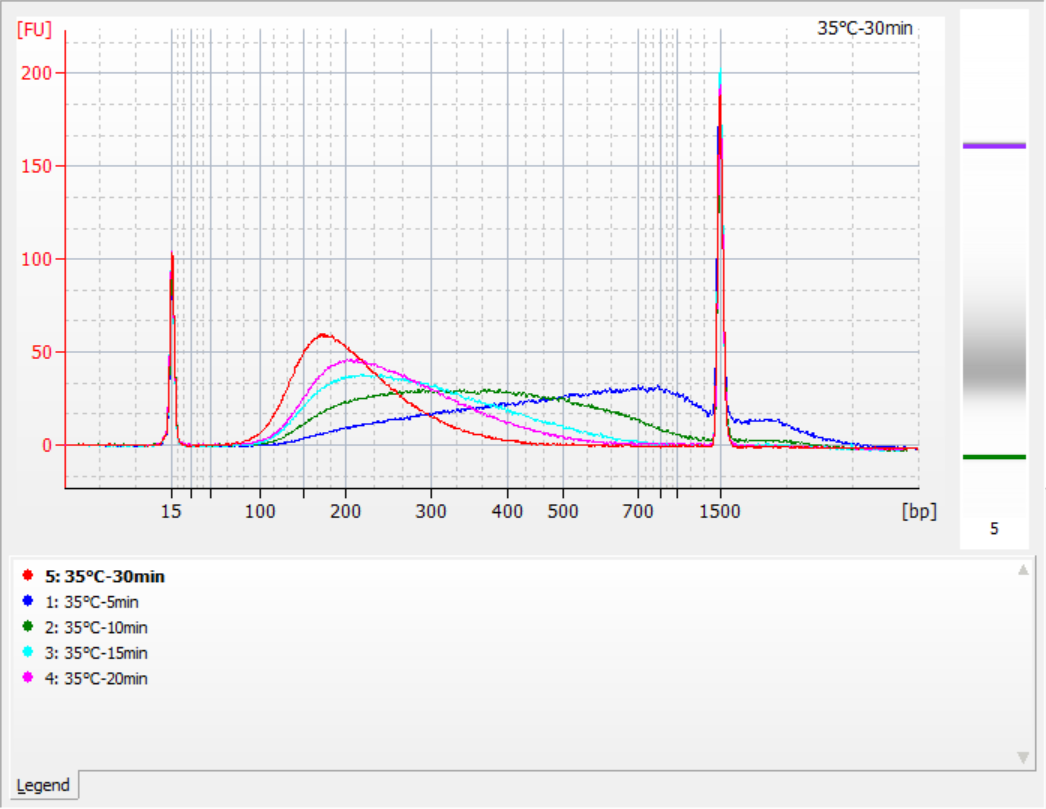
Le dimensioni dei frammenti di inserto ottenuti in diverse condizioni di frammentazione
Utilizzando 500 ng di gDNA standard come modello, le librerie sono state costruite con questo kit. Le condizioni di frammentazione erano digestione enzimatica a 32°C, 35°C e 37°C per 5, 10, 15, 20 e 30 minuti rispettivamente. I prodotti frammentati sono stati purificati con sfere magnetiche 1,2x ed eluiti con 21 μL di ddH2O. La concentrazione è stata misurata utilizzando Qubit e la distribuzione dei frammenti di inserto recuperati è mostrata nella figura seguente.
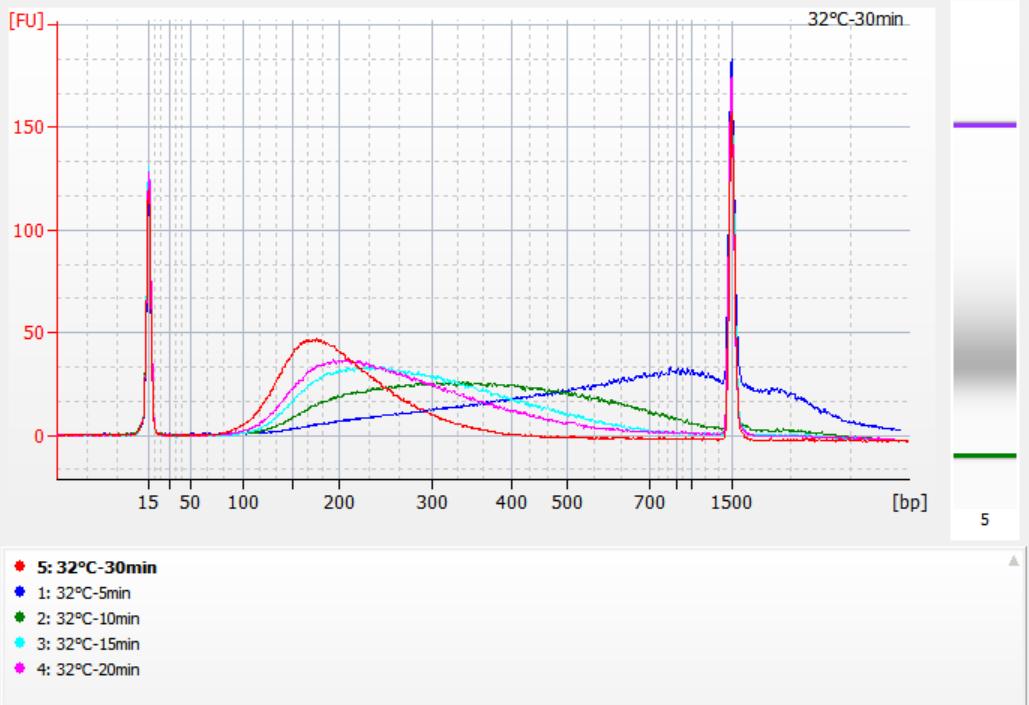 |
Figura 2. Profili di libreria a 32°C per diversi tempi di digestione enzimatica
 |
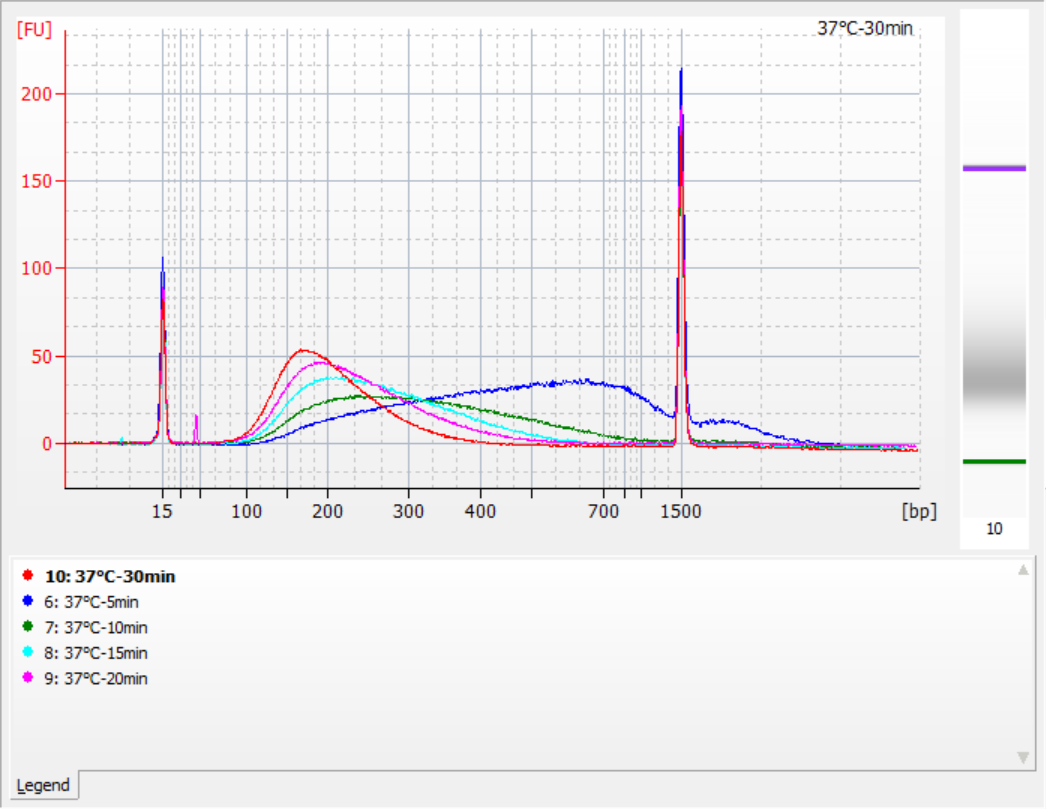 |
Pagamento e sicurezza
Le informazioni di pagamento vengono elaborate in modo sicuro. Non archiviamo i dettagli della carta di credito né abbiamo accesso alle informazioni sulla tua carta di credito.
Indagine
Potrebbe piacerti anche
FAQ
Il prodotto è solo per scopi di ricerca e non è destinato all'uso terapeutico o diagnostico su esseri umani o animali. Prodotti e contenuti sono protetti da brevetti, marchi e copyright di proprietà di Yeasen Biotechnology. I simboli dei marchi indicano il paese di origine, non necessariamente la registrazione in tutte le regioni.
Alcune applicazioni potrebbero richiedere ulteriori diritti di proprietà intellettuale di terze parti.
Yeasen è un sostenitore della scienza etica, convinto che la nostra ricerca debba affrontare questioni critiche garantendo al contempo sicurezza e standard etici.