Descrizione
Viene utilizzato il kit di rilevamento del lentivirus replicativo-competente (RCL) per rilevare quantitativamente i lentivirus in replicazione che può verificarsi in un varietà di prodotti cellulari associati ai lentivirali vettori di potenziali rischi.
Questo kit progetta primer specifici per il Sequenza del gene VSV-G delle proteine dell'involucro lentivirale. E adotta il taqman sonda fluorescente e il metodo della reazione a catena della polimerasi (PCR), che ha un limite di rilevamento del livello di 1 copie/μL e può rilevare in modo specifico e rapido il rischio di lentivirus replicativo-competente. Il kit necessita da utilizzare insieme a il kit di preparazione del campione di DNA residuo (Cat# 18461ES).
Componenti
| Componenti n. | Nome | 41311ES50 | 41311ES60 |
| 41311-A | Miscela di qPCR RCL | 0,75 ml. | 1.5 ml. |
| 41311-B | Miscela di primer e sonda RCL | 200 microlitro | 400 microlitro |
| 41311-C | Diluizione del DNA Respingente | 2×1,8 ml | 4×1,8 ml |
| 41311-D | Controllo del DNA RCL (5×10E8) copie/μL)) | 25 microlitro | 50 microlitro |
| 41311-E | CIRCUITO INTEGRATO* | 50 microlitro | 100 microlitro |
* CIRCUITO INTEGRATO: Interno controllare.
Magazzinaggio
Questo prodotto deve essere conservato a -25~-15℃ per 2 anni.
Sia il 41311-A che il 41311-B devono essere conservati al riparo dalla luce.
Applicabile strumento modelli
Includono ma non sono limitati a: Bio-Rad: Modulo ottico CFX96; Thermo Scientific: codice fiscale 7500; Studio Quant ABI 5; Passaggio ABI OnePlus.
Istruzioni
- DNA RCL Standard diluizione E Standard curva preparazione
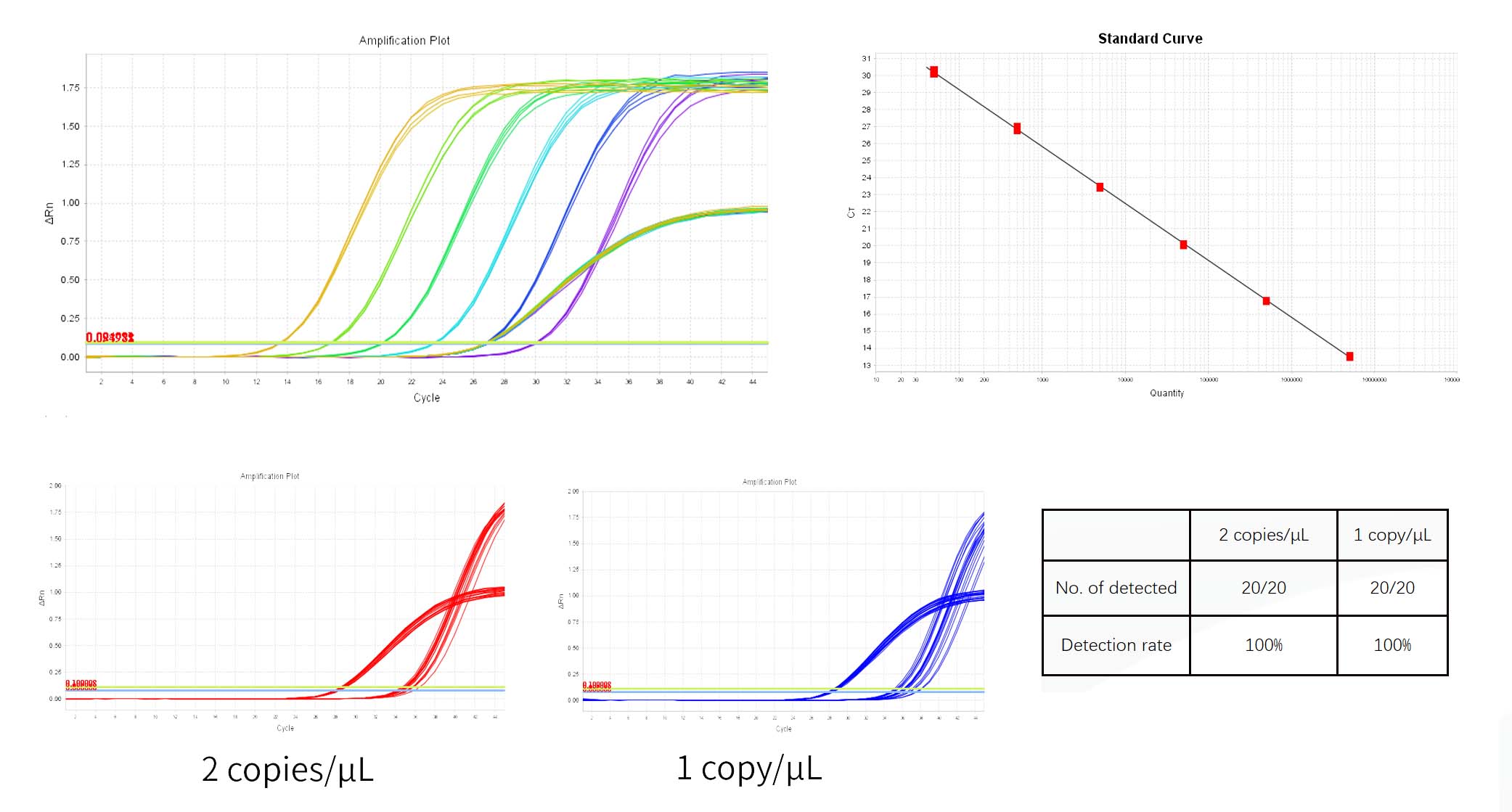
Il controllo del DNA RCL è stato diluito in gradiente utilizzando il tampone di diluizione del DNA fornito nel kit* e la diluizione la concentrazione è 5×10E7 copie/μL, 5×10E6 copie/μL, 5×10E5 copie/μL, 5×10E4 copie/μL, 5×10E3 copie/μL, 5×10E2 copie/μL, 5×10E1 copie/μL.
Vedi istruzioni dettagliate qui sotto:
1) Scongelare il controllo del DNA RCL e il tampone di diluizione del DNA nel ghiaccio. Dopo averlo completamente scongelato, vorticare delicatamente per mescolare e centrifugare a bassa velocità per 10 secondi.
2) Estrarre sette provette pulite da 1,5 ml, contrassegnate con Std0, Std1, Std2, Std3, Std4, Std5, Std6.
3) Aggiungi 90 μL di tampone di diluizione del DNA e 10 μL di controllo del DNA RCL nella provetta da microcentrifuga da 1,5 mL etichettata Std0, vale a dire diluire a 5×10E7 copie/μL. Mescolare e quindi centrifugare per 10 secondi. Sottoconfezionare lo standard di DNA diluito e può essere conservato a breve termine (non più di 3 mesi) a -25~-15℃** Si prega di evitare ripetuti cicli di congelamento e scongelamento.
4) Aggiungi 90 μL di tampone di diluizione del DNA in altre provette*** , quindi seguire la procedura seguente per le diluizioni seriali**** .
| Tubo | Rapporto di diluizione | Concentrazione standard |
| Standard1 | 10 μL Std0 + 90 μL diluizione del DNA Respingente | 5×10E6 copie/μL |
| Standard2 | 10 μL Std1 + 90 μL di diluizione del DNA Respingente | 5×10E5 copie/μL |
| Standard3 | 10 μL Std2 + 90 μL di diluizione del DNA Respingente | 5×10E4 copie/μL |
| Standard4 | 10 μL Std3 + 90 μL diluizione del DNA Respingente | 5×10E3 copie/μL |
| Standard5 | 10 μL Std4 + 90 μL di diluizione del DNA Respingente | 5×10E2 copie/μL |
| Livello 6 | 10 μL Std5 + 90 μL di DNA Diluizione Respingente | 5×10E1 copie/μL |
Tabella 1 Diluizione del gradiente standard
*Tre replicare pozzi Sono necessario per ogni concentrazione.La rilevamento allineare È 5×10E1 copie/μL~5×10E6 copie/μL E Questo allineare Potere Essere ampliato se necessario.
** A ridurre IL numero Di ripetere congelare-scongelare E Evitare contaminazione, esso È raccomandato A negozio IL Il DNA controllare In aliquote A -25~-15℃ per IL Primo tempo.
*** Una volta scongelato, Il DNA diluizione respingente Potevo Essere immagazzinato A Temperatura: da 2 a 8°C per 7 giorni, se non usato per UN lungo tempo, per favore negozio A -25~-15℃ .
**** Fare Sicuro IL modello È completamente mescolato, delicatamente scuotere IL miscela per 15 secondi A 1 minuto per ogni pendenza diluizione.
- Recupero dell'estrazione Controllare (CER) preparazione
Impostare la concentrazione del DNA RCL in ERC secondo necessità (il campione ERC è stato preparato con 5×10E4 copia il DNA RCL come un esempio), come segue:
1) Aggiungi 100 μL di campione di prova in una provetta pulita da 1,5 mL, quindi aggiungere 10 μL 5×10E3 copie/μL RCL DNA Standard (Std4) e mescolare bene, contrassegnato come ERC.
2) Eseguire l'estrazione del DNA dal campione di ERC insieme ai campioni di prova per preparare il campione di ERC purificato.
- Controllo negativo Soluzione (NCS) preparazione
Impostato il controllo negativo nell'esperimento, i passaggi operativi specifici sono i seguenti:
1) Aggiungi 100 μL di matrice campione (o tampone di diluizione del DNA) in una provetta pulita da 1,5 mL, quindi contrassegnata come NCS.
2) Eseguire l'estrazione del DNA di NCS campione insieme ai campioni di prova per preparare l'NCS purificato campione.
- Nessun modello Controllare (CNT) preparazione
Impostando il controllo "Nessun modello" nell'esperimento, i passaggi operativi specifici sono i seguenti:
1) L'NTC non richiede alcun pretrattamento del campione e può essere configurato nella fase di rilevamento qPCR del DNA residuo contenuto.
2) Il campione NTC in ogni provetta o pozzetto è 20 μL Miscela (ad esempio 15 μL di miscela RCL qPCR + 4 microlitro RCL Primer e sonda Mescolare + 1 μL CI) + 10 μL di tampone di diluizione del DNA. Si consiglia di configurare tre pozzetti replicati.
- PCR reazione sistema
| Componente | Volume (μL) |
| Miscela di qPCR RCL* | 15 |
| Miscela di primer e sonda RCL | 4 |
| CIRCUITO INTEGRATO | 1 |
| Modello di DNA | 10 |
| Totale volume** | 30 |
Tabella 2 Sistema di reazione
* Calcolare IL totale PCR reazione volume di IL numero Di reazioni: qPCR Mescolare =(il numero Di reazioni+2) × (15+4+1) μL (incluso IL perdite di due pozzetti di reazione). Si raccomandano più di tre repliche per ogni campione nell'esperimento.
** Dopo tappatura IL tubo O sigillatura IL piastra, centrifuga IL reazione tubo O piatto A Basso velocità per 10 secondi dopo sufficiente tremante E miscelazione per 5 secondi, ripetere centrifuga A raccogliere IL liquido da IL coperchio O parete A IL fondo. Evitare bolle durante operazione.
Per la configurazione consigliata della piastra, vedere la tabella seguente:
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| UN | NTC |
| STUDENTI 1 | STUDENTI 1 | STUDENTI 1 |
| Standardizzato 1 | Standardizzato 1 | Standardizzato 1 |
|
|
|
| B | NTC |
| STUDENTI 2 | STUDENTI 2 | STUDENTI 2 |
| Standardizzato 2 | Standardizzato 2 | Standardizzato 2 |
|
|
|
| C | NTC |
| STUDENTI 3 | STUDENTI 3 | STUDENTI 3 |
| Standardizzato 3 | Standardizzato 3 | Standardizzato 3 |
|
|
|
| D |
|
|
|
|
|
| Standardizzato 4 | Standardizzato 4 | Standardizzato 4 |
|
|
|
| E | NCS |
| CER 1 | CER 1 | CER 1 |
| Standardizzato 5 | Standardizzato 5 | Standardizzato 5 |
|
|
|
| F | NCS |
| ERC 2 | ERC 2 | ERC 2 |
| Standardizzato 6 | Standardizzato 6 | Standardizzato 6 |
|
|
|
| G | NCS |
| ERC 3 | ERC 3 | ERC 3 |
|
|
|
|
|
|
|
| H |
|
|
|
|
|
|
|
|
|
|
|
|
Tabella 3 Computer acceso riferimento asse
La disposizione della piastra include: 6 Std (la curva standard di 6 concentrazioni standard), 1 NTC (nessun controllo del modello), 1 NCS (soluzione di controllo negativo), 3 TS (campioni di prova), 3 ERC (controllo di recupero dell'estrazione).Tre pozzetti replicati per ogni campione.
- Linee guida per l'installazione per UN PCR Strumento
Le seguenti istruzioni si applicano solo a Termo Strumento ABI 7500 qPCR (Software versione 2.0). Se tu usi un strumenti diversi, fare riferimento alla guida dello strumento applicabile per le linee guida di configurazione.
1) Generare un nuovo esperimento, scegliere il modello di quantificazione assoluta o definito dall'utente.
2) Creare 1 sonda di rilevamento, denominata "RCL-DNA", selezionare il fluoroforo reporter come "FAM" e spegnere il fluoroforo come "nessuno"; crea un'altra sonda di rilevamento, chiamala "IC" e seleziona il fluoroforo reporter come "CY5" e tempra fluoroforo come "nessuno". La fluorescenza di riferimento è ROX" (la fluorescenza di riferimento può essere basata sulla modello dello strumento, ecc., seleziona se devi aggiungerlo).
3) Nel Pannello 'Campioni', aggiungi tutte le informazioni sui campioni a turno. Quindi seleziona i pozzetti, scegli il target e i campioni corrispondentemente. Imposta il compito dello standard RCL DNA come standard e assegnare il valori 5000000, 500000, 50000, 5000, 500, 50 (l'unità di concentrazione del DNA in ogni pozzetto è copie/μL) nella colonna Quantità e denominare il pozzi Std 1, Std 2, Std 3, Std 4, Std 5, Std 6, corrispondentemente. Impostare il compito di NTC come NTC. Imposta NCS, TS ed ERC come Sconosciuti e denominati in base alla disposizione delle tavole soprastante. Quindi fare clic su Avanti.
4) Impostare il programma di amplificazione: impostare il volume di reazione su 30 μL.
| Fase del ciclo | Temperatura (℃) | Tempo | Cicli |
| Digestione contaminata | 37℃ | 5 minimo | 1 |
| Denaturazione iniziale | 95℃ | 5 minimo | 1 |
| Denaturazione | 95℃ | 15 secondo |
45 |
| Ricottura/Estensione (raccolta di fluorescenza) | 60℃ | 30 secondi |
Tabella4 Procedura di amplificazione
- Analisi di PCR-q risultati
1) Il sistema fornirà automaticamente la soglia in Pannello del diagramma di amplificazione Analisi. La soglia data dal sistema è a volte troppo vicino alla linea di base, con conseguente grande differenza in Ct tra i pozzetti replicati. Puoi regolare manualmente la Soglia in una posizione appropriata e fare clic Analizza. Quindi puoi inizialmente controllare se la curva di amplificazione è normale nel grafico multicomponente.
2) Nel risultato Scheda Analisi, rivedere il grafico della curva standard. Verificare il valori per R2, Efficienza, Pendenza e Intercetta Y. Per una curva standard normale, R²>0,99, 90%≤Eff%≤110%, -3,6≤Pendenza≤-3,1.
3) Nel 'Visualizzazione pannello del tavolo bene Analisi, le concentrazioni di ciascun campione sono mostrate in Quantità, l'unità è copie/μL, le unità possono essere convertite nel report del test.
4) Le impostazioni dei parametri di l'analisi dei risultati deve essere basata sul modello specifico e sul software versione utilizzati e possono generalmente essere interpretati automaticamente dallo strumento.
5) Calcolare il tasso di recupero dei picchi in base ai risultati dei test di il campione TS da misurare e il picco del campione recupero ERC, il tasso di recupero di sono richiesti picchi essere compreso tra 50%~150%.Formula del misuratore del tasso di recupero a picco:
Recupero (%) = {Sample spiked assay (eg.copies/μL) - Sample assay (eg.copies/μL)} x Volume di eluizione (μL) / Teorico valore della quantità di aggiunta di DNA (ad esempio copie) x 100%。
6) Il Ct valore di il controllo negativo NCS dovrebbe essere maggiore della media di la più bassa concentrazione Ct di IL standard.
7) Modello controllo NTC gratuito dovrebbe essere indeterminato o Ct valore ≥38.
Appunti
- Questo prodotto è destinato esclusivamente alla ricerca.
- Per la vostra sicurezza, operate indossando camici da laboratorio e guanti monouso.
3. Si prega di leggere attentamente questo manuale prima di utilizzare questo reagente e l'esperimento dovrebbe essere standardizzato, incluso manipolazione del campione, preparazione del sistema di reazione e aggiunta del campione.
4. Assicurarsi che ogni componente sia completamente agitato e centrifugato a bassa velocità prima dell'uso.
Pagamento e sicurezza
Le informazioni di pagamento vengono elaborate in modo sicuro. Non archiviamo i dettagli della carta di credito né abbiamo accesso alle informazioni sulla tua carta di credito.
Indagine
Potrebbe piacerti anche
FAQ
Il prodotto è solo per scopi di ricerca e non è destinato all'uso terapeutico o diagnostico su esseri umani o animali. Prodotti e contenuti sono protetti da brevetti, marchi e copyright di proprietà di Yeasen Biotechnology. I simboli dei marchi indicano il paese di origine, non necessariamente la registrazione in tutte le regioni.
Alcune applicazioni potrebbero richiedere ulteriori diritti di proprietà intellettuale di terze parti.
Yeasen è un sostenitore della scienza etica, convinto che la nostra ricerca debba affrontare questioni critiche garantendo al contempo sicurezza e standard etici.