qPCR の結果がおかしい場合はどうすればいいですか?
qPCR 実験は簡単そうに思えるかもしれませんが、時には難しいこともあります。プライマー設計が完了したら、qPCR サンプルを PCR のように段階的に追加し、機械で実験を完了できます。染色法による qPCR 実験にはよくある問題がいくつかありますが、考えられる原因と解決策が示されていますので、qPCR 実験の問題を解決するために役立てていただければ幸いです。
1. qPCR とは何ですか?
2. 異常なqPCR増幅曲線
3. 異常なqPCR融解曲線
4. 注文情報
5. 関連製品
6. 読書について
1. qPCR とは何ですか?
ポリメラーゼ連鎖反応技術(PCR)が発明されて以来、PCRは、そのシンプルさ、安価さ、信頼性、迅速性、高感度のため、おそらく分子生物学で最も広く使用されている技術です。qPCRはPCR技術によって開発された技術です。DNA増幅プロセス中に、蛍光染料で各PCRサイクル後の生成物の総量を検出する方法は、PCRの迅速性と感度だけでなく、より特異性と高、リアルタイムモニタリング、繰り返し可能で正確な定量化などの利点もあります。qPCRは、定量的リアルタイムPCR増幅装置、つまりqPCR機器を使用して、PCRプロセス中に核酸増幅生成物をリアルタイムで監視する技術です。qPCRは、Ct値と標準曲線の分析を通じて開始テンプレートの定量分析を実現します。1992年に日本の樋口が初めて「リアルタイム蛍光定量PCR技術」を提案しました。 1996年、American Biological Companyは世界初の蛍光定量PCR装置を発売しました。この装置はPCR増幅熱サイクルシステム、蛍光検出光学系、コンピュータおよびアプリケーションソフトウェアで構成されています。蛍光染料または蛍光プローブを介して核酸増幅産物をリアルタイムで監視できます。、数学関数関係を介して、結果分析用ソフトウェアと組み合わせて、テスト対象サンプルの初期テンプレート量の計算を実現します。そのため、リアルタイム蛍光定量PCR技術が広く使用されています。qPCRの蛍光標識方法は、SYBR Green I染料法に基づく蛍光染料モザイク法、Taqmanプローブ法(Cycling Probe、Molecular Braconなど)に基づく蛍光プローブ法、クエンチャー染料プライマー法に分けられます。
qPCR 実験は簡単だと感じることもありますが、難しいと感じることもあります。プライマー設計が完了したら、PCR のように段階的に qPCR サンプルを追加し、機械で実験を完了できます。ただし、実験エラーや奇妙な実験結果を減らすために、パイプの壁に液体が垂れ下がらないようにしたり、パイプ内に気泡がないようにしたり、パイプの壁とパイプのカバーなどの直接接触を最小限に抑える必要があるなど、多くの細かい点に注意する必要があります。Xiaoyi は、染色法による qPCR 実験でよくある問題をいくつかまとめ、考えられる原因と解決策を示しました。qPCR 実験のトラブルの解決に役立てていただければ幸いです。
2. 異常なqPCR増幅曲線
2.1 増幅曲線の対数プロットのベースライン位相の異常
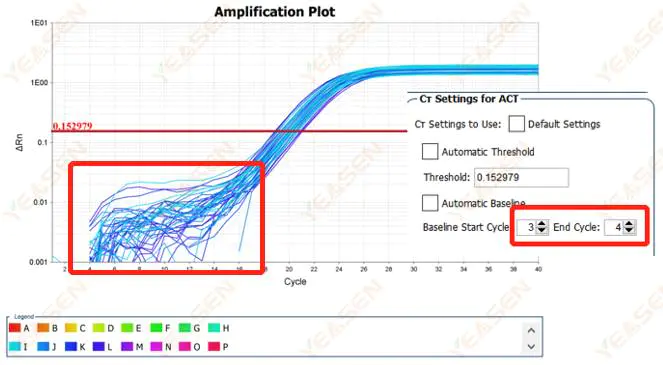
図1.増幅プロット
考えられる原因:
ベースライン設定が不適切です。
解決策:
ベースラインのエンドポイント値を増やすことを推奨します。調整例の図は以下のとおりです。

図2.増幅プロット
2.2 増幅曲線の対数プロット曲線の分割
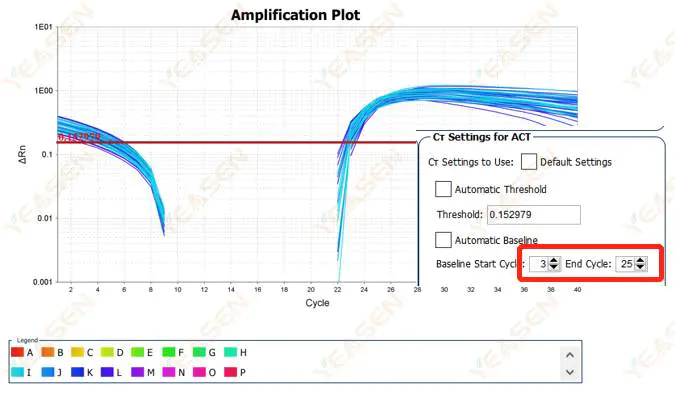
図3.増幅プロット
考えられる原因:
ベースラインが高すぎる設定になっています。
解決策:
ベースラインのエンドポイント値を下げることをお勧めします。調整例の図は次のとおりです。
2.3 不均一な増幅曲線の直線性プロット
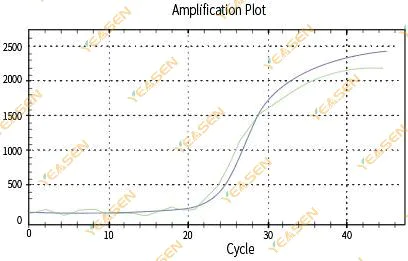
図4.増幅プロット
考えられる原因:
1)PCR反応チューブの蓋がしっかり閉まらず、反応液が漏れてしまった。
2)PCR反応液と吊り壁。
3)機器が校正されていない(自動校正やROX校正を含む)。
4) システムには多くの阻害剤が存在するため、蛍光が不安定になります。
5)機器を過度に使用すると蛍光収集が不安定になります。
解決策:
1)パイプカバーをしっかりと押します。
2)試薬をよく混ぜ、十分に遠心分離した後、慎重に定量装置に投入します。
3)機器を校正します。
4)RNAの純度を高め、適切な逆転写試薬を選択します。
2.4 増幅曲線線形グラフプラトーでのジグザグ
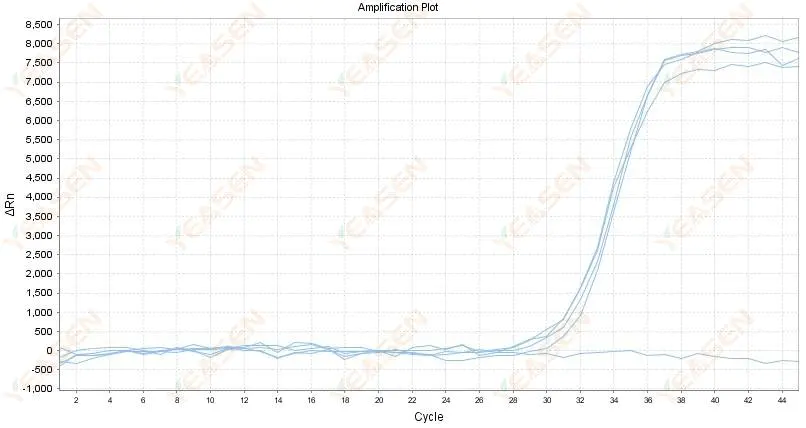
図5.増幅プロット
考えられる原因:
1) RNAの純度が低く、不純物が多い。
2) 機器の使用期間が長すぎる。
解決策:
1) 高品質のRNAを再抽出します。
2) RNA テンプレートを希釈して不純物の濃度を下げます。
3) 機器を校正します。
2.5 増幅曲線の直線プロットがプラトーに到達しない
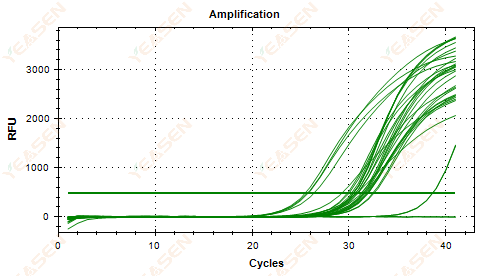
図6.増幅プロット
考えられる原因:
1) テンプレート濃度が低い(Ct値が約35)。
2) 増幅サイクルが少なすぎる。
3) 試薬増幅の効率が低い(Ct は小さいが、プラトーに達することもできない)。
解決策:
1) テンプレートの濃度を高めます。
2) サイクル数を増やします。
3) Mg 2+濃度の増加。
2.6 増幅曲線の線形プロットのプラトーのたるみ
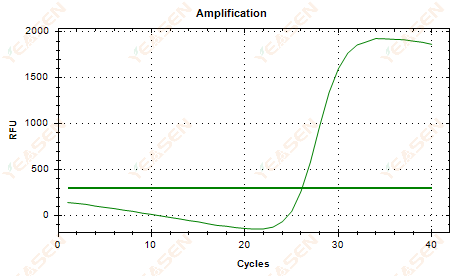
図7.増幅プロット
考えられる原因:
1) 劣化(増幅産物の劣化、SYBRの劣化)の有無。
2) チューブのキャップがきちんと閉まらず、試薬が揮発している。
3) cDNA濃度が高すぎる(Ct値が小さすぎると、蛍光閾値が高く引き上げられ、たるみがより深刻になります)。
4) チューブ内に気泡が入りますが、消えます。
解決策:
1) システムの純度を向上させる。
2) cDNAの量を減らす(テンプレートを希釈する)。
3) ベースラインのエンドポイント値を減らします。
2.7 増幅曲線におけるCt値が大きい
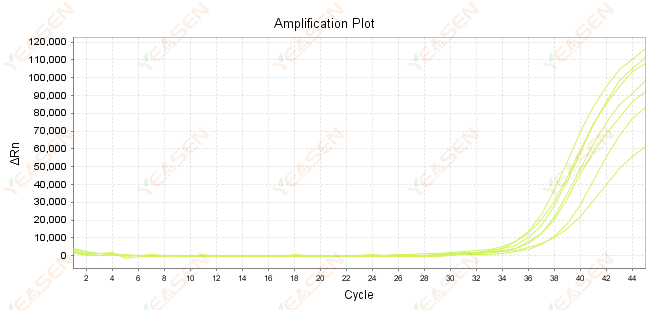
図8.増幅プロット
考えられる原因:
1) テンプレートの数が少ない。
2) 増幅効率が低い。
3) PCRフラグメントが長すぎます。
4) 反応系内に阻害剤が存在する。
解決策:
1) Ct値が可能な限り15〜30の範囲になるように、希釈回数を減らすか、テンプレートの量を増やします。
2) 反応条件を最適化し、3 段階の増幅手順を試すか、プライマーを再設計します。
3) PCR 産物の長さは 100 - 150 bp 以内に設計されており、300 bp を超えることは推奨されません。
4) 高純度テンプレートの再現。
2.8 増幅曲線の再現性が低い
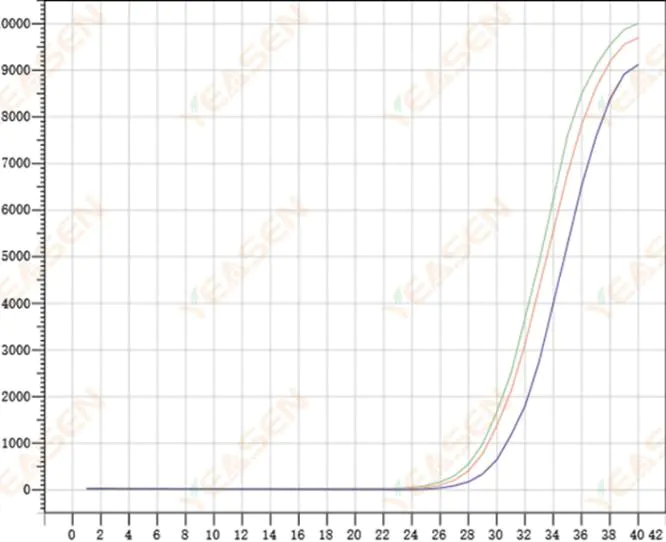
図9.増幅プロット
考えられる原因:
1) 大きなスパイクエラー。
2) 試薬とシステムが十分に混合されていません。
3) cDNAのコピー数が少ない。
4) Rox キャリブレーションは使用されませんでした。
解決策:
1) ピペットの校正。
2) 反応系の徹底した混合。
3) テンプレート濃度が低い、再現性が悪い、複合穴が 4 ~ 6 個ある、および値の大きい 1 ~ 2 の偏差は適切に破棄できます。
4) Rox キャリブレーションを使用するのが最適です。使用する試薬に Rox が含まれていない場合は、参照染料を [なし] として選択する必要があります。
2.9 無作為増幅曲線
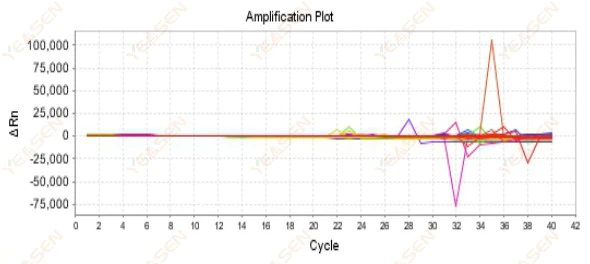
図10.増幅プロット
考えられる原因:
Rox濃度とモデルの不一致。
解決策:
機器の参照色素設定を ROX から NONE に変更し、増幅曲線が正常に戻るかどうかを確認します。
2.10 NTCピーキング
2.10.1 Ct>35、融解曲線Tm値<80℃
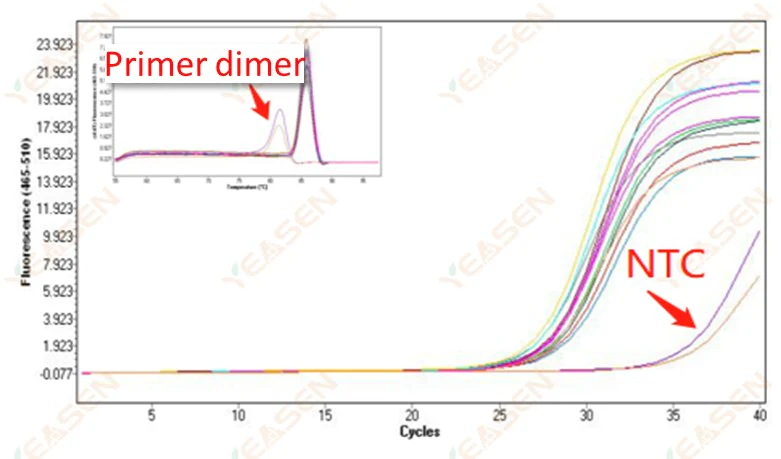
図11.増幅プロット
考えられる原因:
プライマー二量化の結果。
解決策:
最適化されたプライマー。
2.10.2 Ct値<35、NTC融解曲線と遺伝子融解曲線のピーク形状が重なる
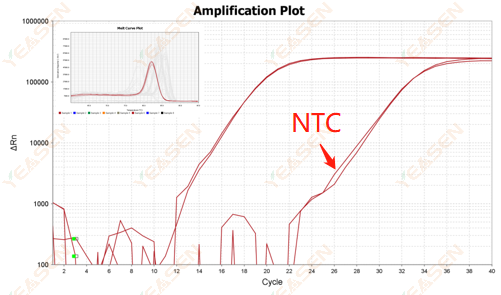
図12.増幅プロット
考えられる原因:
反応システムの汚染。
解決策:
汚染源を一つずつチェックしてください。
3. 異常なqPCR融解曲線
3.1 単一ピーク融解曲線だが鋭くない
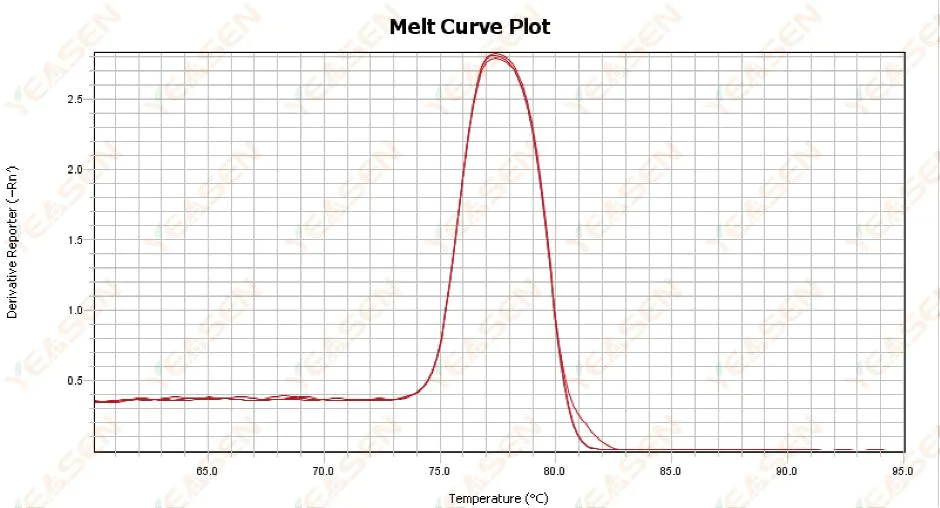
図13. 融解曲線プロット
考えられる原因:
1) 試薬の組成と機器のモデルに関係します。
2) 同様のサイズの断片の非特異的増幅の存在。
解決策:
1) ピークの開始からピークの終了までの温度範囲は 7°C 以下です。結果は使用可能、つまり単一ピークであると見なされます。
2) 測定を補助するために高濃度アガロース電気泳動(例:3%アガロース)を実施した。
3.2 融解曲線は二重ピークを持ち、下側のピークTmは80°Cより前である。
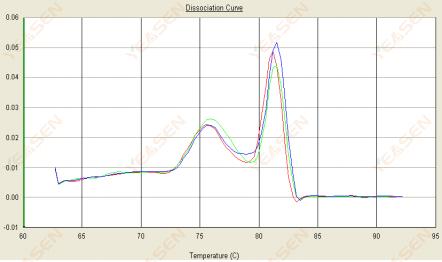
図14. 解離曲線
考えられる原因:
プライマーダイマーの存在。
解決策:
アニーリング温度を上げるか、プライマー濃度を下げるか、プライマーを再設計してください。
3.3 融解曲線は二重ピークを示し、下側のピークTmは80℃以降である。
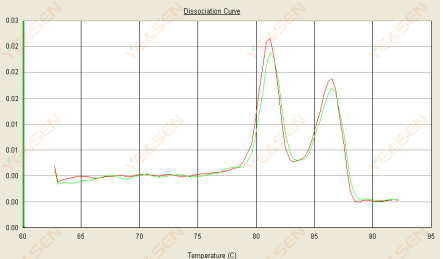
図15. 解離曲線
考えられる原因:
1) プライマーの特異性が低いと、非特異的な産物が増幅されます。
2) gDNAの汚染。
解決策:
1) Blast プライマーの特異性をチェックし、不十分な場合は再設計します。
2) NRCネガティブコントロールによる確認(ある場合)では、テンプレートを再準備する必要があります。
3.4 融解曲線のピークが乱雑になる
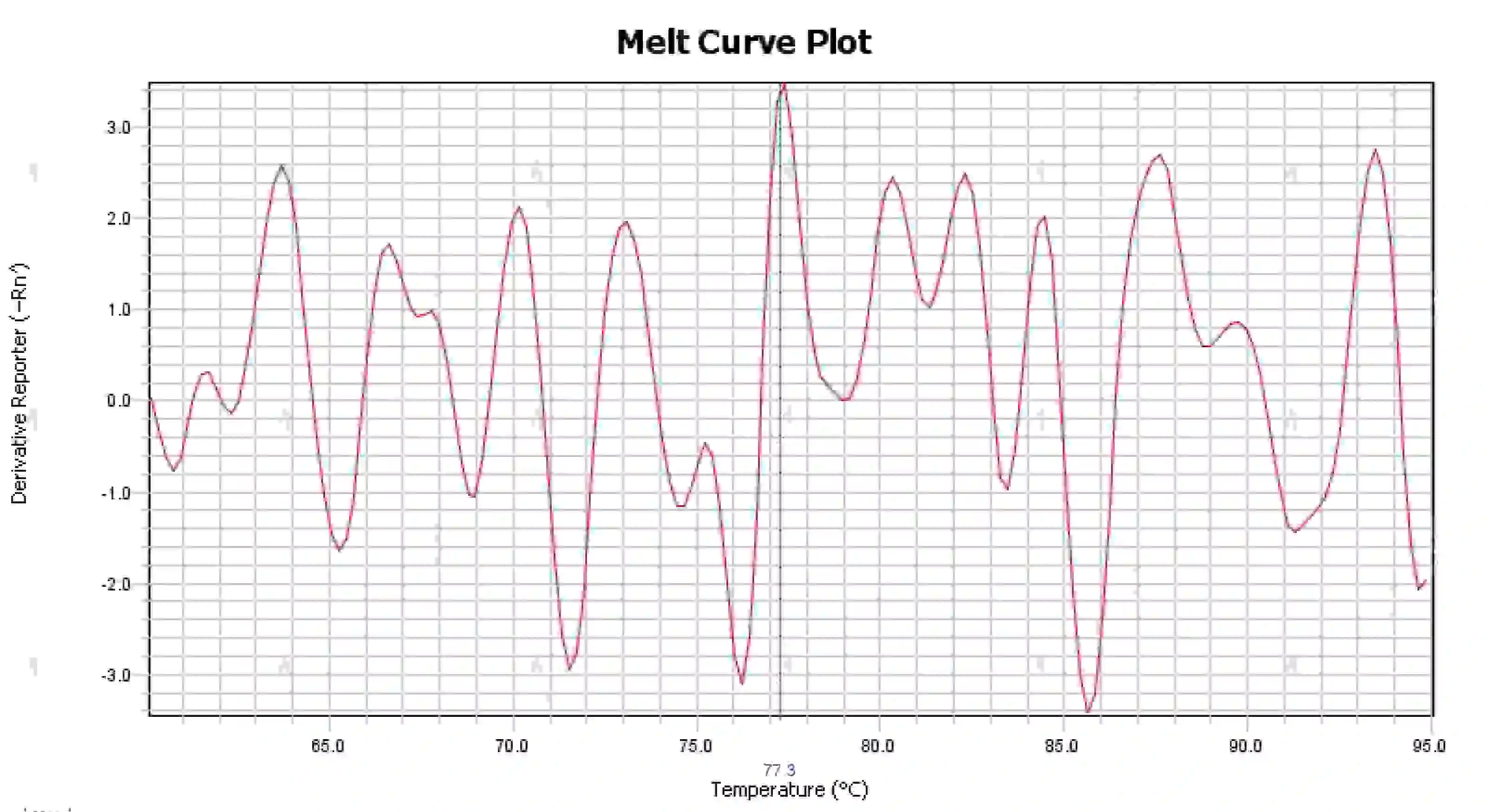
図16. 融解曲線プロット
考えられる原因:
1) 反応系の汚染。
2) 試薬を強い光や高温にさらすと、試薬が故障します。
3) 機器が長期間校正されていない。
4) 消耗品と器具の不一致。
解決策:
1) NTC と NRC の結果を組み合わせて汚染を確認する場合は、水、プライマー、酵素、環境からの汚染を 1 つずつ排除することをお勧めします。
2) 新しい試薬で比較実験を行うことをお勧めします。
3) 定期的な計測器校正メンテナンスをお勧めします。
4) 対応する機器の消耗品の要件を確認します。
3.5 融解曲線の前端における偽ピーク
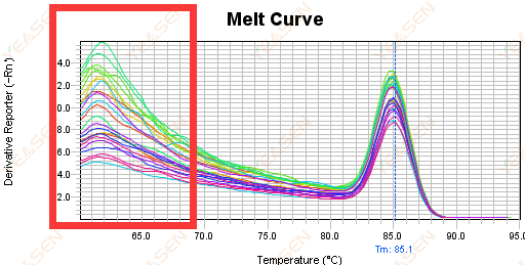
図17. 融解曲線プロット
考えられる原因:
Rox濃度がモデルと一致しません。
解決策:
融解曲線が正常かどうかを確認するには、Rox 補正をキャンセルすることをお勧めします。
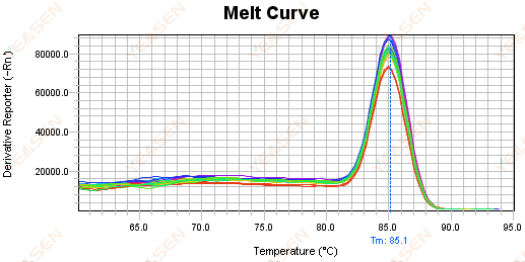
図18. 融解曲線プロット
4. 注文情報
表1. 注文情報
| 製品名 | 製品コード | 仕様 |
| Hieff Unicon™ ユニバーサル ブルー qPCR マスター ミックス (染料ベース) | 11184ES03 | 1mL |
| 11184ES08 | 5×1mL | |
| 11184ES50 | 50×1mL | |
| 11184ES60 | 100×1mL |
5. 関連製品
表2. 関連製品
| 製品の位置付け | 製品名 | 製品コード |
| ワンステップのgDNA除去と逆転写 | Hifair™V ワンステップ RT-gDNA 消化スーパーミックス qPCR 用 (お問い合わせ) | 11142ES |
| 高感度マスターミックス(gDNA除去ステップ付き) | Hifair™ III 1st Strand cDNA 合成スーパーミックス (qPCR 用) (gDNA ダイジェスター プラス) | 11141ES |
| 高感度キット(gDNA除去ステップ付き) | Hifair™ III 1st Strand cDNA合成キット(gDNAダイジェスタープラス)(お問い合わせ) | 11139ES |
| 通常の定量マスターミックス(プローブ法) | Hieff™ qPCR TaqMan プローブ マスター ミックス (お問い合わせ) | 11205ES |
6. 読書について
逆転写酵素選択のガイドライン
