qPCR 결과가 이상할 때 어떻게 해야 하나요?
qPCR 실험은 쉽고 때로는 어려울 수 있습니다. 프라이머 설계가 완료된 후, qPCR 샘플은 PCR처럼 단계별로 추가되고, 실험은 기계에서 완료될 수 있습니다. 염색법에 의한 qPCR 실험에는 몇 가지 일반적인 문제가 있으며, 가능한 원인과 해결책을 제공했으므로, 여러분이 qPCR 실험의 문제를 해결하는 데 사용할 수 있기를 바랍니다.
1. qPCR이란 무엇인가요?
2. 비정상적인 qPCR 증폭 곡선
3. 비정상적인 qPCR 녹는 곡선
4. 주문 정보
5. 관련 상품
6. 독서에 관하여
1. qPCR이란 무엇인가요?
중합효소 연쇄 반응 기술(PCR)이 발명된 이래로, PCR은 단순성, 저렴함, 신뢰성, 신속성 및 높은 감도 덕분에 분자 생물학에서 가장 널리 사용되는 기술일 것입니다. qPCR은 PCR 기술에 의해 개발된 기술입니다. DNA 증폭 과정에서 형광 염료로 각 PCR 사이클 후 총 생성물의 양을 검출하는 방법은 PCR의 신속성과 감도를 가질 뿐만 아니라 더 많은 특이성과 높은 실시간 모니터링, 반복 가능하고 정확한 정량화 및 기타 장점이 있습니다. qPCR은 정량적 실시간 PCR 증폭 장치, 즉 qPCR 기기를 사용하여 PCR 과정 중에 핵산 증폭 생성물을 실시간으로 모니터링하는 기술입니다. qPCR은 Ct 값과 표준 곡선의 분석을 통해 시작 템플릿의 정량적 분석을 실현합니다. 1992년 일본의 히구치는 처음으로 "실시간 형광 정량적 PCR 기술"을 제안했습니다. 1996년 American Biological Company에서 세계 최초의 형광 정량 PCR 기기를 출시했습니다. 이 기기는 PCR 증폭 열 사이클 시스템, 형광 검출 광학 시스템, 컴퓨터 및 응용 소프트웨어로 구성되어 있습니다. 형광 염료 또는 형광 프로브를 통해 핵산 증폭 산물을 실시간으로 모니터링할 수 있습니다. 수학적 함수 관계를 통해 결과 분석 소프트웨어와 결합하여 검사할 샘플의 초기 템플릿 양을 계산합니다. 따라서 실시간 형광 정량 PCR 기술이 널리 사용되었습니다. qPCR의 형광 표지 방법은 SYBR Green I 염료 방법을 기반으로 하는 형광 염료 모자이크 방법, Taqman 프로브 방법(Cycling Probe, Molecular Bracon 등)을 기반으로 하는 형광 프로브 방법, 퀀처 염료 프라이머 방법으로 나뉩니다.
qPCR 실험은 쉽고 때로는 어려울 수 있습니다. 프라이머 설계가 완료된 후, qPCR 샘플은 PCR처럼 단계별로 추가되고, 실험은 기계에서 완료될 수 있습니다. 그러나 파이프 벽에 액체가 걸려 있지 않고, 파이프에 거품이 없고, 실험 오류나 이상한 실험 결과를 줄이기 위해 파이프 벽과 파이프 커버 등의 직접 접촉을 최소화해야 하는 등 많은 작은 세부 사항에 주의가 필요합니다. Xiaoyi는 염색법을 통한 qPCR 실험에서 흔히 발생하는 여러 가지 문제를 정리하고 가능한 원인과 해결책을 제시했습니다. 이를 사용하여 qPCR 실험의 문제를 해결할 수 있기를 바랍니다.
2. 비정상적인 qPCR 증폭 곡선
2.1 증폭곡선의 대수적 플롯의 기준선 위상의 이상
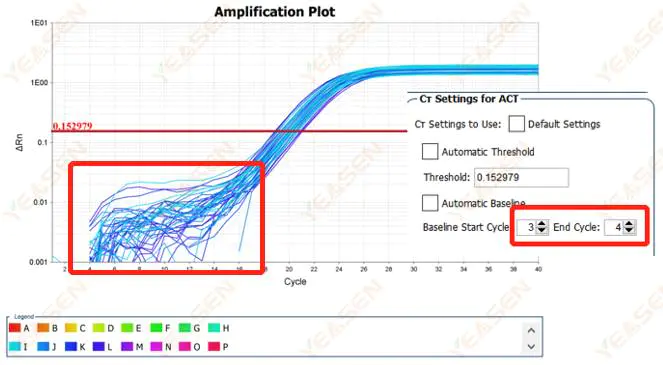
그림 1. 증폭 플롯
가능한 원인:
잘못된 기준 설정.
해결책:
기준선의 종점값을 늘리는 것이 좋습니다. 조정 예시 다이어그램은 다음과 같습니다.

그림 2. 증폭 플롯
2.2 증폭 곡선 로그 플롯 곡선 분할
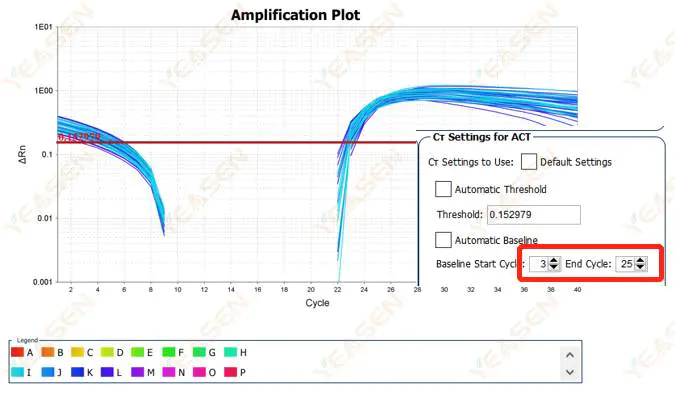
그림 3. 증폭 플롯
가능한 원인:
기준선이 너무 높게 설정되어 있습니다.
해결책:
기준선의 종말점 값을 줄이는 것이 좋습니다. 조정 예시 다이어그램은 다음과 같습니다.
2.3 비매끄러운 증폭 곡선 선형성 플롯
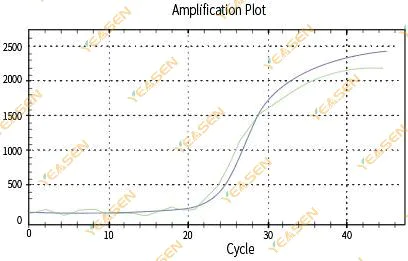
그림 4. 증폭 플롯
가능한 원인:
1) PCR 반응 튜브의 뚜껑이 제대로 닫히지 않아 반응 용액이 새어 나왔습니다.
2) 걸이벽이 있는 PCR 반응 용액.
3) 장비가 교정되지 않았습니다(자동 교정이나 ROX 교정 포함).
4) 이 시스템에는 많은 억제제가 있어 형광이 불안정해집니다.
5) 기기를 과도하게 사용하면 형광 수집이 불안정해질 수 있습니다.
해결책:
1) 파이프 덮개를 단단히 누르세요.
2)시약을 완전히 섞어준 후, 완전 원심분리 후 정량장비에 조심스럽게 넣어줍니다.
3) 계측기를 교정합니다.
4) RNA 순도를 높이고 적절한 역전사 시약을 선택합니다.
2.4 증폭곡선 선형 그래프는 고원에서 지그재그로 움직인다
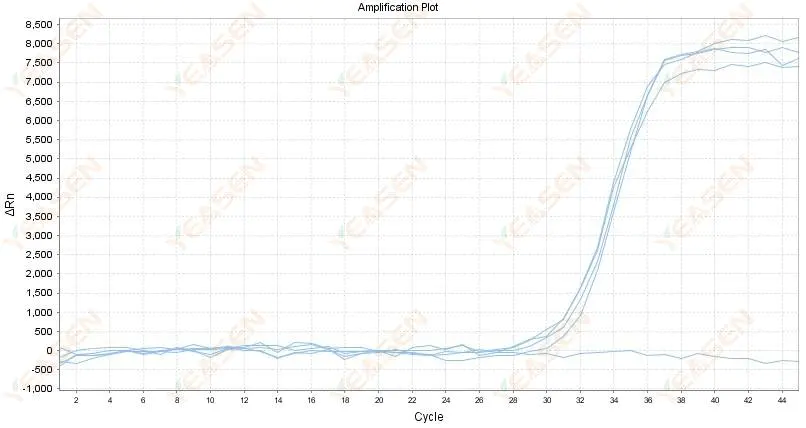
그림 5. 증폭 플롯
가능한 원인:
1) RNA의 순도가 낮고 불순물이 많습니다.
2) 악기를 너무 오랫동안 사용했습니다.
해결책:
1) 고품질 RNA를 다시 추출합니다.
2) 불순물 농도를 줄이기 위해 RNA 템플릿을 희석합니다.
3) 계측기를 교정합니다.
2.5 증폭 곡선의 선형 플롯이 평탄도에 도달하지 못함
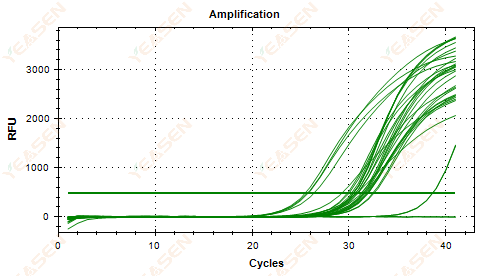
그림 6. 증폭 플롯
가능한 원인:
1) 낮은 템플릿 농도(Ct 값이 35 정도)
2) 증폭 주기가 너무 적습니다.
3) 시약 증폭의 효율성이 낮음(Ct는 작지만 평탄화에 도달할 수 없음).
해결책:
1) 템플릿의 농도를 높입니다.
2) 사이클 횟수를 늘리세요.
3) Mg 2+ 농도 증가.
2.6 증폭곡선 선형 플롯 플래토 처짐
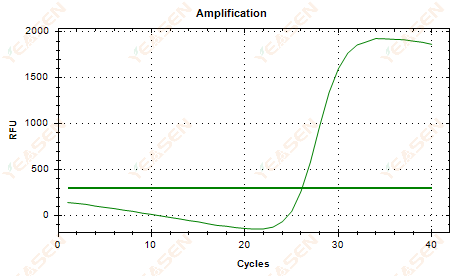
그림 7. 증폭 플롯
가능한 원인:
1) 저하의 존재(증폭산물 저하, SYBR 저하).
2) 튜브 뚜껑이 제대로 닫히지 않아 시약이 휘발되었습니다.
3) cDNA 농도가 너무 높습니다(Ct 값이 너무 작으면 형광 임계값이 높아지고 처짐이 더 심해집니다).
4) 튜브 안에 공기 방울이 생겼다가 사라집니다.
해결책:
1) 시스템 순수성을 향상시킵니다.
2) cDNA 양을 줄입니다(템플릿을 희석합니다).
3) 기준선의 종료점 값을 감소시킵니다.
2.7 증폭곡선의 Ct 값이 크다
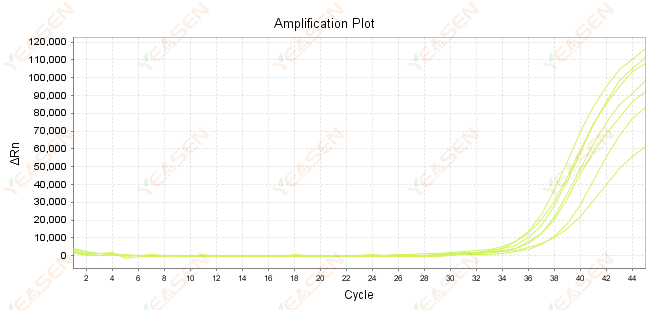
그림 8. 증폭 플롯
가능한 원인:
1) 템플릿의 양이 적습니다.
2) 증폭 효율이 낮습니다.
3) PCR 단편이 너무 깁니다.
4) 반응계 내에 억제제의 존재.
해결책:
1) 희석 시간을 줄이거나 템플릿의 양을 늘려서 Ct 값이 15~30 사이에 최대한 들어오도록 합니다.
2) 반응 조건을 최적화하고 3단계 증폭 과정을 시도하거나 프라이머를 재설계하세요.
3) PCR 생성물의 길이는 100-150bp 이내로 설계되며, 300bp를 초과하지 않는 것이 좋습니다.
4) 더 높은 순도의 템플릿의 재생산.
2.8 증폭 곡선의 반복성이 낮음
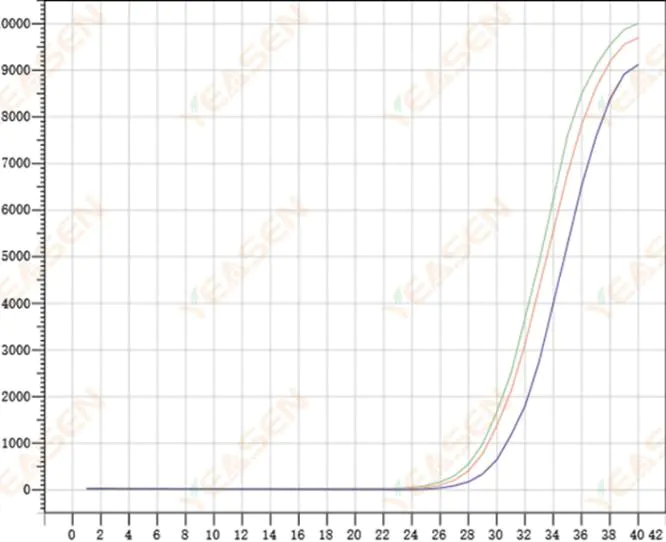
그림 9. 증폭 플롯
가능한 원인:
1) 큰 스파이크 오류.
2) 시약과 시스템이 잘 혼합되지 않았습니다.
3) cDNA의 사본 수가 적습니다.
4) Rox 보정을 사용하지 않았습니다.
해결책:
1) 피펫 교정.
2) 반응계의 완전한 혼합.
3) 템플릿 농도가 낮고, 반복성이 낮고, 화합물 구멍이 4~6개, 더 큰 값의 편차가 1~2개 있는 경우 적절히 삭제할 수 있습니다.
4) Rox 교정을 사용하는 것이 가장 좋습니다. 사용된 시약에 Rox가 포함되지 않은 경우 참조 염료를 없음으로 선택해야 합니다.
2.9 무질서한 증폭 곡선
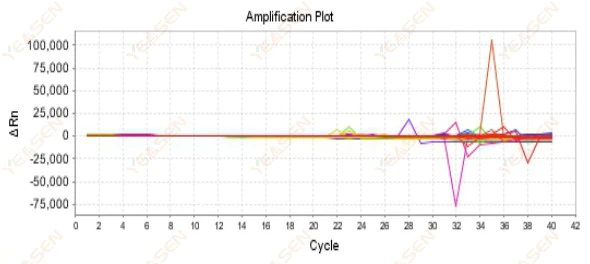
그림 10. 증폭 플롯
가능한 원인:
Rox 농도와 모델이 일치하지 않습니다.
해결책:
기기의 기준 염료 설정을 ROX에서 NONE으로 변경하고 증폭 곡선이 정상으로 돌아오는지 확인하세요.
2.10 NTC 피킹
2.10.1 Ct>35, 용융곡선 Tm값 <80℃
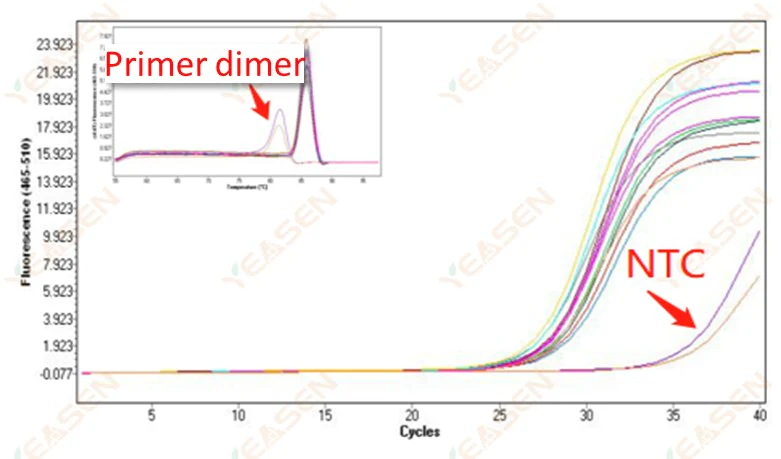
그림 11. 증폭 플롯
가능한 원인:
프라이머 이량체화 결과.
해결책:
최적화된 프라이머.
2.10.2 Ct 값 <35, NTC 용융 곡선과 유전자 용융 곡선 피크 모양이 겹침
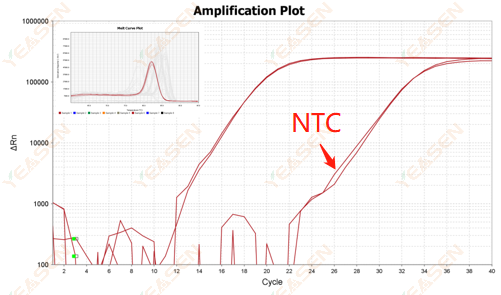
그림 12. 증폭 플롯
가능한 원인:
반응계의 오염.
해결책:
오염원을 하나하나 확인해 보세요.
3. 비정상적인 qPCR 녹는 곡선
3.1 단일 피크 용융 곡선이지만 선명하지 않음
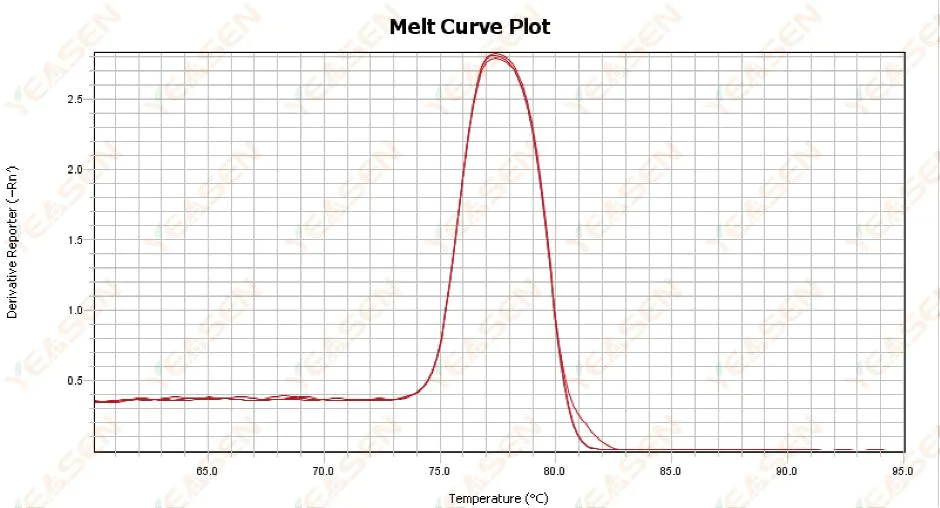
그림 13. 용융 곡선 플롯
가능한 원인:
1) 시약 구성 및 장비 모델과 관련이 있습니다.
2) 비슷한 크기의 단편의 비특이적 증폭의 존재.
해결책:
1) 피크 시작에서 피크 오프까지의 온도 범위는 7°C보다 높지 않습니다. 결과는 사용 가능한 것으로 간주됩니다. 즉, 단일 피크입니다.
2) 고농도 아가로스 전기영동(예: 3% 아가로스)이 결정을 돕기 위해 수행되었습니다.
3.2 용융곡선은 이중 피크를 가지며, 하부 피크 Tm은 80°C 이전이다.
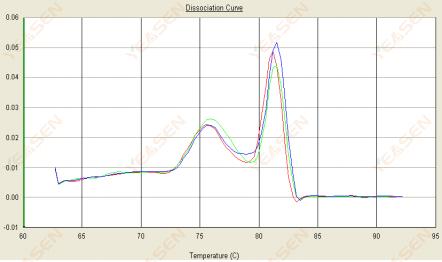
그림 14. 해리 곡선
가능한 원인:
프라이머 다이머의 존재.
해결책:
어닐링 온도를 높이거나, 프라이머 농도를 낮추거나, 프라이머를 재설계하세요.
3.3 용융 곡선은 이중 피크를 가지며, 더 낮은 피크 Tm은 80°C 이후에 나타납니다.
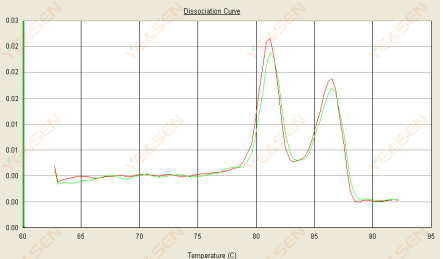
그림 15. 해리 곡선
가능한 원인:
1) 프라이머 특이성이 낮으면 비특이적 산물이 증폭됩니다.
2) gDNA 오염.
해결책:
1) 프라이머 특이성을 블라스트 체크하고, 불량할 경우 재설계합니다.
2) NRC 음성 대조군으로 확인한 경우, 템플릿을 다시 준비해야 함.
3.4 지저분한 용융 곡선 피크
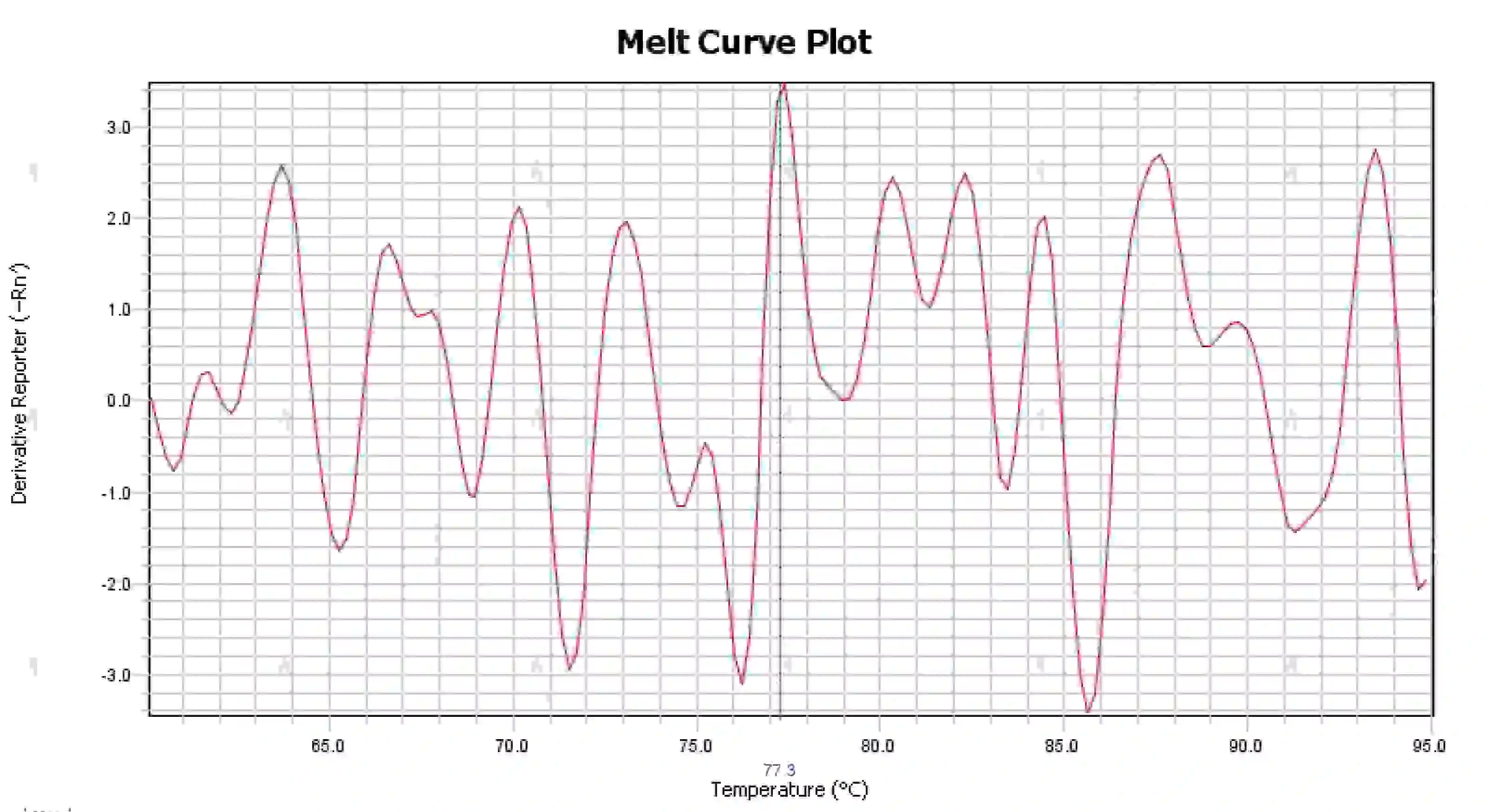
그림 16. 용융 곡선 플롯
가능한 원인:
1) 반응계의 오염
2) 시약을 강한 빛이나 고온에 노출시키면 시약이 손상될 수 있습니다.
3) 장비를 오랫동안 교정하지 않았습니다.
4) 소모품과 장비의 불일치.
해결책:
1) NTC와 NRC 결과를 결합하여 오염을 확인한 후, 물, 프라이머, 효소, 환경 등으로 인한 오염을 하나씩 배제하는 것이 좋습니다.
2) 새로운 시약을 사용하여 비교 실험을 하는 것이 좋습니다.
3) 정기적인 계측기 교정 유지관리가 권장됩니다.
4) 해당 계측기의 소모품 요구사항을 확인하세요.
3.5 용융곡선의 앞쪽 끝부분의 가짜 피크
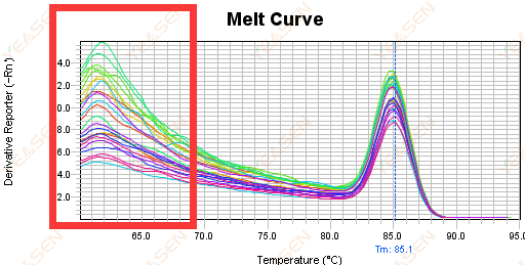
그림 17. 용융 곡선 플롯
가능한 원인:
Rox 농도가 모델과 일치하지 않습니다.
해결책:
융해곡선이 정상인지 확인하기 위해 Rox 보정을 취소하는 것이 좋습니다.
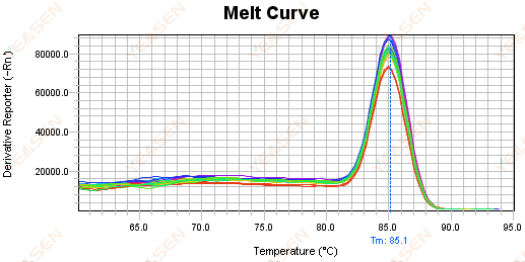
그림 18. 용융 곡선 플롯
4. 주문 정보
표 1. 주문 정보
| 제품 이름 | 제품 코드 | 사양 |
| Hieff Unicon™ Universal Blue qPCR 마스터 믹스(염료 기반) | 11184ES03 | 1ml(1ml) |
| 11184ES08 | 5×1ml | |
| 11184ES50 | 50×1ml | |
| 11184ES60 | 100×1ml |
5. 관련 상품
표 2. 관련 제품
| 제품 포지셔닝 | 제품 이름 | 제품 코드 |
| 1단계 gDNA 제거 및 역전사 | Hifair™V 원스텝 RT-gDNA 소화 SuperMix for qPCR ( 문의 ) | 11142ES |
| 고감도 마스터 믹스(gDNA 제거 단계 포함) | qPCR을 위한 Hifair™ III 1st Strand cDNA 합성 SuperMix (gDNA digester plus) | 11141ES |
| 고감도 키트(gDNA 제거 단계 포함) | Hifair™ III 1st Strand cDNA 합성 키트(gDNA digester plus) ( 문의 ) | 11139ES |
| 일반 정량 마스터 믹스(탐침법) | Hieff™ qPCR TaqMan Probe Master Mix ( 문의 ) | 11205ES |
6. 독서에 관하여
역전사효소 선택 지침
