Descrição
Hieff NGSTM O OnePot Pro DNA Library Prep Kit V3 é um kit de preparação de biblioteca baseado em fragmentação enzimática de nova geração especialmente desenvolvido e projetado para Iluminar Plataforma de sequenciamento &MGI. Comparado aos métodos tradicionais de construção de bibliotecas, este produto emprega enzimas de fragmentação de alta qualidade, eliminando o incômodo processo ultrassônico. Ele simplifica a operação combinando os módulos de fragmentação e reparo final em um. Além disso, as enzimas e o tampão para o módulo de ligação são pré-misturados, reduzindo significativamente o tempo e o custo da construção da biblioteca. Isso o torna mais adequado para a construção automatizada de bibliotecas. Este kit de preparação de biblioteca tem uma excelente taxa de conversão de biblioteca e é aplicável para amostras de todos os animais, plantas, microrganismos comuns, etc., e também amostras FFPE. Com base na geração anterior do kit de construção de biblioteca, este produto apresenta maior eficiência na fragmentação, end repair, dA-tailing e adapter ligation do que as versões anteriores. A enzima de alta fidelidade melhora significativamente a uniformidade e a fidelidade da amplificação.
Especificações
| Cat.No. | 12194ES08 / 12194ES24 / 12194ES96 |
| Tamanho | 8 T/24 E / 96 E |
Componentes
| Componentes No. | Nome | 12194ES08 | 12194ES24 | 12194ES96 |
| 12194-A | EsfregaçoTM Amortecedor 3.0 | 80 μL | 240 μL | 960 μL |
| 12194-B | EsfregaçoTM Enzima 3.0 | 80 μL | 240 μL | 960 μL |
| 12194-C | Mistura pronta para ligação | 200 μL | 600 μL | 3×800 μL |
| 12194-D | 2× Mix de amplificação Ultima HF | 200 μL | 600 μL | 3×800 μL |
[Observação]: Os componentes do kit são compatíveis com ambos Iluminar &MGI plataforma de sequenciamento, se o adaptador completo foi usado, Hieff NGSTM Mistura de primer (
Armazenar
Este produto deve ser armazenado a -25~-15℃ por 1 ano.
Notas
1. Sobre a operação
1. Por favor, opere com jalecos e luvas descartáveis,para sua segurança.
2. Descongele os componentes em temperatura ambiente. Após o descongelamento, misture bem no vórtex, gire o tubo brevemente e coloque-o no gelo para uso posterior.
3. Ao preparar a solução de reação de cada etapa, é recomendado usar uma pipeta para misturar bem ou agitar suavemente. Agitação vigorosa pode causar uma diminuição na saída da biblioteca.
4. É altamente recomendado usar pontas de pipeta filtradas para evitar contaminação cruzada. Certifique-se de trocar as pontas de pipeta ao processar amostras diferentes.
5. Operações impróprias podem muito provavelmente causar contaminações por aerossol, impactando a precisão do resultado. O isolamento físico obrigatório das regiões de mistura de reação de PCR e regiões de ensaio de purificação de produto de PCR é recomendado. Equipado com equipamentos como pipetas especializadas para construção de biblioteca. Realize a limpeza de rotina para cada área limpando as superfícies com 0,5% de hipoclorito de sódio ou 10% de alvejante
6. Este produto é somente para uso em pesquisa.
2. Fragmentação de DNA
1. O kit é compatível com 100 pg - 1000 ng de DNA de entrada. É altamente recomendado usar DNA de entrada de alta qualidade com A260/A280 = 1,8-2,0.
2. Os experimentos a seguir podem ser impactados se altas concentrações de sais como o agente quelante de metal forem introduzidas com o DNA de entrada. Recomendamos eluir a amostra de DNA em ddH2O para fragmentação.
3. Consulte a tabela 6 para o tempo de fragmentação de amostras de DNA padrão. O kit tem baixo viés de fragmentação e fornece cobertura GC uniforme para amostras de DNA com uma ampla gama de composições GC. Ajuste o tempo de fragmentação com base nos seus requisitos experimentais.
4. Para uma fragmentação precisa, prepare a reação no gelo.
3. Ligação do adaptador
1. Os kits de adaptador longo (adaptador com código de barras) e kits de adaptador curto da Illumina ou MGI estão disponíveis para os clientes escolherem de acordo com suas necessidades experimentais.
2. Foi recomendado selecionar adaptadores comerciais de alta qualidade. Se forem selecionados adaptadores feitos por você mesmo, confie a uma empresa com experiência em síntese de primers NGS e observe a necessidade de controle rigoroso de contaminação. Além disso, é recomendado preparar a solução de recozimento de DNA em uma bancada limpa e operar apenas um tipo de adaptador por vez para evitar contaminação cruzada.
3. Descongele os adaptadores no gelo ou a 4 °C; ao operar em temperatura ambiente, a temperatura do laboratório não deve exceder 25 °C para evitar que os adaptadores desnaturem.
4. A qualidade e a concentração dos adaptadores afetarão diretamente a eficiência da ligação e o rendimento da biblioteca. Concentração muito alta de adaptadores favorece a formação do dímero do adaptador, enquanto adaptador muito pequeno reduz a taxa de ligação e o rendimento da biblioteca. Diluições correspondentes com tampão TE de acordo com a quantidade de DNA de entrada ao usar o adaptador.Tabela 1-2 lista os métodos de diluição recomendados para adaptadores convencionais e UMI para diferentes quantidades de DNA de entrada usando este kit para as plataformas de sequenciamento Illumina ou MGI.
Mesa 1 O Illumina recomendado quantidade de adaptador para entrada diferente ADN
| Entrada ADN | Ctaxa de diluição do adaptador convencional | Concentração | Proporção de diluição do adaptador UMI | Concentração |
| <1 ng | 7,5 vezes | 2 μM | 15 vezes | 1 μM |
| 1 ng ~ 10 ng | 3 vezes | 5 μM | 3 vezes | 5 μM |
| 10 ng ~ 200 ng | 1,5 vezes | 10 μM | 2 vezes | 7,5 μM |
| >200 ng | 0-Fold | 15 μM | 0-Fold | 15 μM |
Mesa 2 O recomendado MGI quantidade de adaptador para entrada diferente ADN
| Entrada ADN | Ctaxa de diluição do adaptador convencional | Concentração | Proporção de diluição do adaptador UMI | Concentração |
| <1 ng | 5 vezes | 2 μM | 10 vezes | 1 μM |
| 1 ng ~ 10 ng | 2-Dobrado | 5 μM | 2-Dobrado | 5 μM |
| 10 ng ~ 200 ng | 0-Fold | 10 μM | 1.25 vezes | 8 μM |
| >200 ng | 0-Fold | 10 μM | 0-Fold | 10 μM |
4. Limpeza de DNA baseada em esferas e seleção de tamanho
1. A seleção do tamanho do DNA pode ser realizada antes do reparo final/cauda dA, após a ligação do adaptador ou após a amplificação.
2. É recomendável realizar a seleção do tamanho logo após a ligação do adaptador se a quantidade de DNA de entrada for maior que 50 ng; caso contrário, execute a seleção do tamanho após a amplificação.
3. O Ligation Enhancer contém uma alta concentração de PEG, o que pode causar um impacto significativo na seleção precisa do tamanho. Portanto, se a seleção do tamanho for realizada logo após a ligação do adaptador, é altamente recomendável adicionar uma etapa de limpeza de esferas antes da seleção do tamanho. A etapa de seleção do tamanho pode ser realizada diretamente se for realizada antes do reparo final/remoção de dA ou após a amplificação da biblioteca.
4. As esferas magnéticas devem ser equilibradas em temperatura ambiente antes do uso, caso contrário o rendimento diminuirá e o efeito de seleção do tamanho será afetado.
5. As esferas magnéticas devem ser bem misturadas por vórtice ou pipetagem antes do uso.
6. Não aspire as esferas ao transferir o sobrenadante, mesmo pequenas quantidades das esferas podem afetar as reações seguintes.
7. O etanol 80% deve ser preparado recentemente, caso contrário afetará a eficiência da recuperação.
8. Para uma seleção precisa do tamanho, é recomendado começar com um volume maior que 100 μL. Se for menor, é recomendado aumentar o volume para 100 μL com água ultrapura.
9. As esferas magnéticas devem ser secas à temperatura ambiente antes da eluição do produto. Secagem insuficiente facilmente fará com que o resíduo de etanol afete as reações subsequentes; secagem excessiva fará com que as esferas magnéticas quebrem e reduzam o rendimento da purificação. Normalmente, a secagem à temperatura ambiente por 3-5 minutos é suficiente para permitir que as esferas sequem completamente.
10. Se necessário, as amostras de DNA purificadas ou selecionadas por tamanho são eluídas em 0,1× O tampão TE pode ser armazenado a 4°C por 1-2 semanas ou a -20°C por um mês.
5. Amplificação de biblioteca
1. Se deve ou não realizar a amplificação da biblioteca depende da quantidade de entrada de DNA, tipos de adaptadores, aplicações de dados de sequenciamento, etc. A etapa de amplificação é necessária se usar adaptadores parciais. Ao usar adaptadores de comprimento total, se o DNA de entrada < 200 ng, é recomendado realizar a amplificação; caso contrário, a amplificação não é necessária.
2. Os números do ciclo de amplificação devem ser rigorosamente controlados. A amplificação insuficiente pode levar a um baixo rendimento da biblioteca; A superamplificação pode introduzir aumento de viés, erros, leitura duplicada e produtos quiméricos. Tabela 3 lista os números de ciclos recomendados visando o rendimento da biblioteca de 1 μg.
Mesa 3 O número recomendado de ciclos para gerar 1.000 ng de rendimento da biblioteca
| DNA de entrada | Número de ciclos necessários para gerar 1 μg de rendimento de biblioteca |
| 1000-2000 ng | 2 - 4 |
| 500 ng | 2 - 4 |
| 250 ng | 4 - 6 |
| 100 ng | 5 - 7 |
| 50 ng | 7 - 9 |
| 10 ng | 9 - 11 |
| 5 ng | 10 - 12 |
| 1 ng | 12 - 15 |
| 100 pg | 16 - 18 |
Observação
1.Tabela 3 mostra o número de parâmetros de loop usando testes de DNA de entrada de alta qualidade de cerca de 200 pb. A qualidade do DNA FFPE varia muito e, quando a qualidade do DNA é ruim ou o comprimento da biblioteca é longo, o número de ciclos precisa ser aumentado adequadamente para obter bibliotecas suficientes.
2. Se a seleção do tamanho for necessária durante o processo de construção da biblioteca, recomenda-se um número maior de ciclos para a Ampliação da Biblioteca; caso contrário, recomenda-se um número menor de ciclos.
3. Se forem usados adaptadores incompletos, pelo menos 2 ciclos precisam ser amplificados para formar um adaptador completo.
6. Análise de qualidade da biblioteca
1. A qualidade das bibliotecas construídas é geralmente analisada pela medição das concentrações e distribuições de tamanho.
2. As concentrações das bibliotecas podem ser medidas por métodos baseados em fluorescência, como Qubit e PicoGreen ou qPCR.
3. NÃO é recomendado usar métodos de quantificação baseados em absorbância, como o NanoDrop.
4. É recomendado usar o método qPCR para quantificação de biblioteca: métodos baseados em fluorescência como Qubit e PicoGreen não conseguem diferenciar as estruturas de dsDNA incompletas (inserções sem adaptador ou com apenas uma das extremidades ligadas com adaptador) das bibliotecas completas. O método qPCR amplificará e medirá apenas as bibliotecas completas com ambas as extremidades ligadas com adaptadores (as bibliotecas sequenciáveis), fornecendo assim uma medição mais precisa para carregamento.
5. A distribuição de tamanho das bibliotecas pode ser analisada usando o Agilent Bioanalyzer ou outros dispositivos baseados nos princípios de eletroforese capilar ou microfluídica.
7. Outros materiais
1. Esferas magnéticas de purificação de DNA: Hieff NGSTM Contas de seleção de DNA (
2.Adaptadores: Adaptador completo para Illumina:
3. Análise de qualidade da biblioteca: Agilent 2100 Bioanalyzer DNA 1000 Chip/High Sensitivity Chip ou outros produtos equivalentes; reagentes quantitativos da biblioteca.
4. Outros materiais: etanol absoluto, água ultrapura estéril, pontas de pipeta de baixa retenção, tubo de PCR, suportes magnéticos, termociclador, etc.
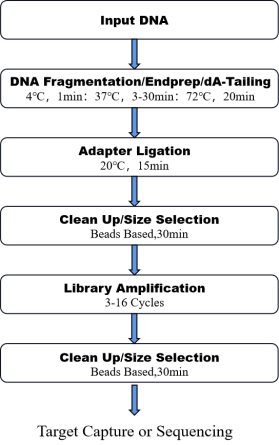
8. Fluxo de trabalho
Figura 1. O fluxo de trabalho de Um Pote Pró ADN Kit de preparação para biblioteca
Figuras
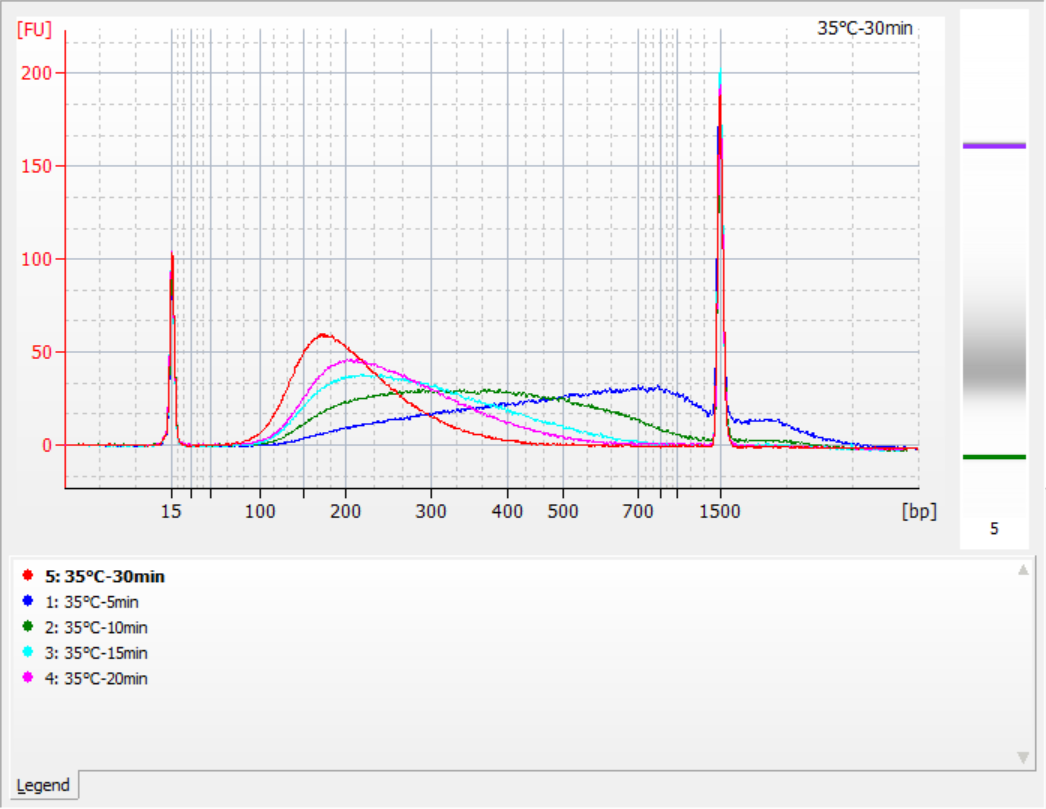
Os tamanhos dos fragmentos de inserção obtidos sob diferentes condições de fragmentação
Usando 500 ng de gDNA padrão como molde, bibliotecas foram construídas com este kit. As condições de fragmentação foram digestão enzimática a 32°C, 35°C e 37°C por 5, 10, 15, 20 e 30 minutos, respectivamente. Os produtos fragmentados foram purificados com esferas magnéticas de 1,2x e eluídos com 21 μL de ddH2O. A concentração foi medida usando Qubit, e a distribuição dos fragmentos de inserção recuperados é mostrada na figura a seguir.
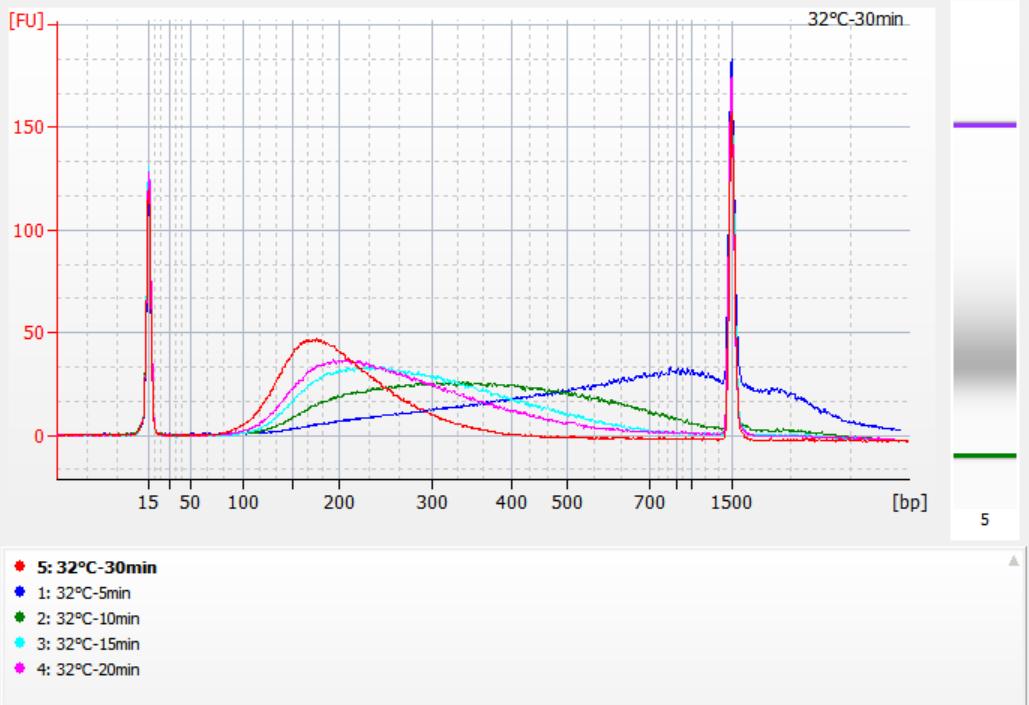 |
Figura 2. Perfis de biblioteca a 32°C para diferentes tempos de digestão enzimática
 |
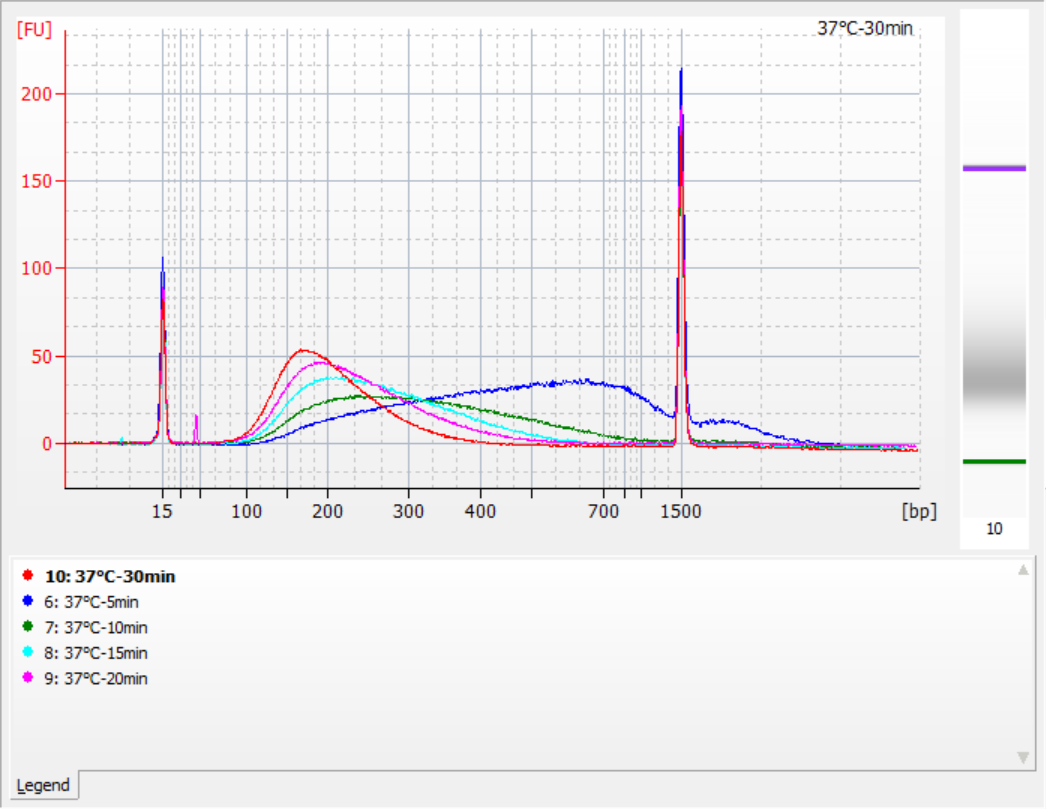 |
Pagamento e segurança
Suas informações de pagamento são processadas com segurança. Não armazenamos detalhes do cartão de crédito nem temos acesso às informações do seu cartão de crédito.
Investigação
Você também pode gostar
Perguntas frequentes
O produto é apenas para fins de pesquisa e não se destina ao uso terapêutico ou diagnóstico em humanos ou animais. Os produtos e o conteúdo são protegidos por patentes, marcas registradas e direitos autorais de propriedade da
Certos aplicativos podem exigir direitos adicionais de propriedade intelectual de terceiros.