Что делать, если результаты ПЦР странные?
Эксперименты qPCR могут показаться простыми, а иногда и сложными. После завершения разработки праймера образцы qPCR добавляются шаг за шагом, как в случае ПЦР, и эксперимент может быть завершен на машине. Существует несколько распространенных проблем в экспериментах qPCR методом окрашивания, и, учитывая возможные причины и решения, мы надеемся, что вы сможете использовать их для решения проблем в экспериментах qPCR.
1. Что такое ПЦР?
2. Аномальная кривая амплификации ПЦР
3. Аномальная кривая плавления ПЦР
4. Информация о заказе
5. Сопутствующие товары
6. О чтении
1. Что такое ПЦР?
С момента изобретения метода полимеразной цепной реакции (ПЦР) ПЦР, вероятно, является наиболее широко используемым методом в молекулярной биологии благодаря своей простоте, дешевизне, надежности, быстроте и высокой чувствительности. qPCR — это технология, разработанная технологией ПЦР. В процессе амплификации ДНК метод обнаружения общего количества продуктов после каждого цикла ПЦР с флуоресцентными красителями не только обладает быстротой и чувствительностью ПЦР, но также имеет большую специфичность и высокий, мониторинг в реальном времени, повторяемую и точную количественную оценку и другие преимущества. qPCR — это технология, которая использует устройство количественной амплификации ПЦР в реальном времени, а именно прибор qPCR, для мониторинга продуктов амплификации нуклеиновых кислот в реальном времени во время процесса ПЦР. qPCR реализует количественный анализ исходного шаблона посредством анализа значения Ct и стандартной кривой. В 1992 году японец Хигучи впервые предложил «технологию флуоресцентной количественной ПЦР в реальном времени». В 1996 году американская биологическая компания выпустила первый в мире флуоресцентный количественный ПЦР-инструмент, состоящий из системы термического цикла амплификации ПЦР, оптической системы обнаружения флуоресценции, а также компьютерного и прикладного программного обеспечения. Он может контролировать продукты амплификации нуклеиновых кислот в реальном времени с помощью флуоресцентных красителей или флуоресцентных зондов. , через математическое функциональное соотношение в сочетании с программным обеспечением для анализа результатов, реализуется расчет начального количества шаблона образца для тестирования. Поэтому технология флуоресцентной количественной ПЦР в реальном времени получила широкое распространение. Методы флуоресцентной маркировки для количественной ПЦР делятся на метод мозаики флуоресцентных красителей, основанный на методе красителя SYBR Green I, метод флуоресцентных зондов, основанный на методе зонда Taqman (Cycling Probe, Molecular Bracon и т. д.), метод праймера красителя-гасителя.
Эксперименты qPCR могут показаться простыми, а иногда и сложными. После завершения разработки праймера образцы qPCR добавляются шаг за шагом, как в случае с ПЦР, и эксперимент может быть завершен на машине. Однако необходимо обратить внимание на множество мелких деталей, таких как отсутствие жидкости, висящей на стенке трубы, отсутствие пузырьков в трубе и необходимость минимизировать прямой контакт между стенкой трубы, крышкой трубы и т. д., чтобы уменьшить экспериментальные ошибки или странные экспериментальные результаты. Xiaoyi собрал несколько распространенных проблем в экспериментах qPCR методом окрашивания и привел возможные причины и решения, которые, как мы надеемся, вы сможете использовать для решения проблем в экспериментах qPCR.
2. Аномальная кривая амплификации ПЦР
2.1 Отклонения в базовой фазе логарифмического графика кривой амплификации
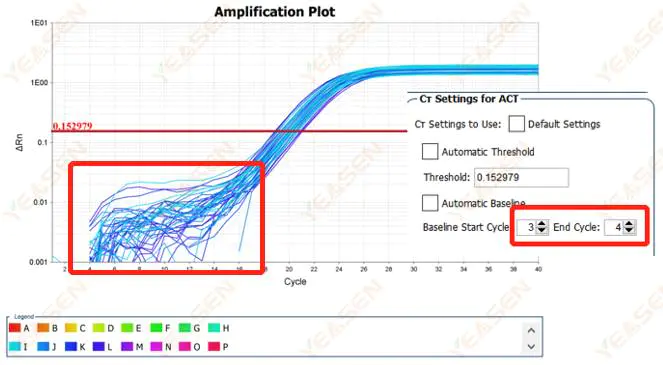
Рисунок 1. График амплификации
Возможные причины:
Неправильная настройка исходного уровня.
Решения:
Рекомендуется увеличить конечное значение базовой линии.Пример схемы регулировки выглядит следующим образом.

Рисунок 2. График амплификации
2.2 Сегментация логарифмической кривой амплификации
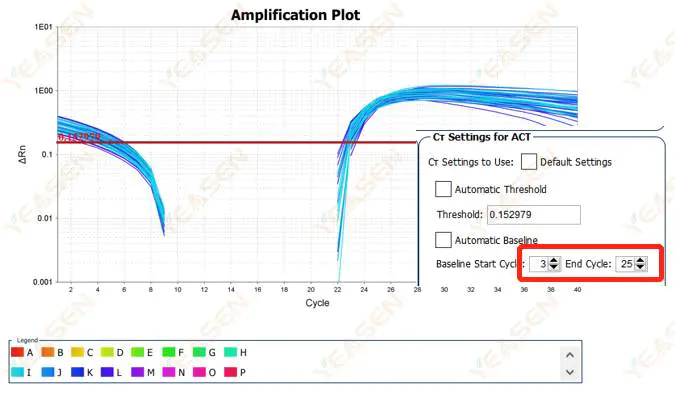
Рисунок 3. График амплификации
Возможные причины:
Базовый уровень установлен слишком высоко.
Решения:
Рекомендуется уменьшить конечное значение базовой линии. Диаграмма примера корректировки выглядит следующим образом.
2.3 Негладкий график линейности кривой амплификации
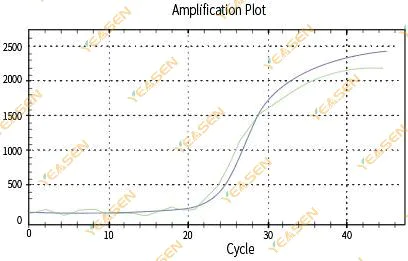
Рисунок 4. График амплификации
Возможные причины:
1) Пробирка для реакции ПЦР была закрыта неплотно, и реакционный раствор вытек.
2)Реакционный раствор ПЦР с подвесной стенкой.
3) Прибор не откалиброван (включая автоматическую калибровку или калибровку ROX).
4) В системе имеется много ингибиторов, что приводит к нестабильной флуоресценции.
5) Чрезмерное использование прибора приводит к нестабильному сбору флуоресценции.
Решения:
1) Плотно прижмите крышку трубы.
2) Тщательно перемешайте реагент и после полного центрифугирования осторожно поместите его в количественный прибор.
3) Откалибруйте прибор.
4) Улучшить чистоту РНК и выбрать подходящие реагенты для обратной транскрипции.
2.4 Усиленный линейный график кривой зигзагообразный на плато
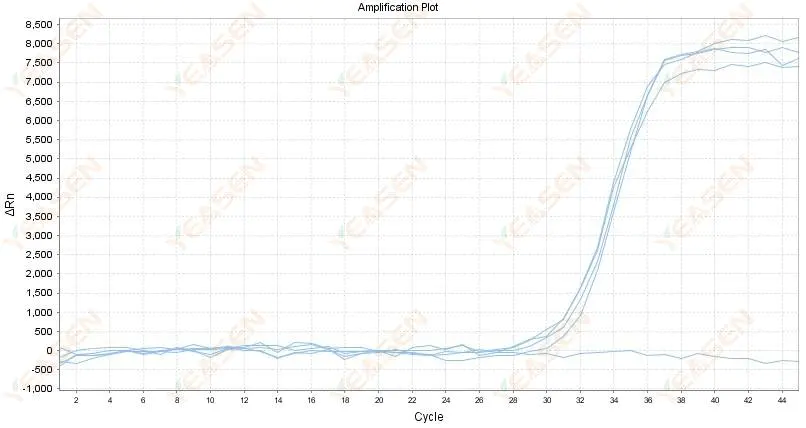
Рисунок 5. График амплификации
Возможные причины:
1) Чистота РНК низкая, в ней много примесей.
2) Инструмент используется слишком долго.
Решения:
1) Повторное извлечение высококачественной РНК.
2) Разбавьте РНК-шаблон, чтобы уменьшить концентрацию примесей.
3) Откалибруйте прибор.
2.5 Линейный график кривой амплификации не достигает плато
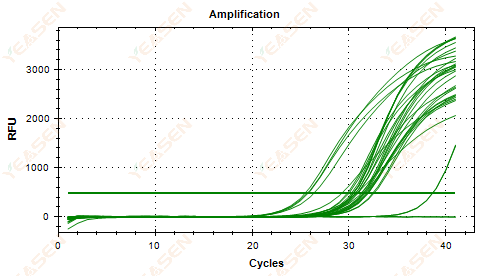
Рисунок 6. График амплификации
Возможные причины:
1) Низкая концентрация шаблона (значение Ct около 35).
2) Слишком мало циклов амплификации.
3) Низкая эффективность амплификации реагента (маленький Ct, но и достичь плато не удается).
Решения:
1) Увеличьте концентрацию шаблона.
2) Увеличьте количество циклов.
3) Увеличение Mg2+ концентрация.
2.6 Кривая амплификации линейный график плато провисание
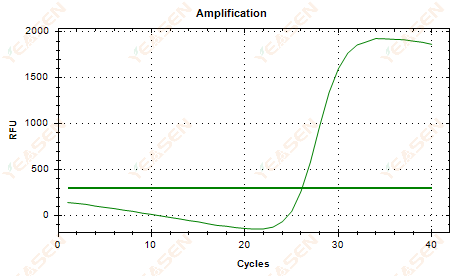
Рисунок 7. График амплификации
Возможные причины:
1) Наличие деградации (деградация продукта амплификации, деградация SYBR).
2) Крышка пробирки закрыта неплотно, и реагент улетучивается.
3) Концентрация кДНК слишком высока (если значение Ct слишком мало, порог флуоресценции повышается, а провисание становится более выраженным).
4) В трубке появляются пузырьки воздуха, затем они исчезают.
Решения:
1) Улучшить чистоту системы.
2) Уменьшите количество кДНК (разбавьте шаблон).
3) Уменьшите конечное значение базовой линии.
2.7 Большое значение Ct в кривой амплификации
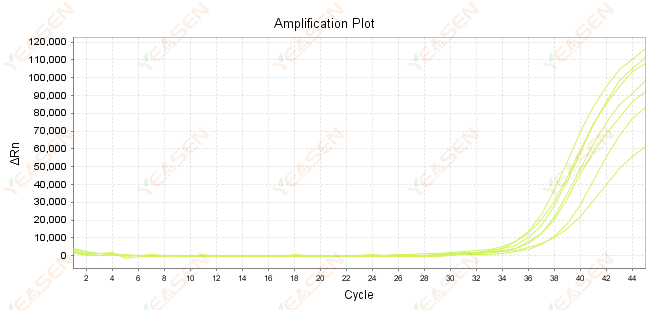
Рисунок 8. График амплификации
Возможные причины:
1) Малое количество шаблонов.
2) Низкая эффективность усиления.
3) Фрагмент ПЦР слишком длинный.
4) Наличие ингибиторов в реакционной системе.
Решения:
1) Сократите время разбавления или увеличьте количество матрицы так, чтобы значение Ct находилось в диапазоне от 15 до 30, насколько это возможно.
2) Оптимизируйте условия реакции, попробуйте трехэтапную процедуру амплификации или перепроектируйте праймеры.
3) Длина продукта ПЦР должна быть в пределах 100–150 п.н., не рекомендуется превышать 300 п.н.
4) Воспроизведение шаблонов более высокой чистоты.
2.8 Плохая повторяемость кривых амплификации
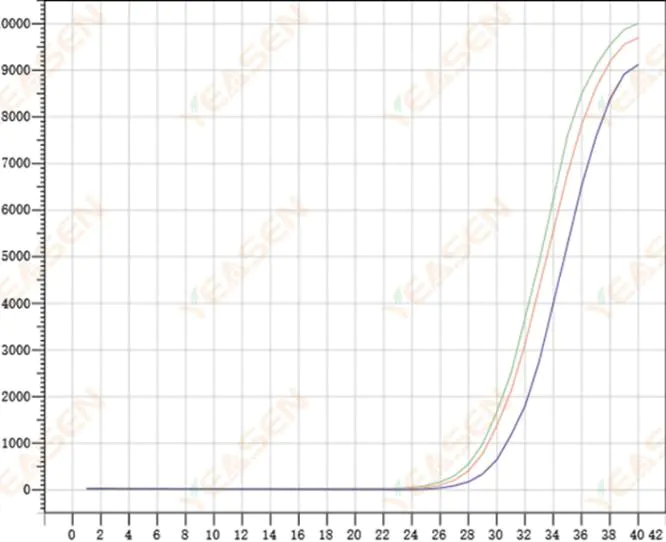
Рисунок 9. График амплификации
Возможные причины:
1) Большие ошибки всплесков.
2) Реагенты и системы плохо перемешаны.
3) Низкое число копий кДНК.
4) Калибровка Rox не использовалась.
Решения:
1) Калибровка пипеток.
2) Тщательное перемешивание реакционной системы.
3) Низкая концентрация шаблона, плохая повторяемость, 4–6 составных отверстий и 1–2 отклонения больших значений могут быть соответствующим образом отброшены.
4) Лучше всего использовать калибровку Rox. Если используемый реагент не содержит Rox, необходимо выбрать референтный краситель None.
2.9 Случайные кривые амплификации
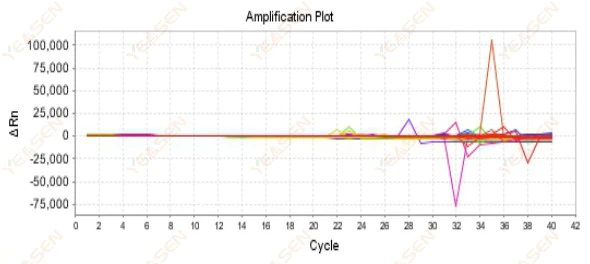
Рисунок 10. График амплификации
Возможные причины:
Несоответствие между концентрацией Rox и моделью.
Решения:
Измените настройку контрольного красителя на приборе с ROX на NONE и посмотрите, вернется ли кривая амплификации к норме.
2.10 Пик NTC
2.10.1 Ct>35, значение Tm кривой плавления <80℃
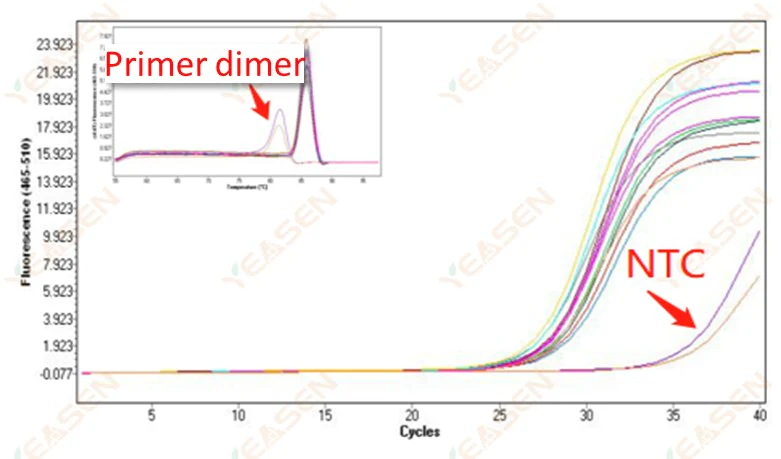
Рисунок 11. График амплификации
Возможные причины:
Результаты димеризации праймеров.
Решения:
Оптимизированные праймеры.
2.10.2 Значение Ct <35, форма пика кривой плавления NTC и кривой плавления гена перекрывается
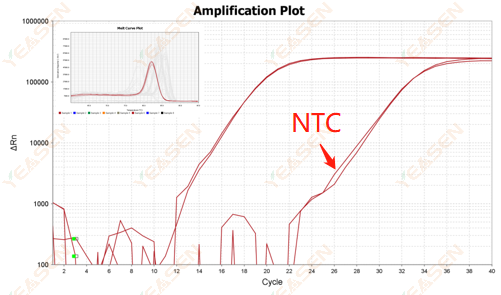
Рисунок 12. График амплификации
Возможные причины:
Загрязнение реакционной системы.
Решения:
Проверяйте источники загрязнения один за другим.
3. Аномальная кривая плавления ПЦР
3.1 Кривая плавления с одним пиком, но не острая
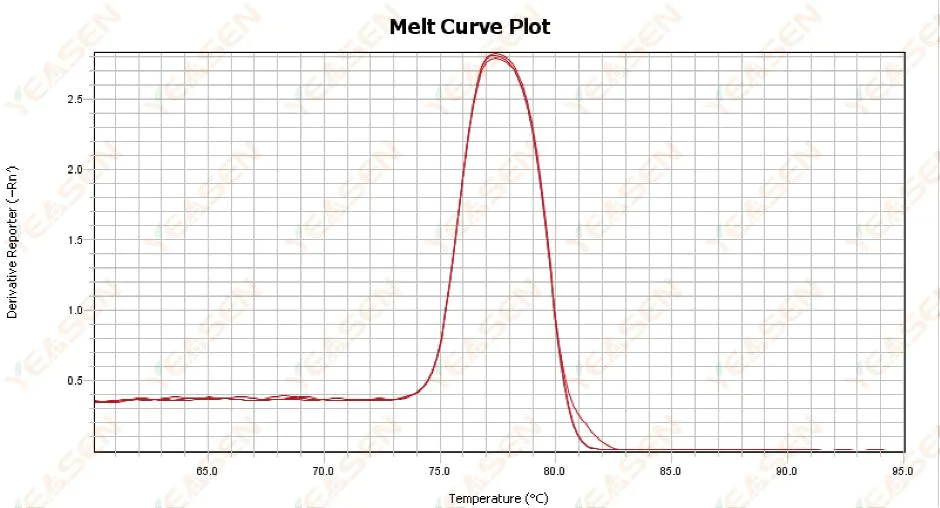
Рисунок 13. График кривой плавления
Возможные причины:
1) Это связано с составом реагента и моделью прибора.
2) Наличие неспецифической амплификации фрагментов одинакового размера.
Решения:
1) Диапазон температур от начала пика до его окончания не превышает 7°C. Результаты считаются пригодными для использования, т.е. один пик.
2) Для облегчения определения был проведен электрофорез в высококонцентрированной агарозе (например, 3% агарозы).
3.2 Кривая плавления имеет два пика, а нижний пик Tm находится до 80°C.
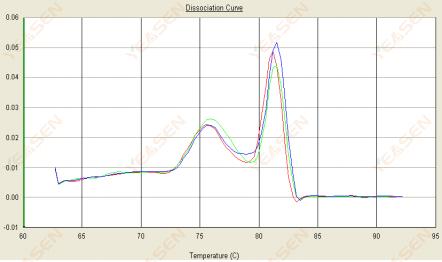
Рисунок 14. Кривая диссоциации
Возможные причины:
Наличие димеров праймеров.
Решения:
Увеличьте температуру отжига, уменьшите концентрацию праймера или перепроектируйте праймеры.
3.3 Кривая плавления имеет два пика, а нижний пик Tm находится после 80°C.
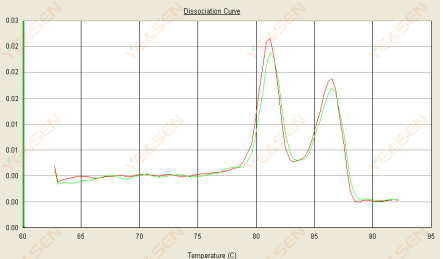
Рисунок 15. Кривая диссоциации
Возможные причины:
1) Низкая специфичность праймера приводит к амплификации неспецифических продуктов.
2) загрязнение геномной ДНК.
Решения:
1) Проверьте специфичность праймера, переделайте его, если он неудовлетворителен.
2) Подтверждение отрицательного контроля NRC, если таковое имеется, необходимо повторно подготовить шаблон.
3.4 Нечеткие пики кривой плавления
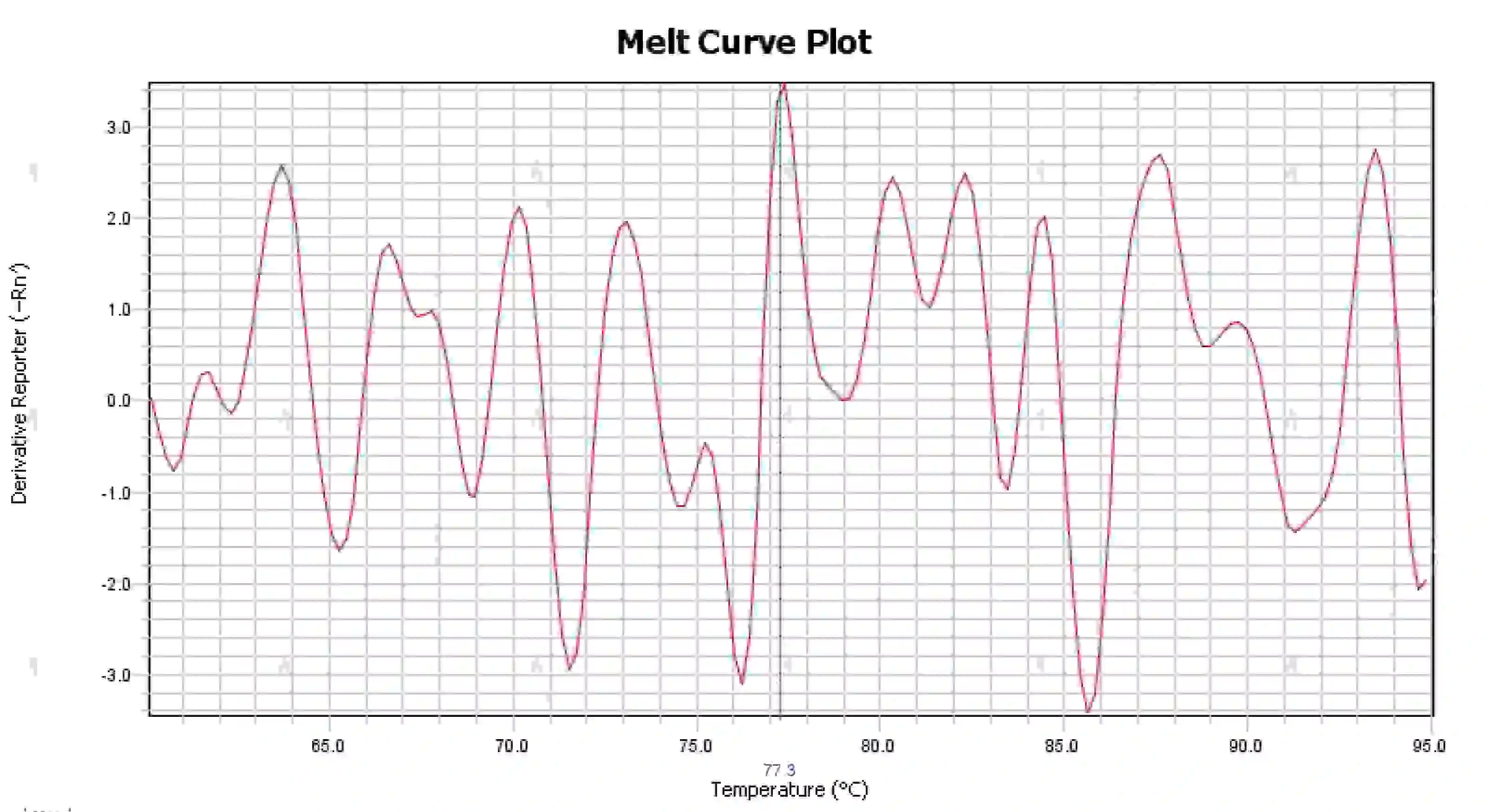
Рисунок 16. График кривой плавления
Возможные причины:
1) Загрязнение реакционной системы.
2) Воздействие яркого света или высокой температуры на реагенты приводит к их порче.
3) Прибор давно не калибровался.
4) Несоответствие расходных материалов и инструментов.
Решения:
1) Объединив результаты NTC и NRC для подтверждения загрязнения, рекомендуется поочередно исключить загрязнение из воды, грунтовок, ферментов и окружающей среды.
2) Рекомендуется провести сравнительные эксперименты с новыми реагентами.
3) Рекомендуется проводить регулярную калибровку прибора.
4) Подтвердите требования соответствующего прибора к расходным материалам.
3.5 Ложные пики на переднем конце кривой плавления
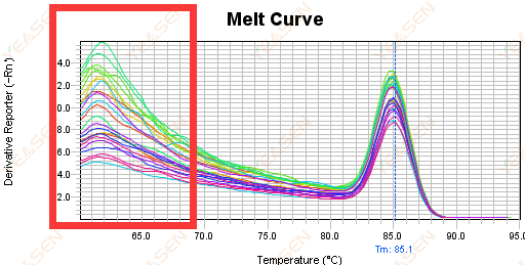
Рисунок 17. График кривой плавления
Возможные причины:
Концентрация Rox не соответствует модели.
Решения:
Рекомендуется отменить коррекцию Rox, чтобы проверить, является ли кривая плавления нормальной.
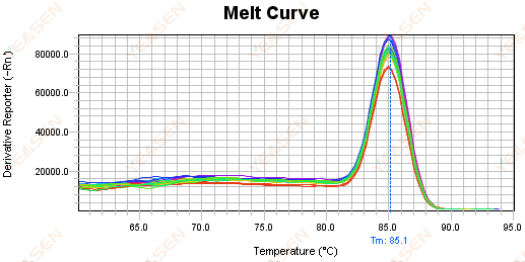
Рисунок 18. График кривой плавления
4. Информация о заказе
Таблица 1. Информация для заказа
| Название продукта | Код продукта | Спецификация |
| Hieff Unicon™ Universal Blue qPCR Master Mix (на основе красителя) | 11184ES03 | 1 мл |
| 11184ES08 | 5×1 мл | |
| 11184ES50 | 50×1 мл | |
| 11184ES60 | 100×1 мл |
5. Сопутствующие товары
Компания Yeasen предлагает следующую продукцию.
Таблица 2. Сопутствующие товары
| Позиционирование продукта | Название продукта | Код продукта |
| Одношаговое удаление геномной ДНК и обратная транскрипция | Hifair™V одноэтапное расщепление ОТ-геномной ДНК SuperMix для количественной ПЦР (Расследование) | 11142ES |
| Мастер-микс высокой чувствительности (с этапом удаления геномной ДНК) | Hifair™ III 1st Strand cDNA Synthesis SuperMix для количественной ПЦР (gDNA digester plus) | 11141ES |
| Набор для высокочувствительного анализа (с этапом удаления геномной ДНК) | Набор для синтеза первой цепи ДНК Hifair™ III (gDNA digester plus) (Расследование) | 11139ES |
| Обычная количественная мастер-микс (метод зонда) | Hieff™ qPCR TaqMan Probe Master Mix (Расследование) | 11205ES |
6. О чтении
ДНКаза I и ее применение в биомедицине
Руководство по выбору обратной транскриптазы
