Organoidler üzerine yapılan araştırmalar derinleştikçe, giderek daha fazla sayıda kişi katılıyor. Bu makale, organoidler hakkında bazı genel bilgi noktalarını özetliyor [1-5] ve herkese yardımcı olmayı umuyor.
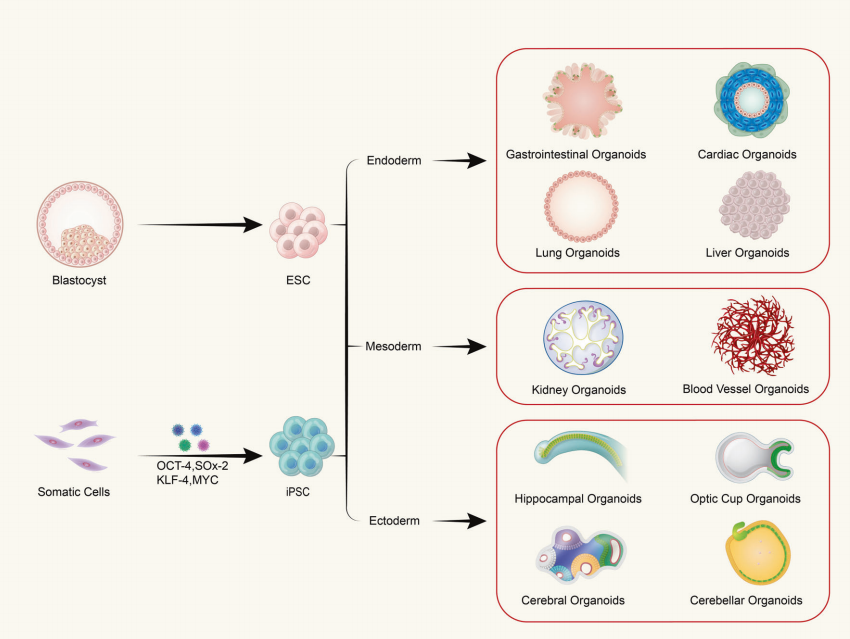
S: Organoidler tek tip hücreden mi yoksa çok hücreli dokulardan mı oluşur?
Organoidler, yetişkin kök hücrelerin veya pluripotent kök hücrelerin in vitro üç boyutlu (3B) yetiştirilmesiyle oluşur ve belirli bir mekansal organizasyona sahip doku benzeri yapılara neden olur. Organoidler tek hücrelerden oluşan yapılar değildir; bunun yerine, kök hücre özelliklerine sahip başlatıcı hücrelerin bölünmesini ve farklılaşmasını indükleyerek oluşurlar ve daha sonra in vivo'daki karşılık gelen organlara benzer belirli bir mekansal yapı, morfoloji ve işlevselliğe sahip dokulara kendi kendine birleşirler.
S: Organoidlerin kültürlenmesi için kaynaklar nelerdir?
(1) Pluripotent kök hücrelerden elde edilen organoidler arasında yetişkin kök hücreler (ASC), pluripotent kök hücreler (PSC) ve uyarılmış pluripotent kök hücreler (iPSC) bulunur. (2) Dokudan çıkarılan hücrelerden elde edilen organoidler genellikle tümör dokularında bulunur.
S: Taze doku bulunmadığında dondurulmuş doku 3 boyutlu kültür için kullanılabilir mi?
Evet, ancak dondurulmuş dokunun büyüklüğü için daha yüksek gereksinimler vardır ve birincil dondurulmuş doku ve hücrelerin canlılığı önemli ölçüde azalacaktır, bu da sonraki yetiştirmede başarı oranının büyük ölçüde düşmesine yol açacaktır.
S: Organoidler nasıl dondurulur ve canlandırılır?
Organoidleri dondurmak için en uygun zaman, organoidlerin aktivitesi ve farklılaşma potansiyelinin en iyi olduğu 2-5 pasajlarıdır. Organoidlerin canlandırılması, hücre canlandırmasında kullanılan yöntemleri takip edebilir.
S: Kültür organoidlerinin boyutunu kontrol etmek gerekli midir ve çok büyük olmaları yararlı mıdır?
Evet, organoidlerin iç vasküler ve gaz-sıvı dolaşım sistemleri olmadığından, tercihen 500 μm içinde boyutu kontrol etmek gerekir. Organoidlerin boyutu büyük olduğunda, merkeze yakın hücreler dış ortamla oksijen ve besin alışverişinde bulunmak için mücadele eder. Bu nedenle, yapı ne kadar büyükse, ölü hücre sayısı da o kadar fazla olur.
S: Matris jelinin yanı sıra organoidlerin kültürü için başka neler kullanılabilir?
Matris jeline ek olarak, organoidleri kültürlemek için alternatifler arasında (1) hücresizleştirilmiş hücre dışı matris ve diğer türetilmiş proteinler, (2) sentetik hidrojeller ve (3) tasarlanmış rekombinant protein jelleri yer alır.
S: Organoidlerin yönlendirilmiş farklılaşması nasıl sağlanabilir?
Organoidlerde kök hücre kaynaklı farklılaşmanın erken gelişimi, birden fazla sinyal yolu tarafından ortaklaşa düzenlenir. İn vitro yetiştirme, bu sinyal yollarının aktivitesini simüle etmek için büyüme faktörlerinin eklenmesini gerektirir ve hücreleri belirli yönlerde farklılaşmaya yönlendirir. Örneğin, Y27632 ve Activin A ile indüksiyon, embriyonik kök hücreleri (ESC'ler) veya indüklenmiş pluripotent kök hücreleri (iPSC'ler) embriyonik gövdelere (EB'ler) farklılaştırabilir. Daha sonra, sinyal yolları, kök hücre farklılaşmasını belirli yönlerde indüklemek için Wnt3a, FGF-4 ve Noggin gibi faktörler tarafından düzenlenir.
S: Klinik örnekler alınırken kontaminasyon nasıl önlenebilir?
(1) Mümkün olduğunca aseptik örnekleme sağlayın. (2) Çıkarmadan önce, antibiyotik içeren PBS'ye birkaç dakika daldırın: mide, bağırsaklar ve mesane gibi dış ortamla potansiyel teması olan bölgelerde bulunan tümörler için, %3-%5 antibiyotik içeren PBS'ye 5-10 dakika daldırılması önerilir; diğer yaygın tümörler için, yaklaşık 5 dakika boyunca %1-%2 antibiyotik içeren PBS'ye daldırın. (3) Hücre çıkarma sırasında kullanılan tüm reaktifler %1 antibiyotik ve uygun konsantrasyonda birincil antibiyotik içermelidir.
S: Tümör dokularının toplanması, saklanması ve taşınmasında hangi önlemler alınmalıdır?
Mümkün olduğunca yüksek tümör hücresi içeriğine sahip tümör dokularını toplayın ve kontaminasyon olasılığını azaltmak için doku örneklerinin havaya maruz kalma süresini en aza indirin. Toplanan tümör doku örneklerini mümkün olan en kısa sürede özel örnek koruma solüsyonu içeren steril tüplere yerleştirin ve düşük sıcaklıkta (yaklaşık 4°C) hızla test ünitesine taşıyın (örneklemeden sonra 2~4 saat içinde teslim etmeye çalışın).
S: Lezyonlardan kültürlenen organoidler ile komşu dokulardan kültürlenen organoidler arasında bir fark var mıdır?
Tümör dokularının örnekleme bölgelerinin gereksinimleri nelerdir? Evet, bir fark vardır. Tümörler kendileri heterojenlik gösterir, bu nedenle farklı kaynaklardan türetilen organoidler arasında farklılıklar gözlemlemek yaygındır. Morfolojik olarak, birincil lezyonlardan türetilen organoidler, bitişik dokulardan türetilenlere kıyasla daha invaziv bir yapıya sahip olma eğilimindedir ve genellikle daha düzensiz görünür. Modelleme veya ilaç taramasındaki hataları en aza indirmek için, iyi aktiviteye sahip bölgelerden birden fazla örnek alınmalıdır.
S: Tümör organoidlerinin ilaç duyarlılığı testinde hangi tip ilaçlar kullanılabilir?
Klinik pratikte kullanılan başlıca anti-tümör ilaç tipleri üç kategoriye ayrılabilir: sitotoksik ilaçlar (paklitaksel, sisplatin/karboplatin, 5-FU vb.), hedeflenmiş ilaçlar (EGFR, HER2, VEGFR vb.'yi hedef alan ilaçlar) ve immün kontrol noktası inhibitörleri ile temsil edilen immünoterapi ilaçları (PD-1 antikorları, PD-L1 antikorları vb.).
S: PDO yetiştiriciliğinin başarı oranı nedir?
PDO ekiminin başarı oranı kaynağa bağlı olarak biraz değişir. Çoğu PDO'nun %63 ila %70 arasında veya hatta daha yüksek, %90'a kadar bir başarı oranı vardır ve bu büyük ölçüde dokunun kendi aktivitesiyle ilişkilidir. Ek olarak, klinik tedaviler başarı oranını etkileyebilir. Doku ex vivo ve operasyonel adımların süresini azaltarak başarı oranları iyileştirilebilir.
S: Dondurulmuş doku organoid yetiştiriciliğinde kullanılabilir mi?
Genellikle, doku kriyoprezervasyonu önemli canlılık kaybı nedeniyle önerilmez. Ancak, dokular -80°C'de saklanırsa, organoid yetiştirme için en uygun zaman aralığı, saklamadan sonraki 6 haftadır. Dokular sıvı nitrojende saklanırsa, saklama süresi daha uzun olabilir ancak tercihen altı ayı geçmemelidir.
S: Birincil hücreler çıkarılırken genellikle fibroblastlar da karışır. Bunlarla nasıl başa çıkılmalıdır?
(1) Fibroblastların zayıf yapışması nedeniyle, tekrarlanan yapışmalarla uzaklaştırılabilirler.(2) Fibroblast çıkarma reaktifleri kullanılabilir, ancak bunların organoid kültürünü etkileyip etkilemediğinin deneysel olarak doğrulanması gerekir.
S: Tümör organoidlerinin kültürü için ne kadar orijinal tümör dokusuna ihtiyaç vardır? Biyopsi örneği yeterli midir?
Genellikle cerrahi dokuların 2-3 soya fasulyesinden büyük olması gerekir; iğne biyopsisi ile elde edilmişse en az 2-3 örnek gerekirken, endoskopik biyopsilerde en az altı veya daha fazla tümör dokusunun klemplenmesi gerekir.
S: Tümör dokusu örneği çok küçükse ve kültürlenen organoidlerin sayısı sonraki testler için yeterli değilse ne yapılmalıdır?
Tümör kaynaklarından türetilen organoidler pasajdan sonra fenotipik farklılıklar gösterebileceğinden, pasaj genellikle önerilmez. Literatürde organoidlerin pasajının 2-3 jenerasyonla, maksimum 5 jenerasyonla sınırlandırılması önerilir. Hücre sayısı çok azsa ve 5 jenerasyondan sonra test gereksinimlerini karşılayamıyorsa, daha küçük 384-kuyulu bir plaka kullanmak veya test için mikroakışkan çipleri denemek gibi test yöntemini değiştirmeyi düşünün.
S: Tümör dokularında normal hücreler olacak mı? Bu normal hücreler nasıl çıkarılır?
Az sayıda normal hücre olabilir. İlk olarak, toplama sırasında normal dokuları örneklemekten kaçının. İkinci olarak, birincil hücreleri çıkardıktan sonra, daha fazla organoid yetiştirme için manyetik boncuk ayırma veya akış sitometrisi kullanılabilir. Çok az sayıda normal hücre mevcut olduğunda, bu sonraki organoid modellemesini ve yetiştirmeyi önemli ölçüde etkilemez, bu nedenle çıkarma gerekli olmayabilir.
S: Tümör dokularından birincil hücreler çıkarıldığında hücreler neden kırmızı görünür?
Dokular canlı organizmada kan temini açısından zengindir, bu nedenle çok sayıda kırmızı kan hücresi vardır. Çoğu durumda, bu işlem gerektirmez ve organoid yetiştiriciliğini etkilemez. Çok fazla kırmızı kan hücresi varsa, yetiştirmeden önce uygun şekilde lizis tamponuyla işlenebilirler.
S: Organoid yetiştirme sırasında siyah parçacıklar bulundu. Bunlar nasıl çıkarılır?
Siyah parçacıklar büyük ihtimalle safsızlıklar veya hücre artıklarıdır. İki şekilde çıkarılabilirler:
Organoidleri sindirin ve içindeki kirleri seyreltmek için tekrar tekrar besiyeriyle yıkayın.
Organoidleri ikiye kesmek için steril bir cerrahi bıçak kullanın, ardından organoidlerdeki kirleri nazikçe temizlemek için ortamla dolu 1 ml'lik bir şırınga kullanın.
S: Organoid yetiştiriciliğinde pasaj sayısının bir sınırı var mıdır ve kaç pasaj yapılabilir?
Geçiş sayısı genellikle kaynak hücrelerin özelliklerine bağlıdır. Çoğu organoid in vitro'da 10 defaya kadar (>6 ay) geçirilebilir. Kültür koşullarının seçimi de bir miktar etkiye sahip olabilir, şartlandırılmış ortam genellikle sentetik faktör ortamından üstündür.
S: Tümör hücre hatları (HepG2 hücre hattı gibi) PDO'lara kültürlenebilir mi?
PDO'lar karmaşık kendiliğinden oluşan yapılardır. Tek hücre hatlarından oluşan 3 boyutlu kültür sistemlerine PDO denilemez; bunlara basitçe 3 boyutlu küresel durumlar denir.
S: Organoidlerin geçişi için kriterler nelerdir?
Organoidlerin gelişim durumuna bağlı olarak, süre genellikle 5-10 gün arasında değişir ve çapı yaklaşık 100-200μm'dir. Yavaş gelişen bazı organoidlerin uygun bir geçiş durumuna ulaşması birkaç hafta sürebilir.
S: Canlı organoidlerin sayısı nasıl sayılır?
Deney sırasında, önceden hazırlanmış Calcein-AM saklama solüsyonunu çıkarın ve Calcein-AM solüsyonunu 0,2 μmol/L'lik son konsantrasyona kadar ortama ekleyin. 37°C'de 60 dakika inkübe edin. Zaman geçtikten sonra Calcein-AM içeren ortamı yavaşça PBS ile yıkayın ve yeni ortam ekleyin. Organoidleri gözlemlemek ve fotoğraflamak için 490 nm'lik bir uyarma dalga boyuna ve 515 nm'lik bir emisyon dalga boyuna sahip bir floresan mikroskobu kullanın. Canlı organoidler yeşil görünecek ve net kenarlara sahip olacaktır. Çapı >20 μm olan organoidleri sayın.
S: Organoidlerin yaşayabilirliği nasıl hesaplanır?
Organoidlerin yaşayabilirliği şu formüle göre hesaplanır: X=(Nlive/Ntotal)×100%, burada: X organoidlerin yaşayabilirliğini temsil eder; Nlive yaşayan organoid sayısını temsil eder; Ntotal toplam organoid sayısını temsil eder.
S: Organoidleri tanımlama yöntemleri nelerdir?
En temel yöntem, organoidlerin morfolojisini bir mikroskopla gözlemlemek ve H&E boyama yapmaktır. Diğer yöntemler arasında organoidlerin karşılık gelen biyobelirteçleri ifade edip etmediğini tespit etmek için Western Blot, qRT-PCR, immüno floresan, akış sitometrisi bulunur. Genetik dizileme, kültürlenmiş organoidler ile kaynak doku arasındaki genetik eşleşmeyi belirleyebilir. Bazı organoidler için, belirli işlevlere sahip olup olmadıklarını görmek için işlevsel testler yapılabilir. Örneğin, çalışmalar gastrik organoidlerin gastrik asit salgılayabildiğini ve kardiyak organoidlerin otonom olarak atabildiğini göstermiştir.
S: Normal hücreler de organoidlere dönüşebilir mi? Tümör organoidi yetiştirilirken normal organoidler nasıl çıkarılır?
Normal hücreler de organoidlere dönüşebilir. Normal organoidleri çıkarma yöntemleri şunları içerir: (1) Bir mikroskop altında HE boyama sonuçlarına dayalı manuel seçim; (2) Kültür ortamının bileşimini ayarlayarak PDO'ların saflaştırılması (büyüme faktörleri/küçük molekül inhibitörleri gibi); (3) Akış sitometrisi veya manyetik boncuk ayırma için PDO'ların tek hücrelere dağıtılması.
S: İlaç duyarlılığı deneyleri sırasında PDO'lar matris jelden sindirilmeli midir?
Hayır, PDO'ların in vivo koşullarını simüle etmek için üç boyutlu bir yapıya ihtiyacı vardır. Matris jelinden destek yoksa, ilaç duyarlılığı deneylerinin doğruluğu etkilenecektir. Genellikle, çözünür ilaçlar organoidler üzerinde etki etmek için matris jeline nüfuz edebilir, ancak immünositokimyasal deneyler yürütürken matris jelini çıkarmak gerekir.
S: PDO deneyleri hayvan modelleri (PDX)'nin yerini tamamen alabilir mi?
PDO'lar PDX'in yerini kısmen alabilirler ancak tamamen alamazlar.
S: Kültür ortamında PDO’ların anormal büyümesinin, önceki koşullara göre kısalan büyüme döngüleri ve hızlı çoğalma ile karakterize olmasının nedenleri neler olabilir?
Dış etkenler: (1) Bu anormallik, fibroblastlar gibi belirli kirletici hücrelerin yaygın büyümesinden kaynaklanabilir. Bu gibi durumlarda, bu kirletici hücrelerin varlığını doğrulamak için kesit boyama ve gözlem yapılması ve ardından bunların çıkarılması önerilir. (2) Belirli faktörlerin veya küçük moleküllerin eklenmesi de dahil olmak üzere kültür koşullarındaki değişiklikler, PDO'ların çoğalma yollarını daha da aktive edebilir.
İç faktörler: Olası genetik mutasyonlar. Bunu doğrulamak için dizileme önerilir ve sonuçlar, herhangi bir genetik mutasyon olup olmadığını belirlemek için birincil PDO'ların sonuçlarıyla karşılaştırılmalıdır.
S: PDO’ların ilaçlara duyarlılığı nasıl test edilebilir?
PDO'lar, CCK8 testi, ATP hücre canlılığı testi ve canlı/ölü boyama gibi yöntemler kullanılarak ilaç duyarlılığı açısından test edilebilir. Tümör organoidlerinin ATP aktivitesini değerlendirmek en yaygın yöntemdir. ATP, hücrelerdeki en önemli enerji molekülüdür ve canlı hücre sayısını yansıtan hücresel metabolik seviyeleri ölçmek için kullanılabilir. İlaç uygulamasının hücresel ATP içeriği üzerindeki etkisine dayanarak, her ilaç rejimi için IC50 değeri (test edilen ilacın yarı-maksimum inhibitör konsantrasyonu) tümör inhibisyonu için en etkili ilaçları seçmek üzere analiz yazılımı kullanılarak hesaplanabilir.
S: PDO'ların ilaç duyarlılığı deneylerindeki konsantrasyon aralıkları, birincil tümör hücreleriyle aynı mıdır?
Hayır, aynı değiller. Tipik olarak, PDO'lar için ilaç konsantrasyonunun birincil hücreler için olandan daha yüksek olması gerekir. Resmi ilaç duyarlılığı deneyleri için optimum konsantrasyonları analiz etmek üzere ön deneyler yapılabilir.
S: Organoidler büyümenin hangi aşamasında ilaç testi için kullanılmalıdır?
Genellikle ilaç testleri için 5 pasaj içindeki organoidlerin kullanılması önerilir. Bu aşamada organoidler en iyi stabilite ve aktiviteyi gösterir.
S: Organoid oluşumunun başarısını belirleyen kriterler nelerdir?
(1) Erken ön değerlendirme: Organoid morfolojisi hücresel bir durumdan vakuollü, tomurcuklanan, kompakt veya gevşek gibi formlara dönüşür. (2) Doku dilimlerindeki dağılıma benzer olması gereken spesifik biyobelirteç ifadesinin tanımlanması. Daha ayrıntılı karşılaştırmalar için daha fazla dizileme analizi yapılabilir.
S: Organoid kültürü, normal hücre kültüründen nasıl farklıdır?
(1) Farklı hücre kültürü yöntemleri: Organoidler üç boyutlu yapılarını korumak için substratların veya mekansal yapıların desteğine ihtiyaç duyarken, normal hücre kültürü buna ihtiyaç duymaz. (2) Organoid kültürü, ex vivo farklılaşma ve kendi kendine birleşmeyi gerektirir, bu nedenle indüksiyon için çeşitli sitokinlerin kombinasyonlarının kullanılmasını gerektirir ve bu da nispeten karmaşık kültür ortamı bileşenleriyle sonuçlanır. Normal hücre kültürü genellikle yalnızca tek bir hücre türünü içerir, bu nedenle kültür ortamı bileşenleri nispeten basittir.(3) Farklı hücre kaynakları: Organoidler çok potansiyelli epitel hücrelerinden türetilirken, düzenli hücre kültürü çeşitli seçilmiş hücre tiplerini yetiştirmek için uygundur.
S: Kültürünü yaptığım 3 boyutlu kürelerin organoid olup olmadığını ve hedef dokuyla uyumlu olup olmadığını nasıl belirleyebilirim?
Organoidleri tanımlama yöntemleri arasında H&E boyama, immünohistokimya (IHC), tek hücre dizilemesi ve diğerleri bulunur. Hedef organ veya dokuyla tutarlı olup olmadıklarını belirlemek için morfolojik, histopatolojik ve moleküler genetik perspektiflerden çok boyutlu yargılarda bulunmak gerekir. Tümör organoidleri için, doğrulama için belirli biyobelirteçlerin tespiti kullanılabilir.
S: Kültür sırasında gözlenen organoidlerin morfolojisi literatürde bildirilenlerden farklıysa bunun nedeni ne olabilir?
Öncelikle, örnek kaynaklar ve alt tiplerde bireysel farklılıklar ve heterojenlik olabilir. İkinci olarak, indüksiyon için kullanılan seçili sitokinlerin ve bazı küçük molekül inhibitörlerinin kalitesindeki farklılıklar, farklı organoidlerin farklılaşma morfolojisinde varyasyonlara yol açabilir. Sadece literatür açıklamalarına güvenmek yerine, organoid morfolojisi ile kaynak doku arasındaki tutarlılığın HE boyama, IHC ve genetik dizileme gibi yöntemlerle doğrulanması önerilir.
S: Organoidlerle ilaç duyarlılığı deneyleri yapılırken, ilaçlarda çözücü olarak kullanılan DMSO miktarının kontrol edilmesi gerekli midir?
Evet, genellikle ilaç duyarlılığı deneylerinde DMSO hacim yüzdesinin %0,5'ten az olması gerekir.
S: Organoidler matriks jelinden nasıl elde edilebilir?
Aşağıdaki yöntemler önerilmektedir: (1) Hücrelere veya hücre yüzey proteinlerine zarar vermeden hücre süspansiyonlarını nazikçe ve etkili bir şekilde elde etmek için ticari olarak temin edilebilen organoid kurtarma solüsyonları (CAT#41421ES) kullanılabilir. (2) Matris jeli, yumuşatmak ve organoidleri serbest bırakmak için düşük bir sıcaklıkta çözülebilir.
S: Kurtarma sırasında santrifüj tüpünün duvarlarına birçok organoid yapışıyor. Kurtarma oranı nasıl iyileştirilebilir?
Toplamadan sonra santrifüjleme yaparken yatay rotorlu santrifüj kullanın ve santrifüjleme hızını uygun şekilde artırın. Genellikle yaklaşık 300g'lık bir santrifüj kuvveti ve yaklaşık 1000-1200rpm'lik bir hız uygundur.
| Pürün Namin | KEDİ | Boyut |
| İnsan Wnt-3a | 92276ES10 | 10μG |
| 92278ES20 | 20μG | |
| 92701ES10 | 10μG | |
| İnsan Kafası | 92528ES10 | 10μG |
| 91330ES10 | 10μG | |
| 91306ES10 | 10μG | |
| 91502ES10 | 10μG | |
| 91701ES08 | 10μG | |
| 92602ES60 | 100μG | |
| 91204ES10 | 10μG | |
| 90601ES10 | 10μG | |
| 91113ES10 | 10μG | |
| 92279ES10 | 10μG | |
| 92055ES10 | 10μG | |
| 92053ES10 | 10μG | |
| 92129ES08 | 5μG | |
| 91304ES10 | 10μG | |
| 91702ES10 | 10μG | |
| 92252ES60 | 100μG | |
| 90103ES10 | 10μG | |
| 90104ES10 | 10μG | |
| 90197ES10 | 10μG | |
| 90144ES08 | 10μG | |
| 90196ES10 | 10μG | |
| 90194ES10 | 10μG | |
| 90111ES10 | 10μG | |
| 90120ES10 | 10μG | |
| 90198ES10 | 10μG | |
| 91605ES10 | 10μG | |
| 92251ES10 | 10μG | |
| 92566ES08 | 5μG | |
| 92102ES10 | 10μG | |
| 91103ES10 | 10μG | |
| 92711ES10 | 10μG | |
| 92122ES60 | 100μG | |
| 92201ES60 | 100μG | |
| 92275ES20 | 20μG | |
| İnsan BMP-2 | 92051ES10 | 10μG |
İlgili okumalar:
Referans
