随着类器官研究的不断深入,越来越多的人加入其中,本文总结了一些关于类器官的常见知识点[1-5],希望对大家有所帮助。
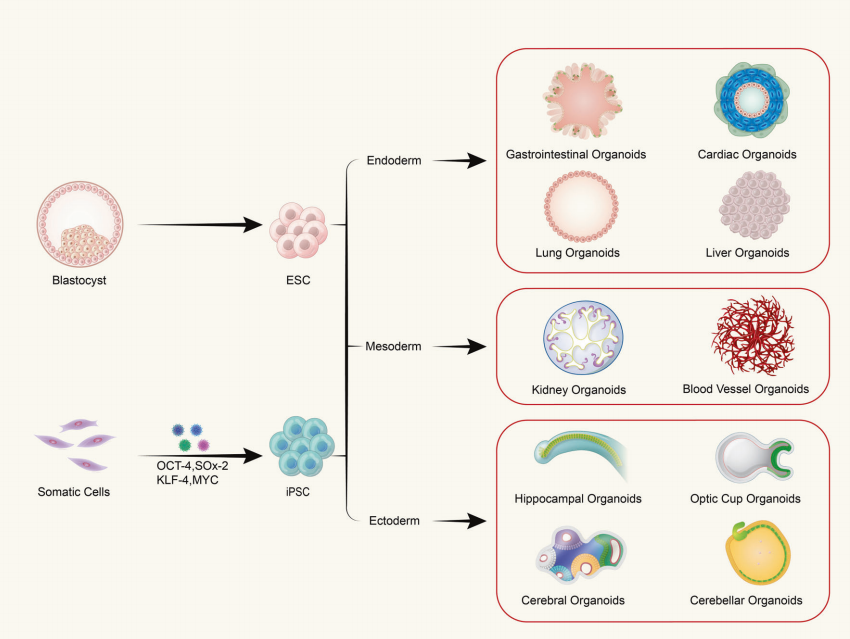
问:类器官是由单一类型的细胞还是多细胞组织组成?
类器官是由成体干细胞或多能干细胞在体外三维培养而形成的具有一定空间组织的类组织结构,它不是由单个细胞构成的结构,而是由具有干细胞特性的起始细胞经过诱导分裂分化,自组装成具有一定空间结构、形态和功能的类似于体内相应器官的组织。
问:培养类器官的来源有哪些?
(1)来源于多能干细胞的类器官包括成体干细胞(ASC)、多能干细胞(PSC)和诱导性多能干细胞(iPSC)。(2)来源于组织提取细胞的类器官常见于肿瘤组织中。
问:在没有新鲜组织的情况下,冷冻组织可以进行三维培养吗?
可以,但是对冷冻组织的尺寸要求较高,并且原代冷冻组织和细胞的活力会明显下降,导致后续培养的成功率大大降低。
问:如何冷冻和复苏类器官?
类器官冻存的最佳时间为2-5代,此时类器官的活性和分化潜能处于最佳状态。类器官的复苏可参照细胞复苏的方法。
问:培养的类器官的大小需要控制吗?太大是否有益?
是的,需要控制大小,最好在500μm以内,因为类器官内部缺乏血管和气液循环系统。当类器官体积较大时,靠近中心的细胞与外界环境交换氧气和营养物质会比较困难。因此,结构越大,死细胞越多。
问:除了使用基质凝胶外,还有什么可以用来培养类器官?
除了基质凝胶外,培养类器官的替代品包括(1)脱细胞的细胞外基质和其他衍生蛋白质,(2)合成水凝胶,和(3)工程重组蛋白质凝胶。
问:如何实现类器官的定向分化?
类器官中干细胞诱导分化的早期发展受到多种信号通路的共同调控。体外培养需要加入生长因子来模拟这些信号通路的活性,引导细胞向特定方向分化。例如,用Y27632和Activin A诱导可以将胚胎干细胞(ESC)或诱导性多能干细胞(iPSC)分化为胚状体(EB)。随后,信号通路通过Wnt3a、FGF-4和Noggin等因子调控,诱导干细胞向特定方向分化。
问:获取临床样本时如何避免污染?
(1)尽量保证无菌取样。(2)提取前先在含有抗生素的PBS中浸泡数分钟:对于位于可能与外界接触部位的肿瘤,如胃、肠、膀胱等,建议在含有3%-5%抗生素的PBS中浸泡5-10分钟;对于其他常见肿瘤,在含有1%-2%抗生素的PBS中浸泡约5分钟。(3)细胞提取过程中使用的所有试剂都应含有1%抗生素和适当浓度的主要抗生素。
问:肿瘤组织的采集、保存和运输应注意什么?
尽量采集肿瘤细胞含量较高的肿瘤组织,尽量减少组织样本暴露在空气中的时间,降低污染概率。将采集到的肿瘤组织样本尽快放入含有专用样本保存液的无菌管中,低温(4℃左右)快速运送至检测单位(争取取样后2~4小时内送达)。
问:从病变部位培养的类器官和从邻近组织培养的类器官有什么区别?
肿瘤组织取样部位有什么要求?是的,有区别。肿瘤本身表现出异质性,因此观察到来自不同来源的类器官之间存在差异是很常见的。从形态学上讲,来自原发性病变的类器官往往比来自邻近组织的类器官具有更具侵袭性的结构,通常看起来更不规则。为了最大限度地减少建模或药物筛选中的错误,应从活性良好的区域采集多个样本。
Q:哪些类型的药物可以用于肿瘤类器官的药敏测试?
临床上主要的抗肿瘤药物类型可分为三类:细胞毒药物(如紫杉醇、顺铂/卡铂、5-FU等)、靶向药物(针对EGFR、HER2、VEGFR等的药物)和以免疫检查点抑制剂(PD-1抗体、PD-L1抗体等)为代表的免疫治疗药物。
问:PDO培育的成功率是多少?
PDO培养的成功率因来源不同而略有差异,大部分PDO的成功率在63%-70%之间,甚至更高,可达90%,这与组织本身的活性有很大关系,另外临床治疗也会影响成功率,可通过减少组织离体时间和操作步骤来提高成功率。
问:冷冻组织可以用于类器官培养吗?
一般不建议冷冻保存组织,因为这样会严重损害其活力。但如果将组织保存在-80°C 下,则类器官培养的最佳时间窗口为保存后 6 周内。如果将组织保存在液氮中,保存时间可以更长,但最好不要超过六个月。
Q:提取原代细胞时,通常会有成纤维细胞混入,该如何处理?
(1)由于成纤维细胞粘连性较差,可通过反复粘连将其去除。(2)可以使用成纤维细胞去除试剂,但是否影响类器官培养仍需实验验证。
问:培养肿瘤类器官需要多少原始肿瘤组织?活检样本足够吗?
一般而言,手术组织应大于2-3个黄豆大小;若通过针吸活检获取组织,至少需要2-3个样本,而内镜活检则至少需要夹取6个以上的肿瘤组织。
Q:如果肿瘤组织样本太少,培养出的类器官数量不足以进行后续检测,该怎么办?
由于肿瘤来源的类器官在传代后可能会出现表型差异,因此一般不建议进行传代。文献中建议类器官传代限制在2-3代,最多5代。如果细胞数量太少,5代后仍不能满足检测要求,可以考虑更换检测方式,比如换用更小的384孔板或者尝试微流控芯片进行检测。
问:肿瘤组织里会有正常细胞吗?如何去除这些正常细胞?
正常细胞数量可能较少,首先采集时尽量避免取样正常组织;其次,提取原代细胞后,可采用磁珠分选或流式细胞仪进行类器官的进一步培养。当正常细胞数量极少时,不会对后续的类器官建模和培养产生明显影响,因此可以不去除。
问:从肿瘤组织中提取原代细胞时,为什么细胞呈现红色?
体内组织血液供应丰富,红细胞较多,多数情况下不需要处理,不影响类器官培养,若红细胞过多,可适当用裂解液处理后再培养。
问:类器官培养过程中发现黑色颗粒,如何去除?
黑色颗粒很可能是杂质或细胞碎片。它们可以通过两种方式去除:
消化类器官并用培养基反复清洗以稀释杂质。
使用无菌手术刀将类器官切成两半,然后使用装有培养基的 1ml 注射器轻轻冲洗出类器官中的杂质。
Q:类器官培养的传代次数有限制吗,可以进行多少次传代?
传代次数通常取决于源细胞的特性。大多数类器官可在体外传代多达 10 次(>6 个月)。培养条件的选择也可能产生一定影响,条件培养基通常优于合成因子培养基。
问:肿瘤细胞系(例如 HepG2 细胞系)可以培养成 PDO 吗?
PDOs是一种复杂的自组装结构,由单个细胞系形成的3D培养体系不能称为PDOs,而只能称为3D球形状态。
问: 类器官的传代标准是什么?
根据类器官的发育状态,时间不尽相同,一般为5-10天,直径约100-200μm。有些发育较慢的类器官可能需要数周才能达到合适的传代状态。
问:如何计数活体类器官的数量?
实验过程中取出预先配制的Calcein-AM保存液,加入Calcein-AM溶液至终浓度为0.2μmol/L,37℃孵育60分钟,时间到后用PBS慢慢洗去含Calcein-AM的培养基,加入新鲜培养基,用激发波长490nm,发射波长515nm的荧光显微镜观察并拍照,活体类器官呈绿色,边缘清晰,计数直径>20μm的类器官。
问:如何计算类器官的活力?
类器官活力的计算公式为:X=(Nlive/Ntotal)×100%,其中:X代表类器官活力;Nlive代表活类器官数量;Ntotal代表类器官总数。
问: 鉴别类器官的方法有哪些?
最基本的方法是通过显微镜观察类器官的形态,并进行H&E染色。进一步的方法包括Western Blot、qRT-PCR、免疫荧光、流式细胞术等,以检测类器官是否表达相应的生物标志物。基因测序可以确定培养的类器官与来源组织的基因匹配情况。对于一些类器官,可以进行功能测试,了解它们是否具有特定的功能。例如,研究表明胃类器官可以分泌胃酸,心脏类器官可以自主跳动。
Q:正常细胞也能长成类器官吗?肿瘤类器官培养过程中如何去除正常类器官?
正常细胞也能长成类器官,去除正常类器官的方法包括:(1)显微镜下根据HE染色结果进行人工筛选;(2)通过调节培养基成分(如生长因子/小分子抑制剂)纯化PDO;(3)将PDO分散成单细胞后进行流式细胞术或磁珠分选。
问:在药物敏感性实验中,是否应该将PDO从基质凝胶中消化掉?
不是,PDO需要三维结构来模拟体内情况,如果没有基质胶的支撑,药敏实验的准确性会受到影响。一般可溶性药物可以穿透基质胶作用于类器官,但进行免疫细胞化学实验时,需要去除基质胶。
问:PDO实验能完全取代动物模型(PDX)吗?
PDO可以部分替代PDX,但不能完全替代。
问:PDO在培养过程中生长异常的原因可能是什么,与之前的情况相比,其生长周期缩短、增殖速度加快?
外部因素: (1)该异常可能是由于某些污染细胞(如成纤维细胞)大量生长所致,此时建议进行切片染色观察,确认污染细胞存在后进行去除。(2)培养条件的改变,包括加入某些因子或小分子,可进一步激活PDOs的增殖途径。
内部因素: 可能存在基因突变。为了验证这一点,建议进行测序,并将结果与原始 PDO 的结果进行比较,以确定是否存在任何基因突变。
问:如何测试PDO对药物的敏感性?
PDOs的药敏试验可以采用CCK8实验、ATP细胞活力试验、活/死染色等方法进行。评估肿瘤类器官的ATP活性是最常见的方法。ATP是细胞中最重要的能量分子,可以用来衡量细胞代谢水平,反映活细胞的数量。根据给药对细胞ATP含量的影响,可以用分析软件计算出每种给药方案的IC50值(受试药物的半数最大抑菌浓度),从而筛选出对肿瘤抑制最有效的药物。
:PDO的药敏实验浓度范围和原代肿瘤细胞的浓度范围相同吗?
不一样,一般PDO的药物浓度要高于原代细胞,可以先做初步实验,分析最佳浓度,再进行正式的药敏实验。
问:类器官应在哪个生长阶段用于药物测试?
一般建议使用5代以内的类器官进行药物测试,此阶段的类器官稳定性和活性最好。
问:判断类器官建立成功的标准是什么?
(1)早期初步评估:类器官形态由细胞状态转变为液泡、芽殖、致密或松散等形态。 (2)识别特定生物标志物的表达,其应与组织切片中的分布相似。 可进行进一步的测序分析以进行更详细的比较。
问:类器官培养与常规细胞培养有何不同?
(1)细胞培养方式不同:类器官需要基底或空间结构的支持才能维持其三维结构,而常规细胞培养则不需要。 (2)类器官培养需要实现体外分化和自组装,因此需要使用多种细胞因子的组合进行诱导,培养基成分相对复杂。 常规细胞培养通常只涉及单一类型的细胞,因此培养基成分相对简单。(3)细胞来源不同:类器官来源于多能上皮细胞,而常规细胞培养适合培养各类选定的细胞。
问:我如何确定我培养的 3D 球体是否是类器官,以及它们是否与目标组织一致?
类器官的鉴别方法包括H&E染色、免疫组织化学(IHC)、单细胞测序等,需从形态学、组织病理学、分子遗传学等多维度判断是否符合目标器官或组织,对于肿瘤类器官,可通过检测特异性生物标志物进行确认。
问:如果在培养过程中观察到的类器官的形态与文献报道的不同,其原因是什么?
首先,样本来源、亚型可能存在个体差异和异质性;其次,诱导所选用的细胞因子和一些小分子抑制剂的质量差异,可能导致不同类器官的分化形态存在差异。建议通过HE染色、IHC、基因测序等方法确认类器官形态与来源组织的一致性,而不能单纯依赖文献描述。
Q:用类器官进行药敏实验时,是否需要控制作为药物溶剂的DMSO的量?
是的,一般药敏实验要求DMSO的体积百分比小于0.5%。
问:如何从基质凝胶中回收类器官?
推荐使用以下方法:(1)可使用市售的类器官恢复溶液(CAT#41421ES),温和有效地获得细胞悬浮液,且不损伤细胞或细胞表面蛋白。(2)可在低温下解冻基质凝胶,使其软化并释放类器官。
问:回收过程中,很多类器官粘附在离心管壁上。如何提高回收率?
采集后离心时,采用水平转子离心机,适当提高离心转速,一般离心力在300g左右,转速在1000-1200rpm左右为宜。
| 磷产品 否英文 | 猫 | 尺寸 |
| 人类Wnt-3a | 92276ES10 | 10μ克 |
| 92278ES20 | 20μ克 | |
| 92701ES10 | 10μ克 | |
| 人类的头脑 | 92528ES10 | 10μ克 |
| 91330ES10 | 10μ克 | |
| 91306ES10 | 10μ克 | |
| 91502ES10 | 10μ克 | |
| 91701ES08 | 10μ克 | |
| 92602ES60 | 100μ克 | |
| 91204ES10 | 10μ克 | |
| 90601ES10 | 10μ克 | |
| 91113ES10 | 10μ克 | |
| 92279ES10 | 10μ克 | |
| 92055ES10 | 10μ克 | |
| 92053ES10 | 10μ克 | |
| 92129ES08 | 5μ克 | |
| 91304ES10 | 10μ克 | |
| 91702ES10 | 10μ克 | |
| 92252ES60 | 100μ克 | |
| 90103ES10 | 10μ克 | |
| 90104ES10 | 10μ克 | |
| 90197ES10 | 10μ克 | |
| 90144ES08 | 10μ克 | |
| 90196ES10 | 10μ克 | |
| 90194ES10 | 10μ克 | |
| 90111ES10 | 10μ克 | |
| 90120ES10 | 10μ克 | |
| 90198ES10 | 10μ克 | |
| 91605ES10 | 10μ克 | |
| 92251ES10 | 10μ克 | |
| 92566ES08 | 5μ克 | |
| 92102ES10 | 10μ克 | |
| 91103ES10 | 10μ克 | |
| 92711ES10 | 10μ克 | |
| 92122ES60 | 100μ克 | |
| 92201ES60 | 100μ克 | |
| 92275ES20 | 20μ克 | |
| 人类BMP-2 | 92051ES10 | 10μ克 |
相关阅读:
参考
