Yeasen Biotechnologys kommercielle HCP-reagenssæt er en enkel, meget følsom og objektiv metode til HCP-detektion. Yeasen Biotechnology har uafhængigt udviklet flere reagenssæt, som følsomt kan detektere resterende HCP-niveauer i prøver. Disse reagenssæt kan bruges til at optimere rensningsprocessen af biofarmaceutiske produkter, kontrollere urenheder i mellemliggende processer og frigive test af slutprodukter. Vil du vide mere om, hvordan Yeasen Biotechnologys HCP-reagenssæt kan forbedre din biofarmaceutiske produktion? Læse artiklen nu!

Koncept og nødvendighed af HCP-detektion
Biologiske produkter fremstilles typisk ved hjælp af rekombinant teknologi i værtsceller (såsom bakterier, gær-, pattedyr-, insekt- eller planteceller), herunder monoklonale antistoffer, rekombinante proteiner og vacciner. Fremstillings- og oprensningsprocesserne for disse produkter introducerer uundgåeligt værtscelleproteiner (HCP'er) som urenheder, som omfatter både strukturelle proteiner i værtscellerne og vækstfaktorer, der udskilles af værtscellerne, og danner en kompleks blanding med forskellige fysisk-kemiske og immunologiske egenskaber. På trods af brugen af avancerede oprensningsteknikker kan nogle værtscelleproteiner stadig forblive som procesrelaterede urenheder i mellemlægemiddelprodukter.
Disse urenheder har potentiel immunogenicitet og kan forstærke det immunogene respons af biofarmaceutiske produkter, hvilket påvirker deres stabilitet og effektivitet og derved udgøre en risiko for menneskers sikkerhed. Derfor skal der etableres passende overvågningsstrategier for fjernelse af HCP'er, og indholdet af HCP'er i det endelige produkt skal kontrolleres for at opfylde kravene til lægemiddelkvalitet.
Regulatoriske krav til HCP'er
Restindholdet af HCP'er i biologiske produkter betragtes generelt som en kritisk kvalitetsegenskab (CQA) for produktet, et vigtigt evalueringsindeks for overvågning af proces robusthed og et nøglekvalitetskontrolindeks for produktet. Regulerende myndigheder i forskellige lande har bestemmelser vedrørende HCP'er, der kræver analyse og oprensning af biofarmaceutiske midler for at reducere værtscelleprotein-HCP'er til acceptable niveauer. Acceptniveauet for HCP'er vil blive vurderet baseret på specifikke omstændigheder og afhænger af flere faktorer, herunder dosis, doseringshyppighed, lægemiddeltype og sygdommens sværhedsgrad.
Den kinesiske farmakopé (2020-udgave) bestemmer: For CHO-celler skal den resterende HCP være <0,05 % (svarende til mindre end 500 ppm); for E. coli skal den resterende HCP være <0,01 %.
United States Pharmacopeia USP <1132> kapitlet specificerer: En meget følsom metode bør anvendes til at påvise HCP'er i lægemidler, og indholdet skal være under detektionsgrænsen (normalt mindre end 100 ppm, dvs. HCP-indholdet i 1 mg totalt protein skal være mindre end 100 ng eller <0,01%).
Den europæiske farmakopé EP 2.6.34 specificerer: I biologiske produkter bør indholdet af HCP'er være mindre end 0,1 %.
Retningslinjer for den internationale konference om harmonisering af tekniske krav til registrering af lægemidler til human brug (ICH): ICH Q6B angiver, at følsomme og validerede metoder bør anvendes til at overvåge resterende HCP'er, hvor restmængden typisk kræves til at være mindre end 100 ppm.
Det kan ses, at tilsynsmyndigheder har meget konsistente krav til HCP'er. Procesudviklingen af biologiske produkter skal gennemgå HCP-detektion, demonstrere, at oprensningsprocessen kan reducere HCP'er til sikre niveauer, og de anbefalede grænser for restindhold i slutproduktet er under 0,01% i både Kina og USA.
HCP-detektionsmetoder
Enzyme-Linked Immunosorbent Assay (ELISA) er i øjeblikket den mest almindeligt anvendte metode til HCP-detektion. Metoderne til påvisning af værtsproteinrester nævnt i kapitel 3412/3413/3414 i 2020-udgaven af den kinesiske farmakopé er alle ELISA-metoder.
United States Pharmacopeia USP <1132>-kapitlet nævner også, at metoder som elektroforese, ELISA og LC-MS/MS kan bruges til at detektere HCP-indhold, og ELISA anbefales som den foretrukne metode til HCP-detektion på grund af dens lette betjening, hastighed, høje følsomhed og høje gennemløb.
ELISA:
Formål: Detekterer den samlede mængde af proteiner i HCP'er, kan bruges til produktudvikling og proceskontrol, og er i øjeblikket en almindelig metode til påvisning af HCP'er.
Fordele: Høj følsomhed og specificitet; Høj gennemstrømning og automatiseringsevne; Kvantitativ; Nem og hurtig betjening.
Ulemper: Kræver specifikke antistoffer; Kan ikke specifikt identificere og evaluere individuelle HCP'er; Metodeudvikling er kompleks og kræver speciel antigenforberedelse; Mange influerende faktorer for metoden, HCP-dækning skal evalueres; Kan ikke identificere arter.

Western Blotting:
Formål: Anvendes til konsekvent screening af et stort antal prøver og påvisning af ukendte proteiner, der reagerer med anti-HCP-antistoffer. Velegnet til at detektere HCP'er og give omtrentlige oplysninger om den relative molekylvægt af HCP'er.
Fordele: Specificitet; Resultaterne er visuelt intuitive: visualiserer forskelle i proteinstørrelse og ekspressionsniveauer; Kan detektere og kvantificere specifikke HCP'er.
Ulemper: Semi-kvantitativ; Begrænset til specifikke proteiner: kan kun påvise HCP'er bundet til antistoffer; Ikke følsom nok til komplekse proteinblandinger; Protein SDS-denaturering kan føre til tab af konformationelle epitoper; Følsomhed afhænger af kvaliteten af polyklonale antistoffer.
Todimensionel gelelektroforese (2-DE):

Formål: Almindeligvis brugt til upstream eller downstream procesudvikling og karakterisering, kan det skelne forskellige HCP'er på en enkelt gel.
Fordele: Intet behov for Western blotting, undgå overførselsproblemer; Kan adskille spormængder af HCP-urenheder fra produktet; Giver omtrentlige oplysninger om relativ molekylvægt og isoelektrisk punkt.
Ulemper: For meget protein kan maskere HCP-pletter; Fordelingen af HCP'er i prøven kan observeres, men kan ikke kvantificeres.

Massespektrometrianalyse:
Formål: Identificerer individuelle HCP'er og giver nøjagtige identifikations- og kvantificeringsoplysninger for værtscelleproteiner.
Fordele: Høj opløsning og nøjagtighed; Identificerer og overvåger individuelle HCP'er; Giver omfattende spektre af HCP'er; Kan dække en bred vifte af proteiner; Kan identificere HCP-arter.
Ulemper: Højt udstyr og tekniske krav; Kompleks operation; høje omkostninger; Lav metodegennemstrømning; Kompleks prøveforbehandling; Potentielle matrixeffekter; Kræver specialiserede dataanalysefunktioner.
ELISA er den anbefalede metode til påvisning af resterende HCP'er i biologiske produkter ved farmakopéer i forskellige lande, som er i stand til at bestemme den samlede mængde af HCP'er. Det har dog begrænsninger med hensyn til at identificere typer og mængder af HCP'er og skal suppleres med andre metoder. Hver detektionsmetode har sine fordele og ulemper, og i praktiske anvendelser kan udvælgelse foretages baseret på eksperimentelle formål, prøvekarakteristika, nøjagtighed og betjeningskomfort, blandt andre faktorer, kombineret med brugen af forskellige metoder for at opnå mere omfattende og præcise resultater.
Derudover US Pharmacopeia USP <1132> og European Pharmacopoeia EP 2.6.34. VÆRTCELLE PROTEINASSAYS indikerer, at forskellige ELISA-reagenser bør bruges til HCP-detektion på forskellige stadier af produktudviklingen, idet HCP-detektionsmetoderne kategoriseres i kommercielle reagenser, produkt-/processpecifikke metoder og platformsmetoder.
USP <1132> nævner, at i mangel af platformsmetoder kan kommercielle reagenser anvendes i prækliniske, fase I og fase II kliniske forsøg; i fase III kliniske forsøg/procesvalidering og post-marketing produkt, på grund af begrænsninger såsom utilstrækkelig antistofdækning af kommercielle generelle HCP-detektionsreagenser, bør der tages hensyn til faktorer såsom celletype og processpecificitet ved brug af platformsmetoder eller produkt-/processpecifikke metoder til opstrøms procesudvikling.
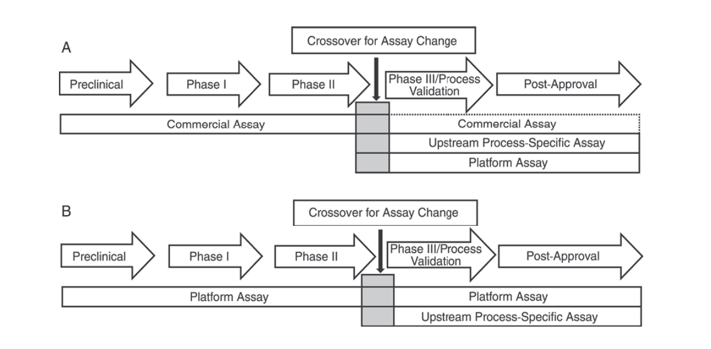
Figur 1. I USP <1132> foreslås forskellige stadier af produktudvikling at bruge specifikke metoder til påvisning af HCP'er.
| Metode | Kommercielt reagenssæt | Produkt/Proces-specifik detektion Kit | Platform detektion Kit |
| Tilgængelighed | Let tilgængelig
| Kræver fremstilling af antigener, herunder kloning af værtscellelinjer
| Kræver fremstilling af antigener ved brug af nøgne eller tomme vektorcellelinjer
|
| Udvikling | Kræver minimal forberedelse | Detektionsudvikling inklusive antigenkarakterisering, immunisering og bekræftelse tager typisk mindst 6 måneder | Detektionsudvikling inklusive antigenkarakterisering, immunisering og bekræftelse tager typisk mindst 9 måneder |
| Mangfoldighed | Begrænset til de mest almindelige udtrykssystemer | Forskellige typer ekspressionssystemer kan anvendes | Forskellige typer ekspressionssystemer kan anvendes |
| Specificitet | Specificiteten kan være dårlig med potentielle uopdagede HCP'er
| Specificiteten er normalt forbedret med antistofdækning rettet mod specifikke HCP-mønstre | Sammenlignet med kommercielle detektionsmetoder er specificiteten forbedret, forståelsen af detektionsydelsen forbedret, og dækningen af HCP-typer er også øget |
| Koste | Startpriserne er relativt billige, men udviklingsomkostningerne vil hurtigt stige for hele nedstrømsrensningsprocessen | Startomkostningerne er højere, men breakeven-punktet er typisk på værdien af 100 sæt reagenssæt | På grund af dets anvendelighed på flere produkter har det betydelige omkostningsfordele |
| Afhængighed | Afhængig af en specifik leverandør er reagenser og kontrolskemaer i en "sort boks". | Har omfattende kontrol over alle reagenser og buffere, kan justeres til enhver tid | Har fuldstændig ejerskab og kontrol over alle reagenser, hvilket reducerer risici i forsyningskæden og batch-sammenlignelighed |
| Regulatoriske krav | Ikke egnet til at understøtte markedsføring ansøgninger om tilladelse | Anvendelig til at understøtte hele processen fra tidlig udvikling til markedsføring af licenserede produkter | Gælder for at understøtte tidlig udvikling indtil markedsføringstilladelse |
Tabel 1.Sammenligning af forskellige HCP-reagenssættyper
Yeasen Biotech Customized HCP Assay Development Service
I betragtning af betydningen af HCP-detektion, Yeasen Biotech er afhængig af en højtydende monoklonalt antistofudviklingsplatform til at etablere proteinantistofkritiske råmaterialeudviklingsplatforme og et uafhængigt laboratorium til immundetektionsproduktudvikling udstyret med avancerede forskningsinstrumenter såsom enzymimmunoassay-analysatorer og 2D-WB tovejs gelelektroforese-immunoblotting-systemer. Udviklingsplatformen er meget moden og i stand til hurtigt at tilpasse HCP-assay-kits til forskellige værtscellerester, herunder pattedyrsceller, insektceller (såsom Sf9), bakterier og gær.
Tidslinje for tilpasning
Tilpasningstjenesten for værtscelle-rester-proteindetektionskit tager typisk 6 til 10 måneder.
Antigen-antistof-forberedelse: Bestemmelse af HCP-antigener, etablering af HCP-referencestandarder, udformning af immunveje og -strategier, forberedelse af HCP-antistoffer osv. tager typisk 4 til 6 måneder.
Analysekitudvikling: Antistofoptimering, dækningsanalyse, validering af analysekitmetode osv. tager typisk 2 til 4 måneder.
Yeasen Biotech HCP Antibody Coverage Verification Service
Det er kendt, at ELISA er guldstandarden til påvisning af resterende HCP i industrien, men nøjagtigheden af denne metode afhænger af dækningen af multi-klon antistoffer mod HCP. United States Pharmacopeia og European Pharmacopeia nævner immunoprensning og 2D-WB som anbefalede metoder til karakterisering af HCP ELISA-antistoffer og deres dækning.
HCP-antistofdækning Verifikation Service
2D-WB adskiller først proteiner baseret på størrelse og ladning ved hjælp af todimensionel gelelektroforese og overfører derefter disse proteiner til en membran til inkubation med HCP-antistoffer til påvisning af proteinaftryk.
Vi har et komplet sæt 2D-WB-instrumentering og omfattende laboratorieerfaring til at levere antistofdækningsverifikationstjenester til HCP-prøver fra værtsceller såsom CHO, E.coli, HEK293 osv.
Relateret produkt:
| Produkt | Katalog nr. | Størrelse |
| 36712ES | 48T/96T | |
| 36713ES | 48T/96T | |
| CHO HCP ELISA kit (CHO-K1) | 36714ES | 48T/96T |
| E.coli HCP ELISA Kit (plasmid) | 36721ES | 48T/96T |
