El kit de reactivos HCP comercial de Yeasen Biotechnology es un método simple, altamente sensible y objetivo para la detección de HCP. Yeasen Biotechnology ha desarrollado de forma independiente múltiples kits de reactivos, que pueden detectar con sensibilidad los niveles residuales de HCP en las muestras. Estos kits de reactivos se pueden utilizar para optimizar el proceso de purificación de productos biofarmacéuticos, controlar las impurezas en los procesos intermedios y liberar las pruebas de los productos finales. ¿Quiere obtener más información sobre cómo los kits de reactivos HCP de Yeasen Biotechnology pueden mejorar su producción biofarmacéutica? Lea ¡el articulo ahora!

Concepto y necesidad de la detección de HCP
Los productos biológicos se producen típicamente utilizando tecnología recombinante en células huésped (como bacterias, levaduras, células de mamíferos, insectos o plantas), incluyendo anticuerpos monoclonales, proteínas recombinantes y vacunas. Los procesos de fabricación y purificación de estos productos inevitablemente introducen proteínas de células huésped (HCP) como impurezas, que incluyen tanto proteínas estructurales de las células huésped como factores de crecimiento secretados por las células huésped, formando una mezcla compleja con diversas propiedades fisicoquímicas e inmunológicas. A pesar del uso de técnicas avanzadas de purificación, algunas proteínas de células huésped pueden permanecer todavía como impurezas relacionadas con el proceso en productos farmacéuticos intermedios.
Estas impurezas tienen potencial inmunogenicidad y pueden mejorar la respuesta inmunogénica de los productos biofarmacéuticos, afectando su estabilidad y eficacia, lo que plantea riesgos para la seguridad humana. Por lo tanto, es necesario establecer estrategias de control adecuadas para la eliminación de HCP y controlar el contenido de HCP en el producto final para cumplir con los requisitos de calidad del medicamento.
Requisitos reglamentarios para profesionales sanitarios
El contenido residual de HCP en productos biológicos se considera generalmente un atributo crítico de calidad (CQA) del producto, un índice de evaluación importante para el monitoreo de la solidez del proceso y un índice clave de control de calidad del producto. Las autoridades regulatorias en varios países tienen disposiciones con respecto a los HCP, que requieren el análisis y la purificación de productos biofarmacéuticos para reducir los HCP de las proteínas de la célula huésped a niveles aceptables. El nivel de aceptación de los HCP se evaluará en función de circunstancias específicas y depende de varios factores, incluida la dosis, la frecuencia de dosificación, el tipo de fármaco y la gravedad de la enfermedad.
La Farmacopea China (edición 2020) estipula: Para las células CHO, el HCP residual debe ser <0,05 % (equivalente a menos de 500 ppm); para E. coli, el HCP residual debe ser <0,01 %.
El capítulo USP <1132> de la Farmacopea de los Estados Unidos especifica: Se debe utilizar un método altamente sensible para detectar HCP en medicamentos, y el contenido debe estar por debajo del límite de detección (generalmente menos de 100 ppm, es decir, el contenido de HCP en 1 mg de proteína total debe ser menor a 100 ng, o <0,01%).
La Farmacopea Europea EP 2.6.34 especifica: En los productos biológicos, el contenido de HCP debe ser inferior al 0,1%.
Las directrices de la Conferencia Internacional sobre Armonización de Requisitos Técnicos para el Registro de Productos Farmacéuticos de Uso Humano (ICH): ICH Q6B establece que se deben adoptar métodos sensibles y validados para monitorear los HCP residuales, y que la cantidad residual normalmente debe ser inferior a 100 ppm.
Se puede observar que las agencias reguladoras tienen requisitos muy consistentes para los HCP. El proceso de desarrollo de productos biológicos debe pasar por la detección de HCP, demostrar que el proceso de purificación puede reducir los HCP a niveles seguros y los límites recomendados para el contenido residual en el producto final son inferiores al 0,01 % tanto en China como en los Estados Unidos.
Métodos de detección de HCP
El ensayo inmunoabsorbente ligado a enzimas (ELISA) es actualmente el método más utilizado para la detección de HCP. Los métodos de detección de residuos de proteínas del huésped mencionados en los capítulos 3412/3413/3414 de la edición 2020 de la Farmacopea china son todos métodos ELISA.
El capítulo USP <1132> de la Farmacopea de los Estados Unidos también menciona que se pueden utilizar métodos como electroforesis, ELISA y LC-MS/MS para detectar el contenido de HCP, y se recomienda ELISA como el método preferido para la detección de HCP debido a su facilidad de operación, velocidad, alta sensibilidad y alto rendimiento.
Prueba ELISA:
Objetivo: Detecta la cantidad total de proteínas en HCP, se puede utilizar para el desarrollo de productos y el control de procesos y actualmente es un método común para detectar HCP.
Ventajas: Alta sensibilidad y especificidad; Alto rendimiento y capacidad de automatización; Cuantitativo; Operación fácil y rápida.
Desventajas: Requiere anticuerpos específicos; No puede identificar y evaluar específicamente a HCP individuales; El desarrollo del método es complejo y requiere una preparación especial de antígeno; Hay muchos factores que influyen en el método; Es necesario evaluar la cobertura de HCP; No se pueden identificar especies.

Western Blot:
Objetivo: Se utiliza para el cribado sistemático de grandes cantidades de muestras y la detección de proteínas desconocidas que reaccionan con anticuerpos anti-HCP. Adecuado para detectar HCP y proporcionar información aproximada sobre el peso molecular relativo de los HCP.
Ventajas: Especificidad; Los resultados son visualmente intuitivos: visualiza las diferencias en el tamaño de las proteínas y los niveles de expresión; Puede detectar y cuantificar HCP específicos.
Desventajas: Semicuantitativo; Limitado a proteínas específicas: solo puede detectar HCP unidos a anticuerpos; No es lo suficientemente sensible para mezclas de proteínas complejas; La desnaturalización de proteínas por SDS puede provocar la pérdida de epítopos conformacionales; La sensibilidad depende de la calidad de los anticuerpos policlonales.
Electroforesis en gel bidimensional (2-DE):

Objetivo: Se utiliza comúnmente para el desarrollo y caracterización de procesos ascendentes o descendentes, y puede distinguir diferentes HCP en un solo gel.
Ventajas: No necesita Western blot, lo que evita problemas de transferencia; puede separar trazas de impurezas de HCP del producto; proporciona información aproximada sobre el peso molecular relativo y el punto isoeléctrico.
Desventajas: El exceso de proteína puede enmascarar manchas de HCP; la distribución de HCP en la muestra se puede observar, pero no se puede cuantificar.

Análisis de espectrometría de masas:
Objetivo: Identifica HCP individuales, proporcionando información precisa de identificación y cuantificación de proteínas de la célula huésped.
Ventajas: Alta resolución y precisión; Identifica y monitorea HCP individuales; Proporciona espectros completos de HCP; Puede cubrir una amplia gama de proteínas; Puede identificar especies de HCP.
Desventajas: Altos requerimientos técnicos y de equipamiento; Operación compleja; Alto costo; Bajo rendimiento del método; Pretratamiento complejo de la muestra; Posibles efectos de matriz; Requiere capacidades especializadas de análisis de datos.
El método ELISA es el método recomendado por las farmacopeas de varios países para detectar HCP residuales en productos biológicos, capaz de determinar la cantidad total de HCP. Sin embargo, tiene limitaciones para identificar los tipos y abundancias de HCP y necesita ser complementado con otros métodos. Cada método de detección tiene sus ventajas y desventajas, y en aplicaciones prácticas, la selección puede hacerse en función de los propósitos experimentales, las características de la muestra, la precisión y la conveniencia operativa, entre otros factores, combinados con el uso de diferentes métodos para obtener resultados más completos y precisos.
Además, la Farmacopea de los Estados Unidos USP <1132> y la Farmacopea Europea EP 2.6.34. ENSAYOS DE PROTEÍNAS DE CÉLULAS HUÉSPED indican que se deben utilizar diferentes reactivos ELISA para la detección de HCP en diferentes etapas del desarrollo del producto, categorizando los métodos de detección de HCP en reactivos comerciales, métodos específicos del producto/proceso y métodos de plataforma.
La USP <1132> menciona que, en ausencia de métodos de plataforma, se pueden utilizar reactivos comerciales en ensayos clínicos preclínicos, de Fase I y de Fase II; en ensayos clínicos de Fase III/validación de procesos y productos posteriores a la comercialización, debido a limitaciones como la cobertura de anticuerpos insuficiente de los reactivos comerciales de detección general de HCP, se deben considerar factores como el tipo de célula y la especificidad del proceso, utilizando métodos de plataforma o métodos específicos del producto/proceso para el desarrollo del proceso previo.
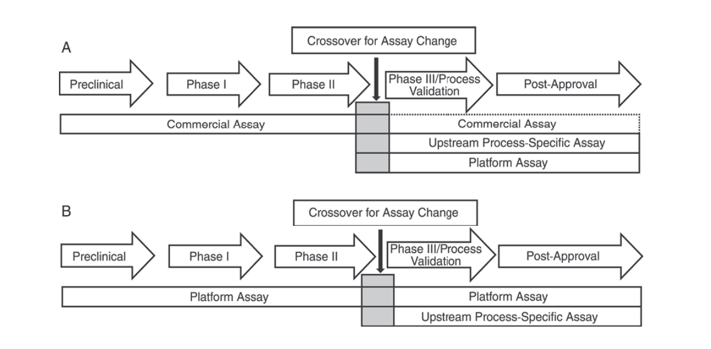
Figura 1. En la USP <1132> se sugiere que en diferentes etapas del desarrollo del producto se utilicen métodos específicos para detectar HCP.
| Método | Kit de reactivos comerciales | Detección específica de productos y procesos Equipo | Detección de plataforma Equipo |
| Disponibilidad | Fácilmente disponible
| Requiere la preparación de antígenos, incluida la clonación de líneas de células huésped.
| Requiere la preparación de antígenos utilizando líneas celulares de vectores desnudos o vacíos.
|
| Desarrollo | Requiere una preparación mínima | El desarrollo de la detección, que incluye la caracterización del antígeno, la inmunización y la confirmación, generalmente demora al menos seis meses. | El desarrollo de la detección, que incluye la caracterización del antígeno, la inmunización y la confirmación, generalmente demora al menos 9 meses. |
| Diversidad | Limitado a los sistemas de expresión más comunes | Se pueden utilizar varios tipos de sistemas de expresión. | Se pueden utilizar varios tipos de sistemas de expresión. |
| Especificidad | La especificidad puede ser deficiente y puede haber posibles HCP no detectados
| La especificidad suele mejorarse, con una cobertura de anticuerpos dirigida a patrones HCP específicos. | En comparación con los métodos de detección comerciales, se mejora la especificidad, se mejora la comprensión del rendimiento de la detección y también aumenta la cobertura de los tipos de HCP. |
| Costo | Los precios iniciales son relativamente baratos, pero los costos de desarrollo aumentarán rápidamente para todo el proceso de purificación posterior. | Los costos iniciales son más altos, pero el punto de equilibrio suele estar en el valor de 100 juegos de kits de reactivos. | Debido a su aplicabilidad a múltiples productos, tiene importantes ventajas en términos de costo. |
| Dependencia | Dependiendo de un proveedor específico, los reactivos y los esquemas de control se encuentran en un estado de "caja negra". | Tiene un control integral sobre todos los reactivos y tampones, se puede ajustar en cualquier momento | Tiene propiedad y control completos sobre todos los reactivos, lo que reduce los riesgos en la cadena de suministro y la comparabilidad de lotes. |
| Requisitos reglamentarios | No apto para apoyar marketing. solicitudes de autorización | Aplicable para respaldar todo el proceso desde el desarrollo inicial hasta la comercialización de productos con licencia. | Aplicable para apoyar el desarrollo temprano hasta la autorización de comercialización. |
Tabla 1.Comparación de diferentes tipos de kits de reactivos HCP
Servicio de desarrollo de ensayos HCP personalizados de Yeasen Biotech
Dada la importancia de la detección de HCP, Yeasen Biotech se apoya en una plataforma de desarrollo de anticuerpos monoclonales de alto rendimiento para establecer plataformas de desarrollo de materia prima crítica para anticuerpos proteicos y un laboratorio independiente para el desarrollo de productos de detección inmunológica, equipado con instrumentos de investigación avanzados, como analizadores de inmunoensayo enzimático y sistemas de electroforesis en gel bidireccional 2D-WB-inmunotransferencia. La plataforma de desarrollo es altamente madura y capaz de personalizar rápidamente los kits de ensayo HCP para diversos residuos de células huésped, incluidas células de mamíferos, células de insectos (como Sf9), bacterias y levaduras.
Cronología de personalización
El servicio de personalización de los kits de detección de proteínas de residuos de células huésped suele tardar entre 6 y 10 meses.
Preparación de antígenos y anticuerpos: la determinación de antígenos HCP, el establecimiento de estándares de referencia HCP, el diseño de vías y estrategias inmunes, la preparación de anticuerpos HCP, etc., generalmente demora entre 4 y 6 meses.
Desarrollo del kit de ensayo: la optimización de anticuerpos, el análisis de cobertura, la validación del método del kit de ensayo, etc., generalmente demoran entre 2 y 4 meses.
Yeasen Servicio de verificación de la cobertura de anticuerpos de profesionales sanitarios de biotecnología
Se sabe que la prueba ELISA es el método de referencia para detectar HCP residual en la industria, pero la precisión de este método depende de la cobertura de anticuerpos multiclonales contra HCP. La Farmacopea de los Estados Unidos y la Farmacopea Europea mencionan la inmunopurificación y la prueba WB 2D como métodos recomendados para caracterizar los anticuerpos ELISA contra HCP y su cobertura.
Cobertura de anticuerpos del HCP Verificación Servicio
2D-WB primero separa las proteínas según su tamaño y carga mediante electroforesis en gel bidimensional, luego transfiere estas proteínas a una membrana para su incubación con anticuerpos HCP para la detección de la impronta proteica.
Nosotros cuenta con un conjunto completo de instrumentación 2D-WB y una amplia experiencia de laboratorio para brindar servicios de verificación de cobertura de anticuerpos para muestras de HCP de células huésped como CHO, E. coli, HEK293, etc.
Producto relacionado:
| Producto | N.º de catálogo | Tamaño |
| 36712ES | 48 dientes/96 dientes | |
| Kit ELISA para el diagnóstico de la hepatitis C (HCP) HEK293 | 36713ES | 48 dientes/96 dientes |
| Kit ELISA para HCP de CHO (CHO-K1) | 36714ES | 48 dientes/96 dientes |
| Kit ELISA para E. coli HCP (plásmido) | 36721ES | 48 dientes/96 dientes |
