Il kit reagente HCP commerciale di Yeasen Biotechnology è un metodo semplice, altamente sensibile e oggettivo per il rilevamento di HCP. Yeasen Biotechnology ha sviluppato in modo indipendente più kit reagenti, in grado di rilevare in modo sensibile i livelli residui di HCP nei campioni. Questi kit reagenti possono essere utilizzati per ottimizzare il processo di purificazione dei prodotti biofarmaceutici, controllare le impurità nei processi intermedi e rilasciare i test dei prodotti finali. Vuoi saperne di più su come i kit reagenti HCP di Yeasen Biotechnology possono migliorare la tua produzione biofarmaceutica? Leggi l'articolo adesso!

Concetto e necessità del rilevamento HCP
I prodotti biologici sono in genere prodotti utilizzando la tecnologia ricombinante in cellule ospiti (come batteri, lieviti, cellule di mammiferi, insetti o piante), inclusi anticorpi monoclonali, proteine ricombinanti e vaccini. I processi di produzione e purificazione di questi prodotti introducono inevitabilmente proteine delle cellule ospiti (HCP) come impurità, che includono sia proteine strutturali delle cellule ospiti sia fattori di crescita secreti dalle cellule ospiti, formando una miscela complessa con varie proprietà fisico-chimiche e immunologiche. Nonostante l'uso di tecniche di purificazione avanzate, alcune proteine delle cellule ospiti possono comunque rimanere come impurità correlate al processo nei prodotti farmaceutici intermedi.
Queste impurità hanno potenziale immunogenicità e possono aumentare la risposta immunogenica dei prodotti biofarmaceutici, influenzandone la stabilità e l'efficacia, ponendo così rischi per la sicurezza umana. Pertanto, devono essere stabilite strategie di monitoraggio appropriate per la rimozione degli HCP e il contenuto di HCP nel prodotto finale deve essere controllato per soddisfare i requisiti di qualità del farmaco.
Requisiti normativi per gli operatori sanitari
Il contenuto residuo di HCP nei prodotti biologici è generalmente considerato un attributo di qualità critico (CQA) del prodotto, un importante indice di valutazione per il monitoraggio della robustezza del processo e un indice di controllo qualità chiave del prodotto. Le autorità di regolamentazione in vari paesi hanno disposizioni riguardanti gli HCP, che richiedono l'analisi e la purificazione dei biofarmaci per ridurre gli HCP delle proteine delle cellule ospiti a livelli accettabili. Il livello di accettazione degli HCP sarà valutato in base a circostanze specifiche e dipende da diversi fattori, tra cui dose, frequenza di dosaggio, tipo di farmaco e gravità della malattia.
La Farmacopea cinese (edizione 2020) stabilisce: per le cellule CHO, l'HCP residuo deve essere <0,05% (equivalente a meno di 500 ppm); per l'E. coli, l'HCP residuo deve essere <0,01%.
Il capitolo <1132> della Farmacopea degli Stati Uniti specifica: Per rilevare gli HCP nei farmaci deve essere utilizzato un metodo altamente sensibile e il contenuto deve essere al di sotto del limite di rilevamento (solitamente inferiore a 100 ppm, ovvero il contenuto di HCP in 1 mg di proteine totali deve essere inferiore a 100 ng, o <0,01%).
La Farmacopea Europea EP 2.6.34 specifica: Nei prodotti biologici, il contenuto di HCP deve essere inferiore allo 0,1%.
Le linee guida della Conferenza internazionale sull'armonizzazione dei requisiti tecnici per la registrazione dei prodotti farmaceutici per uso umano (ICH): ICH Q6B afferma che devono essere adottati metodi sensibili e convalidati per monitorare gli operatori sanitari residui, con una quantità residua solitamente inferiore a 100 ppm.
Si può notare che le agenzie di regolamentazione hanno requisiti altamente coerenti per gli HCP. Lo sviluppo del processo di prodotti biologici deve essere sottoposto a rilevamento degli HCP, dimostrare che il processo di purificazione può ridurre gli HCP a livelli sicuri e i limiti raccomandati per il contenuto residuo nel prodotto finale sono inferiori allo 0,01% sia in Cina che negli Stati Uniti.
Metodi di rilevamento HCP
L'Enzyme-Linked Immunosorbent Assay (ELISA) è attualmente il metodo più comunemente utilizzato per la rilevazione di HCP. I metodi di rilevazione dei residui proteici dell'ospite menzionati nei capitoli 3412/3413/3414 dell'edizione 2020 della Farmacopea cinese sono tutti metodi ELISA.
Il capitolo USP <1132> della Farmacopea degli Stati Uniti menziona anche che metodi quali elettroforesi, ELISA e LC-MS/MS possono essere utilizzati per rilevare il contenuto di HCP, e l'ELISA è raccomandato come metodo preferito per il rilevamento di HCP grazie alla sua semplicità di utilizzo, velocità, elevata sensibilità ed elevata produttività.
ELISA:
Scopo: Rileva la quantità totale di proteine negli operatori sanitari, può essere utilizzato per lo sviluppo di prodotti e il controllo dei processi ed è attualmente un metodo comune per il rilevamento degli operatori sanitari.
Vantaggi: Elevata sensibilità e specificità; Elevata produttività e capacità di automazione; Quantitativo; Funzionamento semplice e veloce.
Svantaggi: Richiede anticorpi specifici; Non è possibile identificare e valutare specificamente i singoli operatori sanitari; Lo sviluppo del metodo è complesso e richiede una speciale preparazione dell'antigene; Molti fattori influenzano il metodo; è necessario valutare la copertura degli operatori sanitari; Non è possibile identificare le specie.

Western Blotting:
Scopo: Utilizzato per lo screening coerente di grandi numeri di campioni e per rilevare proteine sconosciute che reagiscono con anticorpi anti-HCP. Adatto per rilevare HCP e fornire informazioni approssimative sul peso molecolare relativo degli HCP.
Vantaggi: Specificità; I risultati sono visivamente intuitivi: visualizzano le differenze nelle dimensioni delle proteine e nei livelli di espressione; possono rilevare e quantificare specifici operatori sanitari.
Svantaggi: Semiquantitativo; Limitato a proteine specifiche: può rilevare solo gli HCP legati agli anticorpi; Non abbastanza sensibile per miscele proteiche complesse; La denaturazione delle proteine SDS può portare alla perdita di epitopi conformazionali; La sensibilità dipende dalla qualità degli anticorpi policlonali.
Elettroforesi su gel bidimensionale (2-DE):

Scopo: Comunemente utilizzato per lo sviluppo e la caratterizzazione dei processi a monte o a valle, è in grado di distinguere diversi HCP su un singolo gel.
Vantaggi: Non necessita di Western blotting, evitando problemi di trasferimento; Può separare tracce di impurità HCP dal prodotto; Fornisce informazioni approssimative sul peso molecolare relativo e sul punto isoelettrico.
Svantaggi: Un eccesso di proteine può mascherare i punti HCP; la distribuzione degli HCP nel campione può essere osservata, ma non quantificata.

Analisi spettrometrica di massa:
Scopo: Identifica i singoli operatori sanitari, fornendo informazioni accurate sull'identificazione e la quantificazione delle proteine delle cellule ospiti.
Vantaggi: Elevata risoluzione e accuratezza; Identifica e monitora i singoli operatori sanitari; Fornisce spettri completi degli operatori sanitari; Può coprire un'ampia gamma di proteine; Può identificare le specie di operatori sanitari.
Svantaggi: Elevati requisiti tecnici e di equipaggiamento; funzionamento complesso; costi elevati; bassa produttività del metodo; pretrattamento complesso del campione; potenziali effetti matrice; richiede capacità specializzate di analisi dei dati.
ELISA è il metodo raccomandato per rilevare HCP residui nei prodotti biologici dalle farmacopee in vari paesi, in grado di determinare la quantità totale di HCP. Tuttavia, presenta delle limitazioni nell'identificazione dei tipi e delle abbondanze di HCP e deve essere integrato con altri metodi. Ogni metodo di rilevamento ha i suoi vantaggi e svantaggi e, nelle applicazioni pratiche, la selezione può essere effettuata in base a scopi sperimentali, caratteristiche del campione, accuratezza e praticità operativa, tra gli altri fattori, combinati con l'uso di metodi diversi per ottenere risultati più completi e accurati.
Inoltre, la Farmacopea degli Stati Uniti USP <1132> e la Farmacopea europea EP 2.6.34. SAGGI PROTEICI DELLE CELLULE OSPITI indicano che devono essere utilizzati reagenti ELISA diversi per il rilevamento degli operatori sanitari nelle diverse fasi dello sviluppo del prodotto, classificando i metodi di rilevamento degli operatori sanitari in reagenti commerciali, metodi specifici per prodotto/processo e metodi di piattaforma.
La norma USP <1132> menziona che, in assenza di metodi di piattaforma, i reagenti commerciali possono essere utilizzati negli studi clinici preclinici, di fase I e di fase II; negli studi clinici di fase III/validazione del processo e nel prodotto post-marketing, a causa di limitazioni quali una copertura anticorpale insufficiente dei reagenti di rilevamento HCP generali commerciali, si dovrebbe prendere in considerazione fattori quali il tipo di cellula e la specificità del processo, utilizzando metodi di piattaforma o metodi specifici del prodotto/processo per lo sviluppo del processo a monte.
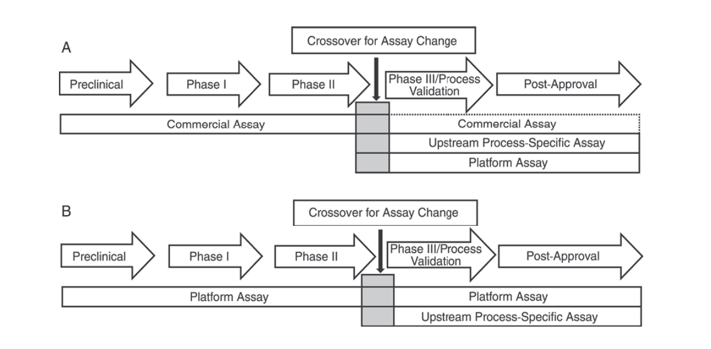
Figura 1. Nella USP <1132>, si suggerisce di utilizzare metodi specifici per rilevare gli operatori sanitari nelle diverse fasi di sviluppo del prodotto.
| Metodo | Kit reagente commerciale | Rilevamento specifico del prodotto/processo Kit | Rilevamento della piattaforma Kit |
| Disponibilità | Disponibile subito
| Richiede la preparazione di antigeni, inclusa la clonazione di linee cellulari ospiti
| Richiede la preparazione di antigeni utilizzando linee cellulari vettoriali nude o vuote
|
| Sviluppo | Richiede una preparazione minima | Lo sviluppo del rilevamento, inclusa la caratterizzazione dell'antigene, l'immunizzazione e la conferma, richiede in genere almeno 6 mesi | Lo sviluppo del rilevamento, inclusa la caratterizzazione dell'antigene, l'immunizzazione e la conferma, richiede in genere almeno 9 mesi |
| Diversità | Limitato ai sistemi di espressione più comuni | Possono essere utilizzati vari tipi di sistemi di espressione | Possono essere utilizzati vari tipi di sistemi di espressione |
| Specificità | La specificità potrebbe essere scarsa, con potenziali operatori sanitari non rilevati
| La specificità è solitamente migliorata, con la copertura anticorpale mirata a specifici modelli di HCP | Rispetto ai metodi di rilevamento commerciali, la specificità è migliorata, la comprensione delle prestazioni di rilevamento è migliorata e anche la copertura dei tipi di HCP è aumentata |
| Costo | I prezzi iniziali sono relativamente economici, ma i costi di sviluppo aumenteranno rapidamente per l'intero processo di purificazione a valle | I costi iniziali sono più elevati, ma il punto di pareggio è in genere pari al valore di 100 set di kit di reagenti | Grazie alla sua applicabilità a più prodotti, presenta notevoli vantaggi in termini di costi |
| Dipendenza | A seconda del fornitore specifico, i reagenti e gli schemi di controllo si trovano in uno stato di "scatola nera". | Ha un controllo completo su tutti i reagenti e i tamponi, può essere regolato in qualsiasi momento | Ha la proprietà e il controllo completi su tutti i reagenti, riducendo i rischi nella catena di fornitura e nella comparabilità dei lotti |
| Requisiti normativi | Non adatto a supportare il marketing domande di autorizzazione | Applicabile per supportare l'intero processo dallo sviluppo iniziale alla commercializzazione di prodotti con licenza | Applicabile per supportare lo sviluppo iniziale fino all'autorizzazione all'immissione in commercio |
Tabella 1.Confronto tra diversi tipi di kit reagenti HCP
Servizio di sviluppo di test HCP personalizzato di Yeasen Biotech
Data l'importanza del rilevamento HCP, Sììì Biotech si affida a una piattaforma di sviluppo di anticorpi monoclonali ad alte prestazioni per stabilire piattaforme di sviluppo di materie prime critiche per anticorpi proteici e un laboratorio indipendente per lo sviluppo di prodotti di rilevamento immunitario, dotato di strumenti di ricerca avanzati come analizzatori di immunoanalisi enzimatica e sistemi di elettroforesi su gel bidirezionale 2D-WB-immunoblotting. La piattaforma di sviluppo è altamente matura e in grado di personalizzare rapidamente i kit di analisi HCP per vari residui di cellule ospiti, tra cui cellule di mammiferi, cellule di insetti (come Sf9), batteri e lieviti.
Cronologia di personalizzazione
Il servizio di personalizzazione dei kit di rilevamento delle proteine residue nelle cellule ospiti richiede in genere dai 6 ai 10 mesi.
Preparazione di antigeni e anticorpi: la determinazione degli antigeni HCP, la definizione degli standard di riferimento HCP, l'elaborazione di percorsi e strategie immunitarie, la preparazione degli anticorpi HCP, ecc., richiede in genere dai 4 ai 6 mesi.
Sviluppo del kit di analisi: l'ottimizzazione degli anticorpi, l'analisi della copertura, la convalida del metodo del kit di analisi, ecc., richiedono in genere dai 2 ai 4 mesi.
Sììì Servizio di verifica della copertura degli anticorpi HCP Biotech
È noto che l'ELISA è il gold standard per la rilevazione di HCP residuo nel settore, ma l'accuratezza di questo metodo dipende dalla copertura di anticorpi multi-clone per HCP. La Farmacopea degli Stati Uniti e la Farmacopea Europea menzionano l'immunopurificazione e il 2D-WB come metodi raccomandati per caratterizzare gli anticorpi ELISA HCP e la loro copertura.
Copertura anticorpale HCP Verifica Servizio
La tecnica 2D-WB separa innanzitutto le proteine in base alle dimensioni e alla carica mediante elettroforesi su gel bidimensionale, quindi trasferisce queste proteine su una membrana per l'incubazione con anticorpi HCP per il rilevamento dell'impronta proteica.
Noi dispone di un set completo di strumentazione 2D-WB e di una vasta esperienza di laboratorio per fornire servizi di verifica della copertura anticorpale per campioni HCP da cellule ospiti come CHO, E. coli, HEK293, ecc.
Prodotto correlato:
| Prodotto | Numero di catalogo | Misurare |
| 36712ES | 48T/96T | |
| 36713ES | 48T/96T | |
| Kit ELISA CHO HCP (CHO-K1) | 36714ES | 48T/96T |
| Kit ELISA E.coli HCP (plasmide) | 36721ES | 48T/96T |
