デキストラン硫酸ナトリウム(DSS)を使用した潰瘍性大腸炎子豚モデルのプロトコル
腸管透過性亢進はIBDの病因の一つであり、小腸および大腸の損傷の重症度を評価するためのバイオマーカーとして使用することができます。腸管透過性は、陰窩絨毛軸全体に沿って吸収される不活性な小炭水化物分子であるD-マンニトールを使用して生体内で評価されました[1] 。

図1. 子豚
1. モデル構築
2. 結果
3. このリソースへのリンク
4.
5. 商品の注文
6. 当社の試薬を使用した論文
7. 読書を尊重する
1. モデル構築
1.1 動物モデル
生後4~5日のヨークシャー豚の子豚
1.2 材質
DSS(イェーセン#60316ES、MW36000-50000)
1.3 プロトコル
a) ヨークシャー種の子豚は、12時間の明暗サイクルが制御された室内のゴム引き床の金属製囲いに個別に飼育されました。室温は26℃に維持され、加熱ランプが補充されました。
b) 子豚には、自由摂取量と同程度の市販のミルク代替配合飼料を1日3回与えた。
c) 動物に外科的に胃内カテーテルを装着しました。カテーテルはシリコンパッチ(約 8×12 mm)に固定され、さらに胃壁に縫合され、胃腔内に約 30 mm 挿入されました。各動物には、カテーテルの外側部分を一時的に保管するための背部ポケットが付いた特注のベストを着用させました。
d) 動物は陽性対照群(Pos)、陰性対照群(Neg)、実験群(Trp)に分けられました。
e) 陽性対照群 (Pos): 灌流 DSS(5 日間) + 生理食塩水(5 日間); 陰性対照群 (Neg): 生理食塩水で灌流(10 日間); 実験群 (Trp): 注入 DSS(5 日間) + 治療薬(5 日間);
f) DSS投与量:1.25g/kg、5日間経口摂取。
g) 終了時点で、動物は吸入麻酔薬イソフルランによって鎮静され、エタノール(ペントバルビタール)0.3 ml/kg体重(BW)の心臓内注射によって安楽死させられました。
h) 結腸組織は、0.1 mM フェニルメチルスルホニルフルオリド (PMSF) を含む冷生理食塩水 (154 mM、pH7.4) で直ちに洗浄され、組織学検査のために採取されるか、またはその後の分析のために液体窒素で急速凍結されました。
2. 結果
2.1 腸管透過性分析
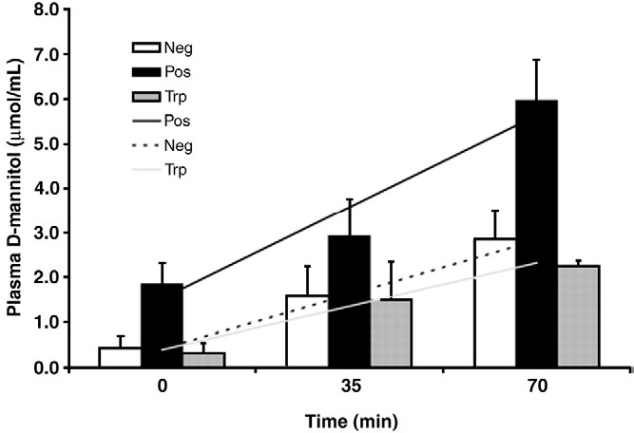
図2. 子豚のDSS誘発D-マンニトール濃度は対照群よりも高かった
子豚におけるDSS誘発D-マンニトール濃度は増加し、腸管バリアが破壊されました。
2.2 H&E病理染色切片
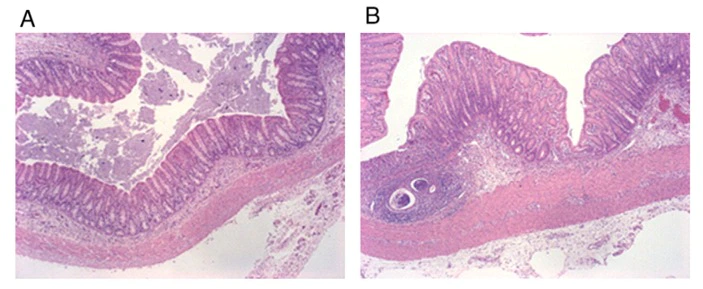
図3. H&E病理染色切片(A:陰性群、B:陽性群)
結腸の炎症の重症度は、炎症スコアと組織学的測定によって評価されました。DSS で治療した Pos グループでは、陥凹構造が歪み、粘膜と粘膜下層に炎症細胞が浸潤し、陥凹膿瘍と陥凹炎症が見られました。
2.3 炎症因子の検出
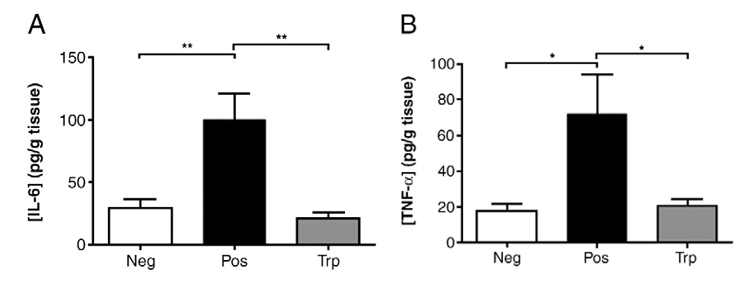
図4. 炎症因子の検出
DSSを投与したPos群では2つのサイトカインの濃度が増加した[1] 。
3. このリソースへのリンク
[1]コニー・J・キム、他栄養生化学ジャーナル21(2010)468-475。
4. Yeasen DSSによるモデリングの成功事例
表1 DSSによる様々なタイプの腸炎モデルの構築
|
モデル |
モデリングサンプル |
モデリング計画 |
モデリング結果 |
使用評価 |
|
急性大腸炎 |
BALB/cマウス、メス、6~8週、25g |
3%-5% DSSを7日間連続で自由に飲む |
5日目には結腸の長さが短くなり、HE染色で炎症が明らかになった。 |
成形速度が速く、時間が短い。急性大腸炎モデルの特性と一致している |
|
C57BL/6マウス、雄、8週、20g |
経口投与による3%-5% DSS、継続投与 |
5日目に、結腸の短縮、体重減少、便中の血、下痢が起こります。 |
高いカビ率と短い持続期間。急性大腸炎モデルの特徴と一致している。 |
|
|
慢性大腸炎 |
C57BL/6 マウス、オス、8 週、22 g |
経口投与による1~2%DSS、持続投与 |
40日目、結腸短縮、体重減少、便に血が混じる、下痢 |
高い成形率。慢性大腸炎モデルの特性と一致している。 |
|
大腸がん |
C57BL/6 マウス、オス、8 週、21 g |
1%-2% DSSを3週間にわたり5日間自由に摂取 |
14週目、結腸の長さが短くなり、体重が減少し、HE染色が見られ、明らかな炎症がみられました。 |
高い成形率。大腸がんモデルの特性と一致している |
5. 商品の注文
売れ筋商品はM*の1/3の価格で同等の効能があり、在庫も豊富です。
表2. 製品の順序
| 製品名 | 猫NO. | サイズ |
| 大腸炎モデル用デキストラン硫酸ナトリウム MW: 36000~50000 | 60316ES25 | 25グラム |
| 60316ES60 | 100グラム | |
| 60316ES76 | 500グラム | |
| 60316ES80 | 1kg |
6. 当社の試薬を使用した論文
[1]Li Zhao、Fei Wang、Zhengwei Cai、et al.潰瘍性大腸炎の治療のための注射可能な粘膜付着性ハイドロゲルによる薬物利用プラットフォームの改善[J]。化学工学ジャーナル。424(2021)130464。IF = 16.744
[2]Lingjun Tong、Haining Hao、Zhe Zhang、et al.ミルク由来の細胞外小胞は腸管免疫を調節し、腸内細菌叢を再形成することで潰瘍性大腸炎を緩和する[J]。Theranostics.2021; 11(17): 8570-8586 IF=11.556
[3]Li, Y., Dong, J., Xiao, H., Zhang, S., Wang, B., Cui, M., & Fan, S.腸内常在菌由来の吉草酸は放射線障害から保護する。腸内微生物、2020 .1–18.IF=10.245
[4]Jingjing Gan、Yuxiao Liu、Lingyu Sun、et al.炎症性腸疾患治療のためのマイクロ流体からの経口投与ヌクレオチド送達粒子[J]。Applied Materials Today.2021年12月;25:101231 IF=10.041
[5]Mengmeng Xu、Ying Kong、Nannan Chen、et al.活動性潰瘍性大腸炎における免疫関連遺伝子シグネチャーの同定とCeRNAネットワークの予測[J].Frontiers in Immunology.2022; 13: 855645. IF=7.561
[6]JialiDong、YuanLi、HuiwenXiao、et al.口腔内微生物叢はマウスモデルにおける大腸癌の放射線治療の有効性と予後に影響を及ぼす[J].Cell reports.2021, 109886.IF=9.423
[7]Hao H、Zhang X、Tong L、Liu Q、et al.Lactobacillus plantarumQ7由来の細胞外小胞のマウスの腸内細菌叢と潰瘍性大腸炎への影響[J].Frontiers in Immunology.2021.777147 .IF=7.561
[8]Yaohua Fan、Yanqun Fan、Kunfeng Liu、et al.食用ツバメの巣はTh17/Treg細胞バランスを回復させることでC57BL/6Jマウスのデキストラン硫酸ナトリウム誘発性潰瘍性大腸炎を軽減する[J].Frontiers in Pharmacology.2021.632602.IF=7.561
[9]Jia-Rong Huang、Sheng-Te Wang、Meng-Ning Wei、et al.Piperlongumineはマウス大腸炎および大腸炎関連大腸癌を緩和する[J].Frontiers in Pharmacology.2020.586885.IF=7.561
[10]Gao X、Fan W、Tan L、et al。大豆イソフラボンはERα/NLRP3インフラマソーム経路を標的にして実験的大腸炎を改善する[J]。栄養生化学ジャーナル、2020年、83.IF = 6.048
[11]Lujuan Xing、Lijuan Fu、Songmin Cao、et al.LPS誘導RAW264.7マクロファージ細胞およびデキストラン硫酸ナトリウム誘導C57BL/6マウスにおけるウシ骨ゼラチン由来ペプチドの抗炎症効果[J]。Nutrients 2022、14、1479。IF=5.717
[12] Wang S、Huang J、Tan KS、et al.イソステビオールナトリウムは代謝プロファイリング、マクロファージ分極、NF-B経路の調節を介してデキストラン硫酸ナトリウム誘発性慢性大腸炎を軽減する[J]。酸化医学と細胞長寿命。2022、4636618。IF = 5.076
7. 読書を尊重する
デキストラン硫酸ナトリウム(DSS)潰瘍性大腸炎モデルの確立
アゾキシメタン(AOM)とデキストラン硫酸ナトリウム(DSS)誘発大腸炎関連癌モデルの確立
デキストラン硫酸ナトリウム(DSS)を使用した潰瘍性大腸炎のショウジョウバエモデリングのプロトコル
