デキストラン硫酸ナトリウム(DSS 35000〜50000)、大腸炎グレードを使用した潰瘍性大腸炎ゼブラフィッシュモデリングのプロトコル
ゼブラフィッシュDanio rerioを腸管損傷のモデルとして使用することは確立されており、デキストラン硫酸ナトリウム(DSS)誘導ゼブラフィッシュIBDモデルは、腸管における好中球性炎症、過剰な粘液産生、腸管リンパ管新生の増加、炎症誘発性サイトカインおよびマーカーccl20、il1β、il23、il8、mmp9、tnf-αの上方制御など、哺乳類IBD表現型のさまざまな特徴を模倣しています[1] 。

図1. ゼブラフィッシュ
1. モデル構築
2. 結果
3. このリソースへのリンク
4.
5. 商品の注文
6. 当社の試薬を使用した論文
7. 読書を尊重する
1. モデル構築
1.1 動物モデル
3dpf(受精後日数)ゼブラフィッシュ
1.2 材質
DSS(
1.3 プロトコル
ゼブラフィッシュの胚は自然産卵により得られ、受精後1日目(dpf)まで、循環水(60 μg/mLインスタント海洋海塩)中で28.5℃のインキュベーター内で育てられ、受精後1日目までメチレンブルーが補充されました。
1 dpf 以降はメチレンブルーを含まない E3 胚培養培地を使用して 3 dpf まで培養します。
E3培地で10% DSS保存溶液を調製します。
DSS を培養培地で最大非致死量まで希釈します (DSS 濃度基準: 0.5%)。
ゼブラフィッシュは 3 dpf から 6 dpf まで 0.5% DSS で処理され、指標が観察されました。
2. 結果
モデリングの成功指標:好中球数の増加、酸性ムチンの増加、炎症因子の発現の増加。
好中球数:好中球数が増加し、腸管および上皮に移動しました。
酸性粘液タンパク質:パラフィン病理切片とAB-PAS染色法により、ゼブラフィッシュの腸内の酸性粘液タンパク質がDSS浸漬後に増加したことが確認されました。
炎症因子の発現:ゼブラフィッシュ腸管における炎症因子の発現はDSS処理後に増加した[1,2] 。
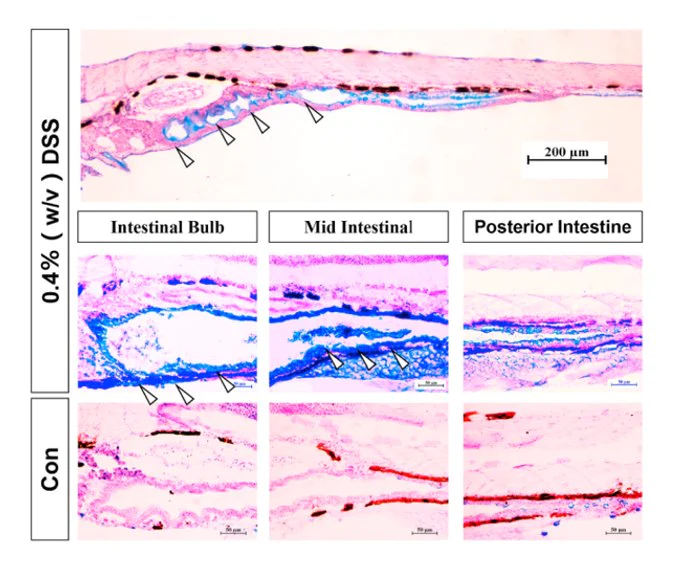
図2.
3. このリソースへのリンク
[1]Jing Ma、et al. Aquaculture and Fisheries (2021) 548–557.
[2]オーラーズ SH、他。ディスモデルメカ。 2012 年 7 月;5(4):457-67。
4. Yeasen DSSによるモデリングの成功事例
表1. DSSによるさまざまなタイプの腸炎モデルの構築
|
モデル |
モデリングサンプル |
モデリング計画 |
モデリング結果 |
使用評価 |
|
急性大腸炎 |
BALB/cマウス、メス、6~8週、25g |
3%-5% DSSを7日間連続で自由に飲む |
5日目に現れ、結腸の長さが短くなり、HE染色で炎症が明らかになった |
成形速度が速く、時間が短い。急性大腸炎モデルの特性と一致している。 |
|
C57BL/6マウス、雄、8週、20g |
経口投与による3%-5% DSS、継続投与 |
5日目に、結腸の短縮、体重減少、便中の血、下痢が起こります。 |
高いカビ率と短い持続期間。急性大腸炎モデルの特徴と一致している。 |
|
|
慢性大腸炎 |
C57BL/6 マウス、オス、8 週、22 g |
経口投与による1~2%DSS、持続投与 |
40日目、結腸短縮、体重減少、便に血が混じる、下痢 |
高い成形率。慢性大腸炎モデルの特性と一致している。 |
|
大腸がん |
C57BL/6 マウス、オス、8 週、21 g |
1%-2% DSSを3週間にわたり5日間自由に摂取 |
14週目、結腸の長さが短くなり、体重が減少し、HE染色が見られ、明らかな炎症がみられました。 |
高い成形率。大腸癌モデルの特性と一致している。 |
5. 商品の注文
売れ筋商品はM*の1/3の価格で同等の効能があり、在庫も豊富です。
表2. 製品の順序
|
製品名 |
記事番号 |
仕様 |
|
60316ES25/60/76/80 |
25g/100g/500g/1kg |
6. 当社の試薬を使用した論文
[1]Li Zhao、Fei Wang、Zhengwei Cai、et al.潰瘍性大腸炎の治療のための注射可能な粘膜付着性ハイドロゲルによる薬物利用プラットフォームの改善[J]。化学工学ジャーナル。424(2021)130464。IF = 16.744
[2]Lingjun Tong、Haining Hao、Zhe Zhang、et al.ミルク由来の細胞外小胞は腸管免疫を調節し、腸内細菌叢を再形成することで潰瘍性大腸炎を緩和する[J]。Theranostics.2021; 11(17): 8570-8586 IF=11.556
[3]Li, Y., Dong, J., Xiao, H., Zhang, S., Wang, B., Cui, M., & Fan, S.腸内常在菌由来の吉草酸は放射線障害から保護する。腸内微生物、2020 .1–18.IF=10.245
[4]Jingjing Gan、Yuxiao Liu、Lingyu Sun、et al.炎症性腸疾患治療のためのマイクロ流体からの経口投与ヌクレオチド送達粒子[J]。Applied Materials Today.2021年12月;25:101231 IF=10.041
[5]Mengmeng Xu、Ying Kong、Nannan Chen、et al.活動性潰瘍性大腸炎における免疫関連遺伝子シグネチャーの同定とCeRNAネットワークの予測[J].Frontiers in Immunology.2022; 13: 855645. IF=7.561
[6]JialiDong、YuanLi、HuiwenXiao、et al.口腔内微生物叢はマウスモデルにおける大腸癌の放射線治療の有効性と予後に影響を及ぼす[J].Cell reports.2021, 109886.IF=9.423
[7]Hao H、Zhang X、Tong L、Liu Q、et al.Lactobacillus plantarumQ7由来の細胞外小胞のマウスの腸内細菌叢と潰瘍性大腸炎への影響[J].Frontiers in Immunology.2021.777147 .IF=7.561
[8]Yaohua Fan、Yanqun Fan、Kunfeng Liu、et al.食用ツバメの巣はTh17/Treg細胞バランスを回復させることでC57BL/6Jマウスのデキストラン硫酸ナトリウム誘発性潰瘍性大腸炎を軽減する[J].Frontiers in Pharmacology.2021.632602.IF=7.561
[9]Jia-Rong Huang、Sheng-Te Wang、Meng-Ning Wei、et al.Piperlongumineはマウス大腸炎および大腸炎関連大腸癌を緩和する[J].Frontiers in Pharmacology.2020.586885.IF=7.561
[10]Gao X、Fan W、Tan L、et al。大豆イソフラボンはERα/NLRP3インフラマソーム経路を標的にして実験的大腸炎を改善する[J]。栄養生化学ジャーナル、2020年、83.IF = 6.048
[11]Lujuan Xing、Lijuan Fu、Songmin Cao、et al.LPS誘導RAW264.7マクロファージ細胞およびデキストラン硫酸ナトリウム誘導C57BL/6マウスにおけるウシ骨ゼラチン由来ペプチドの抗炎症効果[J]。Nutrients 2022、14、1479。IF=5.717
[12] Wang S、Huang J、Tan KS、et al.イソステビオールナトリウムは代謝プロファイリング、マクロファージ分極、NF-B経路の調節を介してデキストラン硫酸ナトリウム誘発性慢性大腸炎を軽減する[J]。酸化医学と細胞長寿命。2022、4636618。IF = 5.076
7. 読書を尊重する
アゾキシメタン(AOM)とデキストラン硫酸ナトリウム(DSS)誘発大腸炎関連癌モデルの確立
デキストラン硫酸ナトリウム(DSS)潰瘍性大腸炎モデルの確立
デキストラン硫酸ナトリウム(DSS)を使用した潰瘍性大腸炎子豚モデルのプロトコル
デキストラン硫酸ナトリウム(DSS)を使用した潰瘍性大腸炎のショウジョウバエモデリングのプロトコル
