より効率的なトランスフェクション試薬、リニアPEI 40000
一般的に、トランスフェクションとは、真核細胞に核酸(DNAまたはRNA)を人工的に導入するプロセスです。トランスフェクション試薬は、その名前が示すように、トランスフェクションに関係する一連の試薬です。トランスフェクションの過程で、トランスフェクション効率が低い、適用範囲が狭い、毒性が強い、操作が面倒、トランスフェクション試薬の価格が高いなどの問題に悩まされることがよくあります。では、これらの問題を解決できるトランスフェクション試薬はあるのでしょうか?はい、これらの問題を解決するには、直鎖状PEIが最適です。
注:
1. 細胞トランスフェクションにはどのような種類がありますか?
2. リニア PEI MW 40000 とは何ですか?
3. リニア PEI MW 40000 はどのように機能しますか?
4. PEI MW 40000の特徴は何ですか?
5.
6. 読書を尊重する
1. 細胞トランスフェクションにはどのような種類がありますか?
リニア PEI MW 40000 を紹介する前に、まず細胞トランスフェクションの種類について簡単に理解しましょう。細胞トランスフェクションは、遺伝子研究、タンパク質研究、細胞学研究にとって非常に重要であり、非ウイルス感染手段を利用して核酸 (DNA または RNA) を細胞に人工的に導入するプロセスを指します。トランスフェクションの主な目的は、細胞内の特定の遺伝子発現を増強または阻害することにより、遺伝子または遺伝子産物の機能を研究すること、または組み換えタンパク質を生成することです。外因性核酸の導入により細胞の特性が変化し、トランスフェクションの目的が達成されます。これは、遺伝子調節とタンパク質発現の研究、およびタンパク質の合成と生成に役立ちます。
細胞トランスフェクションは、化学的、生物学的、物理的方法、または細胞内の外来遺伝子の滞留時間によって分類できます。一過性トランスフェクションでは、導入された核酸は複製されずに限られた時間細胞内に存在できますが、安定的トランスフェクションでは、導入された核酸は宿主ゲノムに組み込まれ、トランスフェクトされた細胞の子孫で発現できます。
さまざまな細胞トランスフェクション方法がありますが、適切な方法をどのように選択すればよいのでしょうか?
すべての細胞タイプに適しており、すべての実験ニーズを満たす単一のトランスフェクション方法はありません。最適なトランスフェクション方法は、細胞タイプと実験条件の要件に応じて選択する必要があります。
現在、化学トランスフェクション試薬は、操作の容易さとさまざまな細胞株との互換性により、依然として主流の細胞トランスフェクション方法です。
2. リニア PEI MW 40000 とは何ですか?
ポリエチレンイミン リニア (PEI) MW40000 (迅速溶解) は、分子量 40,000 のポリエチレンイミン (PEI 40000) をベースにした一過性トランスフェクション試薬です。PEI 40000 は、高電荷カチオン性ポリマーで、負に帯電した核酸分子と容易に結合して複合体を形成し、複合体を細胞に導入します。
PEI 25000 トランスフェクション試薬と比較すると、PEI 40000 は溶解しやすく、水に直接溶解できます。さらに、PEI 25000 には 4 ~ 11% のプロピオニル残基が含まれており、ポリマー骨格が DNA に結合するのを防ぎます。しかし、PEI 40000 は完全なシェッド構造であるため、そのパフォーマンスは一貫して効率的です。
3. リニア PEI MW 40000 はどのように機能しますか?
ポリエチレンイミン (PEI) は、細胞接着性に優れた優れた多機能非ウイルスベクターで、リソソーム阻害剤に依存せずに細胞をトランスフェクトするために使用できます。PEI と DNA は静電気力で結合し、DNA を緩いコイル状構造から球状粒子複合体に崩壊させます。PEI-DNA 複合体は通常、正に帯電し、外部細胞膜と静電的に相互作用してエンドサイトーシスによって取り込まれます。エンドサイトーシスされた PEI-DNA 複合体は、エンドソームによって捕捉され、リソソームに運ばれて分解されます。内部のイオン圧が絶えず増加すると、エンドソームが膨張して破裂し、外来 DNA が細胞質に放出されます。このトランスフェクション メカニズムは、「プロトン スポンジ」効果と呼ばれます。
研究により、PEI分子はPEI-DNA複合体の表面を覆い、細胞質内のヌクレアーゼによるDNAの分解を十分に防ぎ、外来DNAが細胞質から核へ確実に移行できることがわかっています。さらに、PEI分子はリン脂質膜に挿入され、DNAを細胞核へ移行するための安定したチャネルを形成します。PEI分子は細胞核に入らず、DNAベクターとして重要な役割を果たします。
外来遺伝子が哺乳類細胞に導入されてから1~4日後に遺伝子発現が検出されます。この発現は、導入されたDNAの一部が核に入った後にmRNAに転写され、その後細胞質に翻訳されるためです。この方法は比較的シンプルで実装が容易であるため、適切な発現ベクターとトランスフェクション方法を選択することにより、タンパク質発現量をより高いレベルにまで高めることができます。PEIトランスフェクション試薬は、タンパク質の構造と機能を研究するための一般的なトランスフェクション方法として、科学研究と産業用途で広く使用されています。
4. PEI MW 40000の特徴は何ですか?
PEI 40000 は細胞毒性の低い一過性トランスフェクション試薬として、HEK293 や CHO などの細胞で高いトランスフェクション効率と高い遺伝子発現効率を発揮します。リニア PEI トランスフェクション試薬は、HEK-293、HEK293T、CHO-K1、COS-1、COS-7、NIH/3T3、HepG2、Hela 細胞など、幅広い細胞株で検証されています。トランスフェクション効率は 80%~90% と高いです。パフォーマンス データを引き続き表示します。
- 高いトランスフェクション効率、接着細胞および浮遊細胞に最適
HEK-293、HEK293T、CHO-K1、COS-1、COS-7、NIH/3T3、Sf9、HepG2、Hela細胞など、さまざまな細胞株に適しており、トランスフェクション効率は80%~90%と高くなります。
表1. 検証済み細胞株のリスト
|
接着細胞(1μg DNA) |
効率 |
浮遊細胞(DNA 2μg) |
効率 |
|
HEK-293 |
80%-90% |
チョーK1 |
85% |
|
SF9 |
80%-90% |
HEK-293T |
70%-80% |
|
肝細胞G2 |
80%-90% |
THP-1 |
70%-80% |
|
ヘラ |
80%-90% |
||
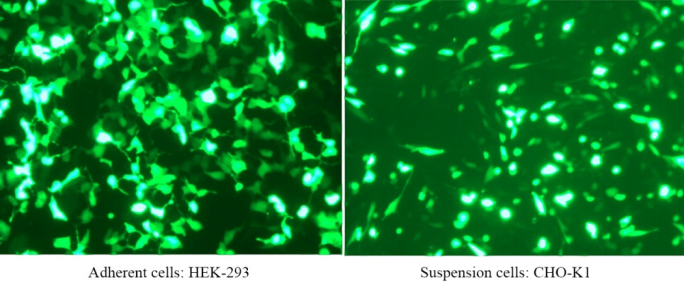
図2. PEI 40000は接着細胞HEK-293にGFPプラスミドを導入し、導入効率は72時間後に90%に達した(左);PEI 40000は懸濁細胞CHO-K1にGFPプラスミドを導入し、導入効率は72時間後に80%に達した(右)
- 低毒性
細胞の生存率を保証し、トランスフェクション効率を向上させます。
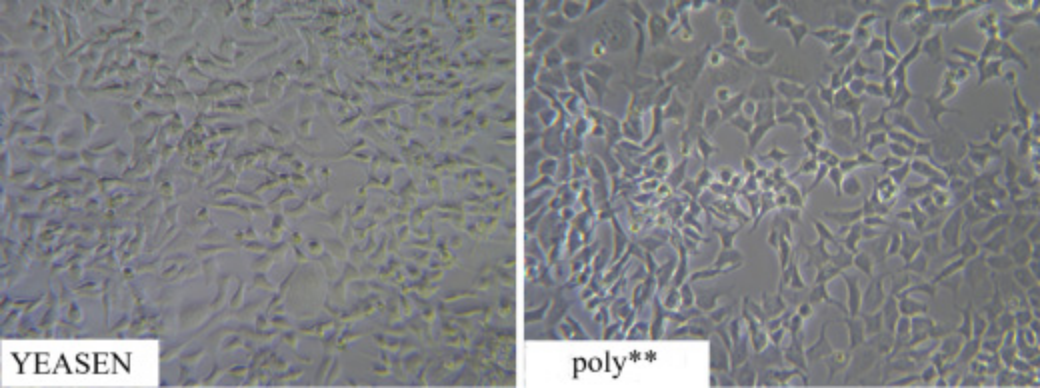
図3. YEASENが提供するPEI 40000は、競合するポリよりも細胞毒性がはるかに低い**
- トランスフェクション効率はPEI 25000よりも高く、PEI 25000を完全に置き換えることができます。
PEI 25000 には 4 ~ 11% のプロピオニル残基が含まれており、ポリマー骨格が DNA に結合するのを防ぎます。PEI 25000 と比較すると、PEI 40000 は完全なシェッド構造であるため、そのパフォーマンスは一貫して効率的です。
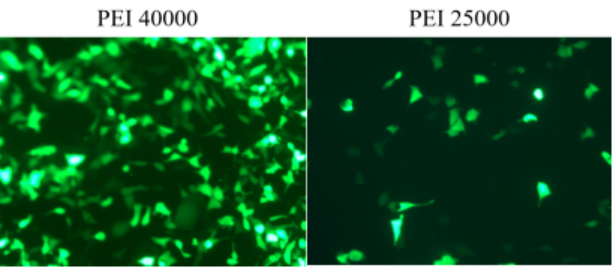
図 4. HEK-293 細胞に PEI 25000 および PEI 40000 トランスフェクション試薬を使用して GFP プラスミドを一時的にトランスフェクトし、72 時間後に蛍光を観察しました。実験結果: PEI 40000 トランスフェクション効率は PEI25000 よりも優れています。
- シンプルな構成と短いトランスフェクション時間
本製品はpH調整なしで水に直接溶解できるインスタントタイプです。血清や抗生物質にも対応しており、培地交換の必要がありません。
- コスト効率が高く、大規模な一過性トランスフェクションに適しています
5. Yeasen のその他のトランスフェクション試薬
表2.
|
猫# |
製品名 |
核酸型 |
細胞の種類 |
|
40823ES |
DNA |
忠実で 懸濁細胞 |
|
|
40816ES |
DNA |
忠実で 懸濁細胞 |
|
|
40820ES |
DNA |
忠実で 懸濁細胞 |
|
|
40821ES |
DNA |
忠実で 懸濁細胞 |
|
|
40802ES |
DNA (<10kb)、shRNA |
接着細胞 |
|
|
40805ES |
Hieff Trans™ 懸濁液 無細胞 リポソームトランスフェクション試薬 (お問い合わせ) |
DNA (<10kb) |
懸濁細胞( 浮遊血球または免疫 細胞、トランスフェクション効率 現在の化学試薬は 高くない。 エレクトロポレーションまたはウイルス法 が推奨されます。 |
|
40806ES |
siRNA 、 miRNA 、 pre-miRNA、模倣miRNA、アンチmiRNA |
接着細胞と浮遊細胞 |
6. 読書を尊重する
トランスフェクション試薬 – Hieff Trans™ および PEI
参照:
[1] Lu, Y., Yao, J., & Zhou, J. (nd). ポリエチレンイミン-DNA複合体の形成と凝集挙動薬学部、南京210009。
[2] Sabin, J., et al. (2022). ポリエチレンイミントランスフェクションのメカニズムに関する新たな知見と遺伝子治療およびDNAワクチンへの影響。コロイドおよび表面B:バイオインターフェイス、210、112219。
[3] ポリエチレンイミン(PEI)による一過性哺乳類細胞トランスフェクション。Longo PA、Kavran JM、Kim MS、Leahy DJ
