体外細胞トランスフェクション試薬製品選択ガイド
細胞トランスフェクション試薬は、真核細胞における遺伝子機能の研究と制御のための日常的な試薬となっています。トランスフェクション試薬は、遺伝子機能研究、遺伝子発現調節、突然変異分析、遺伝子治療、細胞治療、タンパク質生産、ワクチン生産に広く使用されています。では、トランスフェクションとは何でしょうか。また、実験に基づいてトランスフェクション試薬の種類をどのように選択すればよいのでしょうか。
トランスフェクションにはどのような種類がありますか?
実験に基づいてトランスフェクション試薬の種類を選択するにはどうすればよいでしょうか?
応用事例
トランスフェクション条件の参考
よくある質問
読書について
トランスフェクションにはどのような種類がありますか?
トランスフェクション後に核酸が宿主細胞の染色体に組み込まれるかどうかによって、「一過性」(一過性トランスフェクション)と「安定」(安定トランスフェクション)に分けられます。異なるトランスフェクション方法のトランスフェクション効率、細胞毒性、正常な生理機能への影響、遺伝子発現レベルは異なります。次の表に、原理、用途、特徴を比較します。
表1 さまざまなトランスフェクション法の比較
|
テクノロジー |
原則 |
利点 |
デメリット |
|
化学的トランスフェクション法 |
|||
|
カチオン性リポソーム |
正に帯電したリポソームは、負に帯電した核酸のリン酸基と複合体を形成し、細胞に取り込まれます。 |
|
|
|
リン酸カルシウム共沈 |
リン酸カルシウムDNA複合体は細胞膜に吸着し、細胞に取り込まれる。 |
|
|
|
デキストラン |
正に帯電した DEAE デキストランと核酸の負に帯電したリン酸骨格の相互作用によって形成された複合体は、細胞によってエンドサイトーシスされます。 |
|
|
|
その他のカチオンポリマー |
正に帯電したポリマーは、核酸の負に帯電したリン酸基と正に帯電した複合体を形成し、次に細胞表面の負に帯電したプロテオグリカンと相互作用し、エンドサイトーシスによって細胞内に入ります。 |
|
|
|
バイオトランスフェクション法 |
|||
|
ウイルストランスフェクション |
本能は細胞に感染し遺伝物質を送り込む |
|
|
|
物理的トランスフェクション法 |
|||
|
電気転送 |
高パルス電圧により細胞膜電位が破壊され、膜に形成された孔から DNA が導入されます。 |
|
|
|
生体伝達粒子送達(粒子衝撃) |
DNA を微細な重金属粒子で沈殿させ、コーティングされた粒子を弾道装置で細胞内に発射すると、DNA が徐々に細胞内に放出され、発現します。 |
|
|
|
マイクロインジェクション |
マイクロマニピュレーションは、標的細胞の核に DNA を直接注入するために使用されます。 |
|
|
Yeasen のトランスフェクション試薬の特徴
DNAトランスフェクション試薬とRNAトランスフェクション試薬については、
|
Hieff Trans™ 懸濁液無細胞リポソームトランスフェクション試薬 |
|
|
40802ES |
40805ES |
|
40806ES |
40816ES |
- 高効率: 細胞株の一過性トランスフェクションまたは安定トランスフェクションに適しています。
- 低毒性: トランスフェクトされた細胞は生存能力を維持します。
- 幅広い適応性: 一般的な細胞とトランスフェクションが難しい初代細胞を包括的にカバーします。
- 操作が簡単: 血清が存在する培地に適しており、トランスフェクションの前後に培地を交換する必要はありません。
- コスト効率が高い: 経済的かつ実用的、高いトランスフェクション効率、低価格。
実験に基づいてトランスフェクション試薬の種類を選択するにはどうすればよいでしょうか?
トランスフェクション試薬の選択は、トランスフェクトされる物質、特定の細胞、操作の利便性などのさまざまな実験目的と実験内容に応じて選択する必要があります。
|
製品 |
Hieff Trans™ 懸濁液無細胞リポソームトランスフェクション試薬 |
|||
|
細胞の種類 |
従来のセル |
従来のセル |
従来のセル |
従来のセル |
|
/ |
/ |
トランスフェクションが難しい細胞 |
トランスフェクションが難しい細胞 |
|
|
核酸型 |
DNA |
DNA |
/ |
DNA |
|
siRNA |
siRNA |
siRNA |
/ |
|
|
/ |
/ |
マイクロRNA |
/ |
|
|
/ |
/ |
miRNAを模倣する |
/ |
|
|
/ |
/ |
アンチミRNA |
/ |
|
|
DNA/siRNA共トランスフェクション |
DNA/siRNA共トランスフェクション |
/ |
/ |
|
|
ウイルスパッケージ |
ウイルスパッケージ |
/ |
ウイルスパッケージ |
応用事例
Hieff Trans™ リポソームトランスフェクション試薬
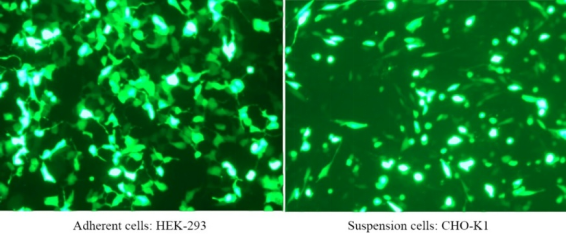
Hieff Trans™ は滅菌液状で供給されます。通常、24 ウェル プレートのトランスフェクションでは、1 回あたり約 1.5 μL、1 mL の Hieff Trans™ で約 660 回のトランスフェクションが可能です。6 ウェル プレートでは、1 回あたり約 6 μL、1 mL の Hieff Trans™ で約 660 回のトランスフェクションが可能です。160 回のトランスフェクション。
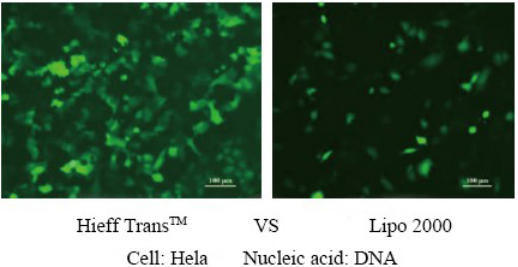
詳細については、 Hieff Trans™ Lipofectamine試薬によるトランスフェクションの信頼性をご覧ください。
ポリエチレンイミン リニア (PEI) MW40000 (急速溶解)
PEI 40000は、分子量40,000の高電荷カチオン性ポリマーで、負に帯電した核酸分子と非常に容易に結合し、複合体を形成して複合体が細胞内に侵入することを可能にします。PEI 40000は、HEK293やCHOなどの細胞において、細胞毒性が低く、トランスフェクション効率が高く、遺伝子発現効率が高い一過性トランスフェクション試薬です。リニアPEIトランスフェクション試薬は、HEK-293、HEK293T、CHO-K1、COS-1、COS-7、NIH/3T3、Sf9、HepG2、Hela細胞など、幅広い細胞株で検証されています。トランスフェクション効率は80%~90%と高くなっています。
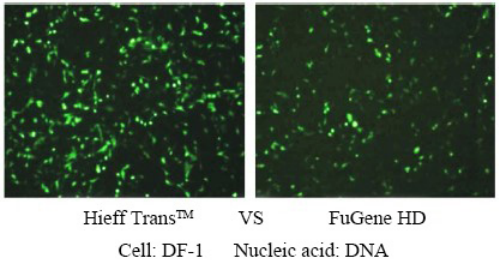
詳細については、 「トランスフェクションの新しいお気に入り —— より効率的なトランスフェクション試薬、リニア PEI MW 40000」をご覧ください。
Hieff Trans™ in vitro siRNA/miRNAトランスフェクション試薬
この製品は、幅広い細胞株で 1 nM siRNA の 90% を超える発現効率を達成し、オフターゲット効果を回避できます。Hela、MCF-7、HepG2、CHO などの接着細胞を含むさまざまな細胞のトランスフェクションに適しており、トランスフェクションが難しい K562 または THP-1 細胞などの懸濁細胞株でも 80% のサイレンシング効率を達成できます。一部の初代細胞、初代ヒト線維芽細胞、初代ヒト肝細胞などを含め、80% のサイレンシング効率を達成できます。
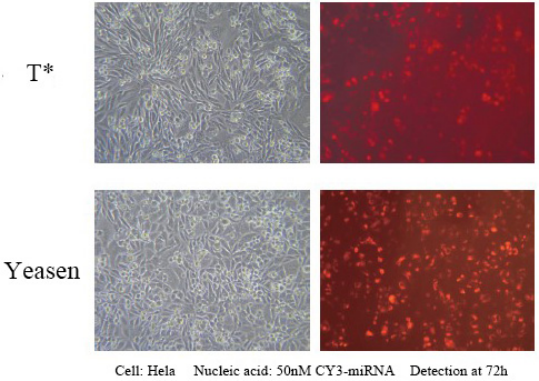
トランスフェクション条件の参考
各製品の説明書以外にも、お客様はそれぞれの実験内容に応じて操作し、使用量にも差があります。製品使用後にお客様から報告されたin vitro細胞トランスフェクション条件に基づき、参考のために整理しました。
|
商品名/品番 |
Hieff Trans™ リポソームトランスフェクション試薬/40802ES |
||||
|
細胞 |
培養容器 |
細胞培養密度 |
DNA |
ヒエフトランス |
トランスフェクション効率 |
|
A549 |
6 井戸 |
90% |
0.7μg |
1.15μL |
+++ |
|
2 ビクター |
24 井戸 |
95% |
0.2μg |
0.2μL |
++ |
|
C2C12 |
24 井戸 |
80% - 90% |
1μg |
5μL |
++ |
|
DF1 |
24 井戸 |
80% - 90% |
0.5μg |
0.5μL |
+++ |
|
H520 |
6 井戸 |
80% |
1.2μg |
6μL |
++ |
|
ハキャット |
96 ウェル |
70% |
100 ng |
1μL |
++ |
|
HCT116 |
6 井戸 |
90% |
4μg |
10μL |
++ |
|
ヘック293 |
6 井戸 |
95% |
2μg |
10μL |
80 - 90% |
|
HEK 293フィート |
24 井戸 |
85% |
1μg |
4μL |
90% |
|
ヘック293T |
12 井戸 |
1×105 |
1μg |
2μL |
+++ |
|
HEK 293T(サスペンション) |
30ml |
80% |
30μg |
60μL |
++ |
|
ヘラ |
12 井戸 |
90% |
0.2μg |
0.6μL |
90% |
|
ヘラ |
12 井戸 |
80% |
1μg |
3μL |
+++ |
|
肝細胞G2 |
12 井戸 |
80% |
1μg |
3μL |
++ |
|
ヒト血管内皮細胞 |
24 井戸 |
80% |
1μg |
2μL |
++ |
|
MC10A |
10cm皿 |
60% |
5μg |
15μL |
++ |
|
N2A |
24 井戸 |
70% - 80% |
300 ng |
900μL |
+ |
|
NCI H1975 |
6 井戸 |
80% |
4μg |
10μL |
+++ |
|
国立衛生研究所 3T3 |
6 井戸 |
90% |
4μg |
10μL |
+++ |
|
生 264.7 |
35 mmディッシュ |
80% |
1μg |
2μL |
90% |
|
ベロ |
6 井戸 |
80% |
3μg |
9μL |
+++ |
|
細胞 |
培養容器 |
細胞培養密度 |
siRNA |
ヒエフトランス |
トランスフェクション効率 |
|
香港2 |
6 井戸 |
65% |
100ピコモル |
6μL |
+++ |
よくある質問
1 Hieff Trans™ リポソームトランスフェクション試薬
1.1 Q: 核酸トランスフェクション試薬複合体を調製する際に血清を存在させることはできますか?
A: 血清の存在はリポソームの形成に影響します。核酸トランスフェクション試薬複合体を調製する際は、無血清培地(通常は MEM 培地)の使用をお勧めします。
1.2 Q: Hieff Trans™ リポソーム核酸トランスフェクション試薬を使用する際に注意すべきことは何ですか?
答え:
1) 細胞をトランスフェクトする際、細胞密度は好ましくは80%〜95%であり、具体的な播種密度は細胞の状況に応じて決定される。
2) 高純度 DNA を使用すると、より高いトランスフェクション効率が得られます。
3) トランスフェクション複合体を調製する際には、DNA およびトランスフェクション試薬を無血清培地で希釈する必要があります。
4) トランスフェクション中に培地に抗生物質を添加することはできません。
5) 試薬は2~8℃で保管し、蓋を長時間繰り返し開けないように注意する。
6) 最大のトランスフェクション効率を得るために、初回使用時に DNA 濃度とカチオン性リポソーム試薬の数を最適化する必要があります。DNA とトランスフェクション試薬の比率は、通常 1:2 ~ 1:3 が推奨されます。
1.3 Q: トランスフェクション後に終了する必要がありますか?
A: 必要ありません。リポソーム複合体は 6 時間安定しています。トランスフェクション前に細胞培地を交換していない場合は、正常な細胞成長に必要な栄養素を確保するために、4 ~ 6 時間後に新しい培地に変更する必要があります。ただし、トランスフェクション前に培地を変更した場合は、リポソームトランスフェクション後に培地を変更する必要はありません。
1.4 Q: DNA と siRNA の同時トランスフェクションは可能ですか? 効果はどうですか?
A: はい、DNA と siRNA を共トランスフェクトすると、siRNA トランスフェクション効率はわずかに低下します。
1.5 Q: トランスフェクション試薬はレンチウイルスパッケージングのトランスフェクションに使用できますか?
A: レンチウイルスのパッケージングは可能です。
1.6 Q: Hieff Trans™ リポソーム核酸トランスフェクション試薬を使用して懸濁細胞をトランスフェクトできますか?
A: Hieff Trans™ リポソーム核酸トランスフェクション試薬は、浮遊細胞トランスフェクションに使用できます。詳細についてはプロトコルを参照してください。さらに、浮遊細胞専用のトランスフェクション試薬も導入しました (カタログ番号 40805、Hieff Trans™ 浮遊細胞フリーリポソームトランスフェクション試薬)
2 Hieff Trans™ in vitro siRNA/miRNAトランスフェクション試薬
2.1 Q: トランスフェクション後にトランスフェクション試薬を交換する必要がありますか?
A: この問題は 2 つのケースに分けられます: 1. トランスフェクション前に培地交換を行わない場合、細胞の成長に必要な栄養素を確保するために、トランスフェクション後約 6 時間で培地を交換する必要があります。2. トランスフェクション前に培地交換を行う場合は、培養細胞の通常の操作に従って操作できますか? ? 液体交換操作後?
2.2 Q: トランスフェクション試薬は凍結できますか?
A: トランスフェクション試薬は PEI カチオントランスフェクション試薬であるため、凍結できません。低温で凍結すると、PEI トランスフェクション試薬の活性が破壊されます。したがって、最良のトランスフェクション効率を維持するには、2 ~ 8 °C で保管するのが最適です。
製品情報
| 製品名 | 製品コード | 仕様 |
| Hieff Trans™ リポソームトランスフェクション試薬 | 40802ES02 | 0.5mL |
| 40802ES03 | 1.0mL | |
| 40802ES08 | 5×1mL | |
| Hieff Trans™ 懸濁液無細胞リポソームトランスフェクション試薬 (お問い合わせ) | 40805ES02 | 0.5mL |
| 40805ES03 | 1.0mL | |
| 40805ES08 | 5×1mL | |
| Hieff Trans™ in vitro siRNA/miRNAトランスフェクション試薬(お問い合わせ) | 40806ES02 | 0.5mL |
| 40806ES03 | 1.0mL | |
| ポリエチレンイミンリニア(PEI) MW40000(迅速溶解) | 40816ES02 | 100mg |
| 40816ES03 | 1グラム | |
| 40816ES08 | 5×1g |
当社の製品を使用して公開された記事の一部
[1] Liu R、Yang J、et al. 人工光スイッチRNA結合タンパク質を用いたRNA機能と代謝の光遺伝学的制御。Nat Biotechnol. 2022年1月3日。(IF:55)
[2] Luo J, Yang Q, et al. TFPIは、超毒性系統2のC. difficile由来のTcdBの大腸陰窩受容体である。Cell. 2022年3月17日(IF:41.582)
[3] Zhou J、Chen P、et al. 厳密なPAM認識によりゲノム全体のオフターゲット効果を低減するように設計されたCas12aバリアント。Mol Ther. 2022年1月5日。(IF:11.454)
[4] Chen S、Cao X、et al. circVAMP3はCAPRIN1の相分離を促進し、c-Mycの翻訳を抑制することで肝細胞癌を阻害する。Adv Sci(Weinh)。2022年1月24日。(IF:16.808)
[5] Gu C、Wang Y、et al. AHSA1は多発性骨髄腫における細胞増殖およびプロテアソーム阻害剤耐性に対する有望な治療標的である。J Exp Clin Cancer Res. 2022年1月6日。(IF:11.161)
[6] Zhang Y、Yu X、et al. スプライシング因子アルギニン/セリンリッチ8はCACYBPの選択的スプライシングとエクソソームベースの細胞間コミュニケーションを介して多発性骨髄腫の悪性度と骨病変を促進する。Clin Transl Med. 2022年2月(IF:11.492)
[7] Qin J, Cai Y, et al. グレリン受容体のアゴニズムと逆アゴニズムの分子メカニズム。Nat Commun. 2022年1月13日(IF:14.9)
[8] Tang X、Deng Z、et al. circHNRNPUによってコードされる新規タンパク質は骨髄微小環境と選択的スプライシングを制御することで多発性骨髄腫の進行を促進する。J Exp Clin Cancer Res. 2022年3月8日。(IF:11.161)
[9] Xie F, Su P, et al. パルミトイル化ACE2を豊富に含む細胞外小胞のエンジニアリングによるCOVID-19治療。Adv Mater. 2021年10月19日。(IF:30.849)
[10] Liang Y、Lu Q、et al。NamiRNAネットワークを介したエンハンサースイッチングによる乳がんの腫瘍抑制因子の再活性化。Nucleic Acids Res。2021年9月7日。(IF:16.9)
[11] Fan Y、Wang J、et al. CircNR3C2はトリプルネガティブ乳がんにおいてmiR-513a-3pのスポンジングを介してHRD1を介した腫瘍抑制効果を促進する。Mol Cancer. 2021年2月2日。(IF:27.403)
[12] Dai L、Dai Y、et al. BRCA1-BARD1複合体の損傷したクロマチンへのリクルートメントに関する構造的洞察。Mol Cell. 2021年7月1日。(IF:17.97)
[13] Zhang K、Wang A、et al。UBQLN2-HSP70軸はポリグリシンアラニン凝集体を減少させ、C9ORF72動物モデルの行動障害を軽減する。ニューロン。2021年6月16日。(IF:17.17)
[14] Li T、Chen X、et al. マウスのグルコース恒常性を可能にする脈動遺伝子発現のための合成BRETベースの光遺伝学デバイス。Nat Commun。2021年1月27日。(IF:14.92)
[15] Yan F, Huang C, et al. 細菌エフェクターファミリーによるユビキチンのトレオニンADPリボシル化は宿主のユビキチン化を阻害する。Mol Cell. 2020年5月21日。(IF:17.97)
[16] Sun X、Peng X、et al. ADNPはWnt/β-カテニンシグナル伝達を調節することで神経分化を促進する。Nat Commun. 2020年6月12日(IF:14.911)
[17] Yang X、Wang H、et al。ERBB3とERKシグナル伝達の再配線は、ERBB3-E928G変異を有する消化管癌におけるFGFR1阻害に対する抵抗性を付与する。Protein Cell。2020年12月(IF:14.872)
[18] Zou Y、Wang A、et al. 遺伝子組み換え蛍光センサーを用いた生細胞および生体内における酸化還元ランドスケープとダイナミクスの解析。Nat Protoc. 2018年10月(IF:13.490)
[19] Hao H、Hu S、et al. 心筋梗塞後の血管恒常性と心臓リモデリングを阻害する内皮CXCR7の喪失:心血管系薬剤発見への影響。Circulation。2017年3月28日。(IF:29.69)
