Overzicht van T4 DNA Ligase
Welke enzymen gebruiken wetenschappers om een nieuw gen te binden? DNA-ligase is hierbij uiteraard inbegrepen. Waarom is DNA-ligase dan zo belangrijk in recombinant DNA? Omdat DNA-ligase verantwoordelijk is voor het binden van het doelfragment aan de vector, wat een van de belangrijkste elementen is die het succes van het experiment bepaalt. Welke rol speelt T4 DNA-ligase als een soort DNA-ligase in moleculaire kloneringsexperimenten? Hoe werkt het? De T4 DNA-ligase wordt hierna uitgebreid geïntroduceerd.
1. Wat is T4 DNA Ligase?
2. Wat is de functie van T4 DNA-ligase?
3.
4. Een selectiegids voor
1. Wat is T4 DNA Ligase?
T4 DNA-ligase is een ATP-afhankelijke ligase die de ligatiereactie tussen DNA-moleculen katalyseert. Het vormt voornamelijk fosfodiester door de 3'-hydroxyl- en 5'-fosfaatuiteinden te verbinden. DNA-ligases zijn betrokken bij DNA-replicatie- en reparatieprocessen in alle organismen. De faag-gecodeerde T4 DNA-ligase wordt geproduceerd tijdens faag T4-infectie van E. coli.
De ligases die worden gebruikt in genetische manipulatie zijn voornamelijk E. coli DNA-ligase en T4 DNA-ligase, waarbij de laatste momenteel het meest wordt gebruikt. T4 DNA-ligase kan enkelstrengs nicks op dubbelstrengs DNA, dubbelstrengs RNA of DNA/RNA-hybride strengen repareren om twee aangrenzende nucleotiden te verbinden, en speelt een belangrijke rol bij DNA-reparatie en -recombinatie.
In het recombinant plasmide constructieproces kan T4 DNA ligase samen met restrictie-enzymen worden gebruikt om het recombinant plasmide constructie experiment te voltooien. Het kan de vorming van een fosfodiesterbinding tussen het 5'-P uiteinde en het 3'-OH uiteinde van dubbelstrengs DNA katalyseren en heeft een goede verbindingsefficiëntie voor sticky end connection en blunt end connection.
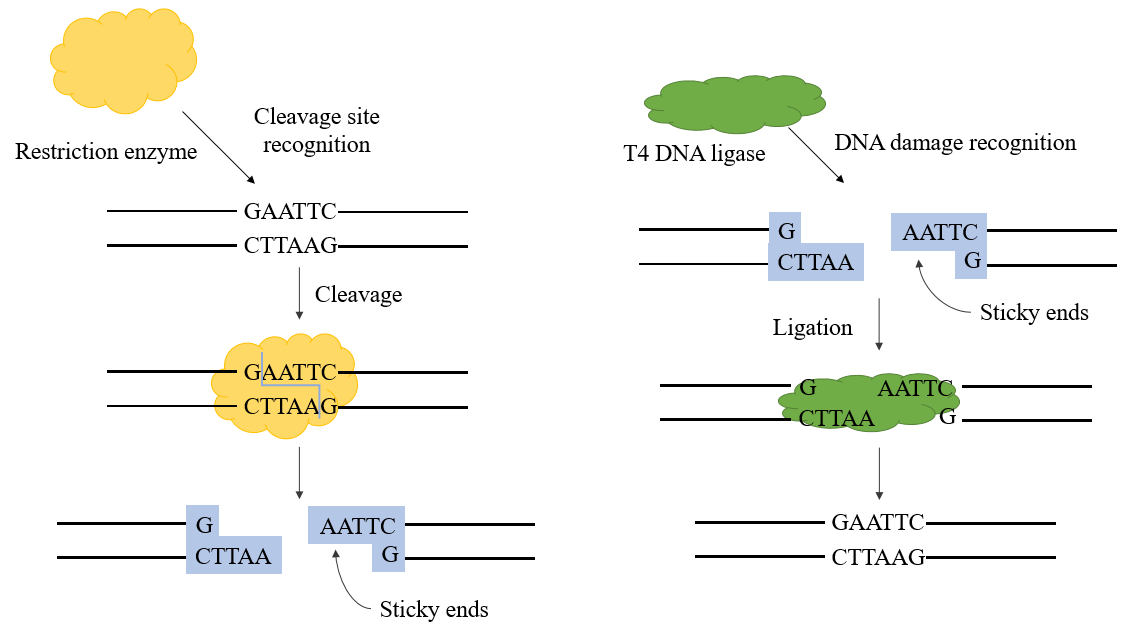
Figuur 1. T4 DNA-ligasemechanisme
2. Wat is de functie van T4 DNA-ligase?
2.1 Vectorconstructie
In vectorconstructie-experimenten kunnen verschillende restrictie-enzymen verschillende typen uiteinden produceren. Voor verschillende uiteinden zal T4 DNA-ligase verschillende ligatiestrategieën hebben.
2.1.1 Klonen met restrictie-enzymen, kleverige uiteinden geproduceerd door enkelvoudige vertering
Tijdens de constructie van de vector, als dezelfde restrictie-endonuclease wordt gebruikt om het DNA-fragment van het doelgen te knippen en het vectormolecuul hetzelfde kleverige uiteinde kan produceren, kan de T4 DNA-ligase de recombinatieverbinding direct uitvoeren. Omdat de kleverige uiteinden echter hetzelfde zijn, kan het doelgen in de vector worden ingebracht in de voorwaartse of achterwaartse richting, wat de werklast van het screenen op correcte recombinante klonen gemakkelijk zal vergroten. Overweeg om de dubbele-enzymdigestiemethode te gebruiken voor vectorconstructie.
Bovendien kunnen de cohesieve uiteinden van de vector die door enkelvoudige enzymdigestie is bereid, ook worden gepaard, en vervolgens worden fosfodiesterbindingen gevormd tussen nucleotiden onder de werking van T4 DNA-ligase, wat resulteert in de zelfligatie van de vector. Door alkalische fosfatase te gebruiken om de verteerde vector te behandelen, kan de fosfaatgroep aan het 5'-uiteinde van de vector worden verwijderd, zodat de vector de zelfligatie niet kan voltooien. Zo worden de vector en het doelfragment onder de werking van T4 DNA-ligase verbonden om de constructie van de recombinante vector te voltooien.
2.1.2 Klonen met restrictie-enzymen, kleverige uiteinden geproduceerd door dubbele vertering
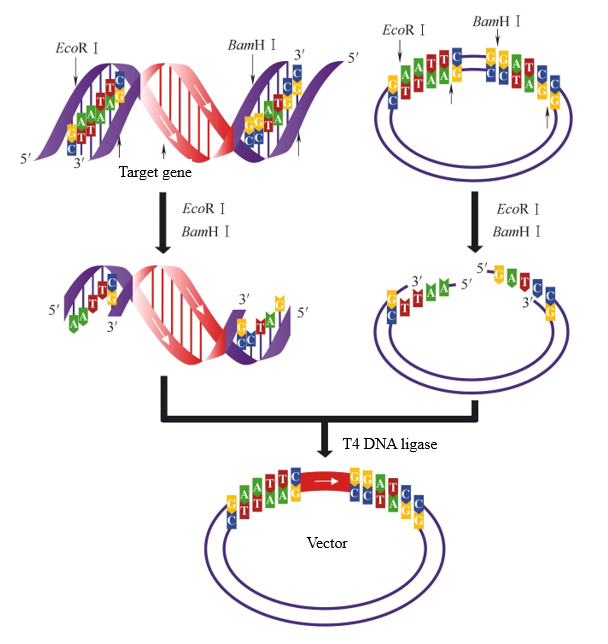
In het proces van vectorconstructie kunnen, als twee restrictie-enzymen met verschillende sticky ends worden gebruikt om respectievelijk het targetfragment en de vector te verteren, twee verschillende sticky ends worden gegenereerd. Op dit punt kan T4 DNA-ligase selectief dezelfde sticky ends ligeren om ervoor te zorgen dat het targetfragment in de juiste richting in de vector wordt ingevoegd. Wanneer het targetfragment en de vector in Figuur 2 tegelijkertijd worden verteerd met EcoR I en BamH I, kunnen dezelfde sticky ends worden verbonden. Er is slechts één ligatierichting tussen het targetfragment en de vector.

Figuur 2. Kleverige eindligatie gegenereerd door dubbele-enzymvertering[1]
2.1.3 Klonen van restrictiefragmenten, stomp uiteinde
Sommige restrictie-endonucleasen kunnen ook stompe uiteinden genereren tijdens enzymatische splitsingen, zoals Sma I en andere. T4 DNA-ligase kan direct een fosfodiesterbinding vormen tussen de vector en het insert, en er is geen behoefte aan paring tussen basen. Deze methode heeft echter een lage ligatie-efficiëntie en is gevoelig voor vector-zelfligatie. Over het algemeen kunnen de stompe uiteinden worden omgezet in kleverige uiteinden en vervolgens worden geligeerd. Bijvoorbeeld, het toevoegen van complementaire poly A- en poly T-basen aan de uiteinden van het doelfragment en de vector en kunstmatig kleverige complementaire uiteinden verbeteren respectievelijk de verbindingsefficiëntie door terminale deoxynucleotidyltransferase.
2.1.4 TA-klonen
De T-vector die wordt gebruikt bij TA-klonering heeft een T-overhang aan het 3'-uiteinde. Wanneer de DNA-sequentie van het doelfragment onduidelijk is, kan het doelgenfragment worden verbonden met de T-vector door TA-klonering en kan het doelgen worden bepaald door sequentiebepaling. De Taq DNA-polymerase die wordt gebruikt bij PCR heeft terminale transferase-activiteit en kan een nucleotide "A" toevoegen aan het 3'-uiteinde van het DNA-fragment. T4 DNA-ligase kan het product dat is versterkt door Taq DNA-polymerase direct verbinden met de T-vector en het PCR-versterkte product kan het doel van efficiënt klonen bereiken zonder kunstmatige adapters toe te voegen.
Figuur 3. De workflow van TA-klonen[2]
2.2 NGS-adapterligatie
Tijdens de constructie van de next-generation sequencing bibliotheek is het noodzakelijk om de kunstmatige adapter aan het PCR-product te koppelen voordat deze op de flow cell op de sequencing chip kan worden bevestigd om de sequencing te voltooien. TA klonen ligatie linker bibliotheek bouwen is een zeer gebruikelijk technisch middel, en het principe ervan is vergelijkbaar met het hierboven genoemde TA klonen. Nadat het te sequencen DNA fragment aan het 5' uiteinde is gefosforyleerd en "A" is toegevoegd aan het 3' uiteinde, is het complementair en gepaard met de adapter met het "T" kleverige uiteinde. De complete dubbelstrengs wordt vervolgens gevormd en gesequenced door de machine.
Tijdens TA-ligatie hebben verschillende monstertypen of de complexiteit van de nucleïnezuurfragmentstructuur invloed op de efficiëntie van de ligatie. Daarom hebben de adapters van verschillende platforms ook invloed op het uiteindelijke bibliotheekresultaat.
De Bubble-adapter van het MGI-platform heeft bijvoorbeeld een speciale secundaire structuur en vereist een zeer hoge ligatie-efficiëntie voor T4 DNA-ligase. De vermindering van de ligatie-efficiëntie heeft een direct effect op de output van de bibliotheek.
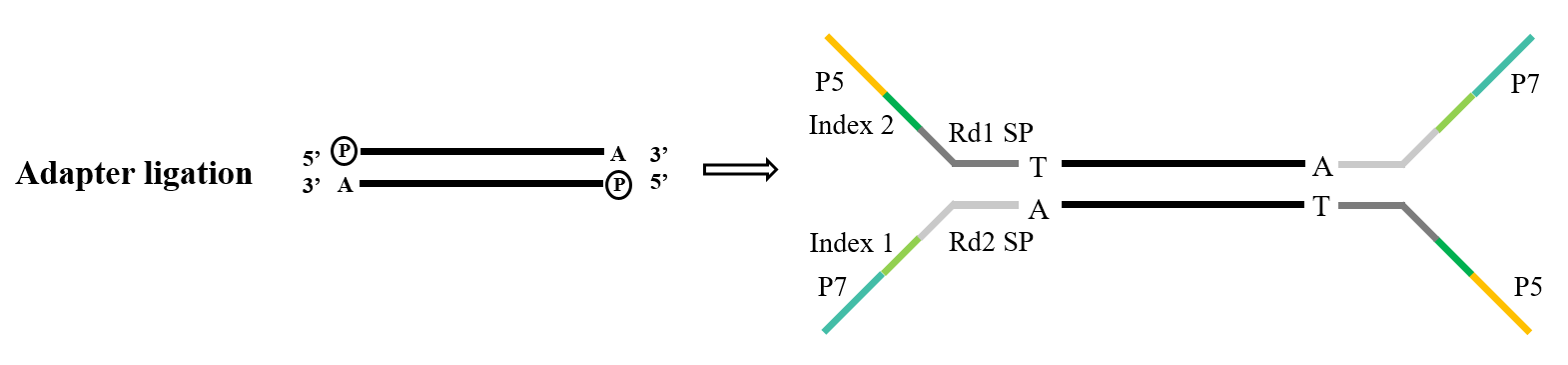
Figuur 4. Algemeen adapterligatieproces
3. Yeasen Biotech T4 DNA-ligase kan worden gebruikt voor NGS-adapterligatie
3.1 Yeasen Biotech Fast T4 DNA-ligase met ultrahoge ligatie-efficiëntie
Gebruik
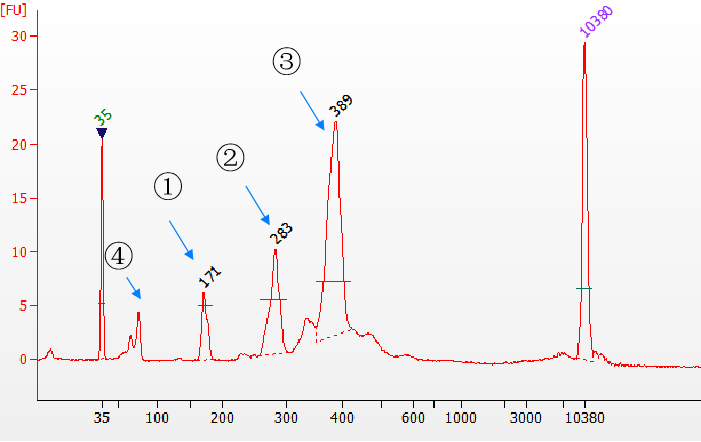
Figuur 5. Verschillende soorten ligatieproducten gedetecteerd door de Agilent 2100
3.2 Yeasen Biotech Fast T4 DNA-ligase met uitstekende bibliotheekopbrengst
Wanneer Fast T4 DNA-ligase wordt gebruikt voor verschillende soorten bibliotheekconstructie, zijn de bibliotheekopbrengsten beter dan bij andere T4 DNA-ligases.
Tabel 1. Opbrengst van verschillende soorten monsters in bibliotheken
| Soorten monsters | Intestinale microbiota gDNA | cfDNA | FFPE HD200-gDNA | |||
| T4 DNA-ligase (zelfde eenheid) | | N* | | N* | | N* |
| Invoer DNA (ng) | 10 | 10 | 50 | |||
| Amplificatiecyclusnummer | 10 | 10 | 8 | |||
| Gemiddelde opbrengst (μg) Illumina-platform | 3.3 | 2.8 | 2.7 | 2.2 | 3 | 2.5 |
| Gemiddelde opbrengst (μg) MGI-platform | 2.7 | 0,9 | 2.0 | 0.7 | 2.3 | 0,8 |
4. Een selectiegids voor Yeasen Biotech T4 DNA-ligase
Tabel 2: Gerelateerde producten
| Productpositionering | Productnaam | Kat# | Sollicitatie |
| Universeel | Hieff™ Gold T4 DNA-ligaseVraag) | 10300ES | Moleculair klonen. |
| Universeel | 10301ES | Bouw van de NGS-bibliotheek. | |
| Hoge ligatie-efficiëntie en lage gastheer E. coli restanten | 10299ES | NGS-bibliotheekconstructie, vooral geschikt voor ziekteverwekkerdetectie, NIPT-detectie, enz. | |
| Hoge gevoeligheid | 10298ES | NGS-bibliotheekconstructie, vooral geschikt voor bibliotheekconstructie van cfDNA-monsters. |
Referenties
[1] W. Yuan. Gene Engineering[M]. Chemical Industry Press, 2019.
[2] Clark DP, Pazdernik NJ, Mcgehee M R. Klonen van genen voor synthetische biologie - ScienceDirect[J]. Moleculaire biologie (derde editie), 2019:199-239.
[3] Tomkinson AE, Vijayakumar S, Pascal JM, et al. DNA-ligases: structuur, reactiemechanisme en functie[J]. Chemical Reviews, 2006, 106(2):687-699.
[4] Shuman S. DNA-ligases: vooruitgang en vooruitzichten[J]. Journal of Biological Chemistry, 2009, 284(26):17365-17369.
