Met het verdiepende onderzoek naar organoïden doen steeds meer mensen mee. Dit artikel vat een aantal algemene kennispunten over organoïden samen [1-5], in de hoop dat het voor iedereen nuttig is.
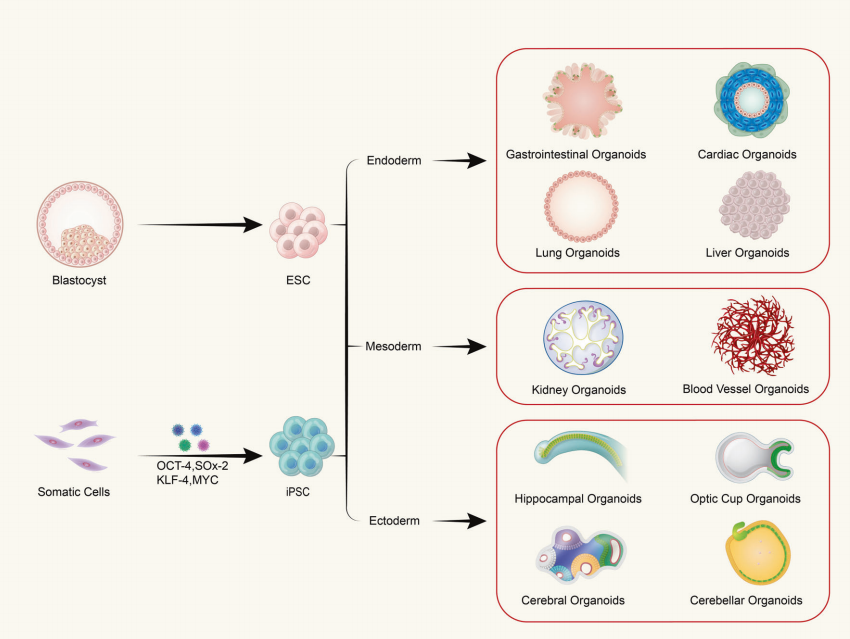
V: Bestaan organoïden uit één type cel of uit meercellige weefsels?
Organoïden worden gevormd door de in vitro driedimensionale (3D) kweek van volwassen stamcellen of pluripotente stamcellen, wat resulteert in weefselachtige structuren met een bepaalde ruimtelijke organisatie. Organoïden zijn geen structuren die bestaan uit enkele cellen; ze worden gevormd door deling en differentiatie van initiërende cellen met stamceleigenschappen te induceren, die zichzelf vervolgens assembleren tot weefsels met een bepaalde ruimtelijke structuur, morfologie en functionaliteit die vergelijkbaar zijn met overeenkomstige organen in vivo.
V: Wat zijn de bronnen voor het kweken van organoïden?
(1) Organoïden afkomstig van pluripotente stamcellen omvatten volwassen stamcellen (ASC), pluripotente stamcellen (PSC) en geïnduceerde pluripotente stamcellen (iPSC). (2) Organoïden afkomstig van uit weefsel geëxtraheerde cellen worden vaak aangetroffen in tumorweefsels.
V: Kan bevroren weefsel gebruikt worden voor 3D-kweek als er geen vers weefsel beschikbaar is?
Ja, maar er worden hogere eisen gesteld aan de grootte van het ingevroren weefsel en de levensvatbaarheid van primair ingevroren weefsel en cellen zal aanzienlijk afnemen, wat leidt tot een sterk verlaagde slagingskans bij de daaropvolgende kweek.
V: Hoe worden organoïden ingevroren en weer tot leven gewekt?
De optimale tijd om organoïden in te vriezen is bij passages 2-5, wanneer de activiteit en het differentiatiepotentieel van organoïden op hun best zijn. De reanimatie van organoïden kan de methoden volgen die worden gebruikt voor celreanimatie.
V: Is het nodig om de grootte van gekweekte organoïden te controleren, en is het nuttig als ze te groot zijn?
Ja, het is noodzakelijk om de grootte te controleren, bij voorkeur binnen 500 μm, aangezien organoïden geen interne vasculaire en gas-vloeistofcirculatiesystemen hebben. Wanneer de grootte van organoïden groot is, hebben cellen in de buurt van het centrum moeite om zuurstof en voedingsstoffen uit te wisselen met de externe omgeving. Daarom geldt: hoe groter de structuur, hoe groter het aantal dode cellen.
V: Wat kan er, naast matrixgel, nog meer gebruikt worden voor het kweken van organoïden?
Naast matrixgel omvatten alternatieven voor het kweken van organoïden (1) gedecellulariseerde extracellulaire matrix en andere afgeleide eiwitten, (2) synthetische hydrogels en (3) gemanipuleerde recombinante eiwitgels.
V: Hoe kan gerichte differentiatie van organoïden worden bereikt?
De vroege ontwikkeling van stamcel-geïnduceerde differentiatie in organoïden wordt gezamenlijk gereguleerd door meerdere signaalpaden. In vitro-kweek vereist de toevoeging van groeifactoren om de activiteit van deze signaalpaden te simuleren, waardoor cellen worden geleid om in specifieke richtingen te differentiëren. Bijvoorbeeld, inductie met Y27632 en Activin A kan embryonale stamcellen (ESC's) of geïnduceerde pluripotente stamcellen (iPSC's) differentiëren tot embryonale lichamen (EB's). Vervolgens worden signaalpaden gereguleerd door factoren zoals Wnt3a, FGF-4 en Noggin om stamceldifferentiatie in specifieke richtingen te induceren.
V: Hoe kan contaminatie worden voorkomen bij het verkrijgen van klinische monsters?
(1) Zorg voor zoveel mogelijk aseptische bemonstering. (2) Dompel de tumoren vóór extractie enkele minuten onder in PBS met antibiotica: voor tumoren die zich bevinden in gebieden met mogelijk contact met de externe omgeving, zoals de maag, de darmen en de blaas, wordt aanbevolen om ze 5-10 minuten onder te dompelen in PBS met 3%-5% antibiotica; voor andere veelvoorkomende tumoren, dompel ze ongeveer 5 minuten onder in PBS met 1%-2% antibiotica. (3) Alle reagentia die tijdens de celextractie worden gebruikt, moeten 1% antibiotica en een geschikte concentratie primaire antibiotica bevatten.
V: Welke voorzorgsmaatregelen moeten worden genomen bij het verzamelen, bewaren en transporteren van tumorweefsel?
Verzamel tumorweefsels met een hoog gehalte aan tumorcellen zoveel mogelijk en minimaliseer de blootstellingstijd van weefselmonsters aan lucht om de kans op besmetting te verkleinen. Plaats verzamelde tumorweefselmonsters zo snel mogelijk in steriele buizen met speciale monsterconserveringsoplossing en transporteer ze snel naar de testeenheid bij lage temperatuur (ongeveer 4°C) (streef ernaar om binnen 2~4 uur na bemonstering te leveren).
V: Is er een verschil tussen organoïden die uit laesies worden gekweekt en organoïden die uit aangrenzende weefsels worden gekweekt?
Wat zijn de vereisten voor de bemonsteringslocaties van tumorweefsels? Ja, er is een verschil. Tumoren zelf vertonen heterogeniteit, dus het is gebruikelijk om verschillen te zien tussen organoïden die afkomstig zijn van verschillende bronnen. Morfologisch gezien hebben organoïden die afkomstig zijn van primaire laesies de neiging om een meer invasieve structuur te hebben vergeleken met die van aangrenzende weefsels, en lijken ze over het algemeen onregelmatiger. Om fouten in modellering of medicijnscreening te minimaliseren, moeten er meerdere monsters worden genomen van gebieden met een goede activiteit.
V: Welke soorten medicijnen kunnen worden gebruikt voor medicijngevoeligheidstesten van tumororganoïden?
De belangrijkste soorten antitumormedicijnen in de klinische praktijk kunnen worden ingedeeld in drie categorieën: cytotoxische geneesmiddelen (zoals paclitaxel, cisplatine/carboplatine, 5-FU, enz.), doelgerichte geneesmiddelen (geneesmiddelen gericht op EGFR, HER2, VEGFR, enz.) en immunotherapeutische geneesmiddelen in de vorm van immuuncheckpointremmers (PD-1-antilichamen, PD-L1-antilichamen, enz.).
V: Wat is het succespercentage van PDO-teelt?
Het succespercentage van PDO-kweek varieert enigszins, afhankelijk van de bron. De meeste PDO's hebben een succespercentage tussen 63% en 70%, of zelfs hoger, tot 90%, wat grotendeels gecorreleerd is met de activiteit van het weefsel zelf. Bovendien kunnen klinische behandelingen het succespercentage beïnvloeden. Succespercentages kunnen worden verbeterd door de tijd van weefsel ex vivo en operationele stappen te verkorten.
V: Kan ingevroren weefsel gebruikt worden voor de kweek van organoïden?
Over het algemeen wordt cryopreservatie van weefsel niet aanbevolen vanwege het significante verlies van levensvatbaarheid. Echter, als weefsels worden opgeslagen bij -80°C, is het optimale venster voor organoïdekweek binnen 6 weken na conservering. Als weefsels worden opgeslagen in vloeibare stikstof, kan de conserveringstijd langer zijn, maar bij voorkeur niet langer dan zes maanden.
V: Bij het extraheren van primaire cellen zitten er meestal fibroblasten bij. Hoe moet je hiermee omgaan?
(1) Vanwege de slechte hechting van fibroblasten kunnen ze door herhaalde hechting worden verwijderd.(2) Reagentia voor het verwijderen van fibroblasten kunnen worden gebruikt, maar of ze de kweek van organoïden beïnvloeden, moet nog experimenteel worden gevalideerd.
V: Hoeveel origineel tumorweefsel is nodig voor het kweken van tumororganoïden? Is het biopsiemonster voldoende?
Normaal gesproken moeten chirurgische weefsels groter zijn dan 2-3 sojabonen. Als het weefsel via een naaldbiopsie wordt verkregen, zijn er ten minste 2-3 monsters nodig, terwijl voor endoscopische biopsieën ten minste zes of meer tumorweefsels moeten worden afgeklemd.
V: Wat moet er gebeuren als het monster tumorweefsel te klein is en het aantal gekweekte organoïden onvoldoende is voor verder onderzoek?
Omdat organoïden afkomstig van tumorbronnen fenotypische verschillen kunnen vertonen na passage, wordt passage over het algemeen niet aanbevolen. In de literatuur wordt aanbevolen om de passage van organoïden te beperken tot 2-3 generaties, met een maximum van 5 generaties. Als het aantal cellen te klein is en niet aan de testvereisten kan voldoen na 5 generaties, overweeg dan om de testmethode te wijzigen, zoals het gebruik van een kleinere 384-wells plaat of het proberen van microfluïdische chips voor het testen.
V: Zijn er normale cellen in tumorweefsels? Hoe kunnen deze normale cellen verwijderd worden?
Er kan een klein aantal normale cellen zijn. Probeer ten eerste te voorkomen dat er normale weefsels worden bemonsterd tijdens het verzamelen. Ten tweede kan na het extraheren van primaire cellen magnetische kralensortering of flowcytometrie worden gebruikt voor verdere organoïdekweek. Wanneer er een zeer klein aantal normale cellen aanwezig is, heeft dit geen significante invloed op de daaropvolgende organoïdemodellering en -kweek, dus verwijdering is mogelijk niet nodig.
V: Waarom zijn de cellen rood als primaire cellen uit tumorweefsel worden gehaald?
Weefsels zijn rijk aan bloedtoevoer in vivo, dus er zijn veel rode bloedcellen. In de meeste gevallen is hiervoor geen verwerking nodig en heeft het geen invloed op de kweek van organoïden. Als er te veel rode bloedcellen zijn, kunnen ze op de juiste manier worden behandeld met lysisbuffer vóór de kweek.
V: Tijdens de cultivatie van organoïden worden zwarte deeltjes gevonden. Hoe verwijder je deze?
Zwarte deeltjes zijn hoogstwaarschijnlijk onzuiverheden of celresten. Ze kunnen op twee manieren worden verwijderd:
Verteer de organoïden en was ze herhaaldelijk met medium om de onzuiverheden te verdunnen.
Gebruik een steriel chirurgisch mes om de organoïden doormidden te snijden en gebruik vervolgens een 1 ml-spuit gevuld met medium om voorzichtig de onzuiverheden uit de organoïden te spoelen.
V: Is er een limiet aan het aantal passages voor de kweek van organoïden, en hoeveel passages kunnen er worden uitgevoerd?
Het aantal passages hangt over het algemeen af van de eigenschappen van de broncellen. De meeste organoïden kunnen in vitro tot 10 keer worden gepasseerd (>6 maanden). De keuze van de kweekomstandigheden kan ook enige invloed hebben, waarbij geconditioneerd medium over het algemeen beter is dan synthetisch factormedium.
V: Kunnen tumorcellijnen (zoals de HepG2-cellijn) worden gekweekt tot PDO's?
PDO's zijn complexe, zelfgeassembleerde structuren. 3D-cultuursystemen gevormd door enkele cellijnen kunnen niet PDO's worden genoemd; ze worden eenvoudigweg 3D-bolvormige toestanden genoemd.
V: Wat zijn de criteria voor het doorgeven van organoïden?
Afhankelijk van de ontwikkelingsstatus van de organoïden varieert de tijd, meestal tussen 5-10 dagen, met een diameter van ongeveer 100-200μm. Sommige langzaam ontwikkelende organoïden kunnen meerdere weken nodig hebben om een geschikte passagestatus te bereiken.
V: Hoe tel je het aantal levensvatbare organoïden?
Haal tijdens het experiment de vooraf bereide Calcein-AM-bewaaroplossing eruit en voeg Calcein-AM-oplossing toe aan het medium tot een uiteindelijke concentratie van 0,2 μmol/l. Incubeer gedurende 60 minuten bij 37 °C. Spoel na het verstrijken van de tijd het Calcein-AM-bevattende medium langzaam weg met PBS en voeg vers medium toe. Gebruik een fluorescentiemicroscoop met een excitatiegolflengte van 490 nm en een emissiegolflengte van 515 nm om de organoïden te observeren en te fotograferen. Levende organoïden zien er groen uit en hebben duidelijke randen. Tel de organoïden met een diameter > 20 μm.
V: Hoe bereken je de levensvatbaarheid van organoïden?
De levensvatbaarheid van organoïden wordt berekend volgens de formule: X=(Nlive/Ntotal)×100%, waarbij: X de levensvatbaarheid van organoïden weergeeft; Nlive het aantal levende organoïden weergeeft; Ntotal het totale aantal organoïden weergeeft.
V: Welke methoden zijn er om organoïden te identificeren?
De meest basale methode is om de morfologie van organoïden te observeren door een microscoop en H&E-kleuring uit te voeren. Andere methoden omvatten Western Blot, qRT-PCR, immunofluorescentie, flowcytometrie om te detecteren of de organoïden overeenkomstige biomarkers tot expressie brengen. Genetische sequentiebepaling kan de genetische match identificeren tussen de gekweekte organoïden en het bronweefsel. Voor sommige organoïden kunnen functionele testen worden uitgevoerd om te zien of ze specifieke functies bezitten. Studies hebben bijvoorbeeld aangetoond dat maagorganoïden maagzuur kunnen afscheiden en hartorganoïden autonoom kunnen kloppen.
V: Kunnen normale cellen ook uitgroeien tot organoïden? Hoe verwijder je normale organoïden tijdens de kweek van tumororganoïden?
Normale cellen kunnen ook uitgroeien tot organoïden. Methoden om normale organoïden te verwijderen omvatten: (1) Handmatige selectie op basis van HE-kleuringsresultaten onder een microscoop; (2) Zuivering van PDO's door de samenstelling van het kweekmedium aan te passen (zoals groeifactoren/kleine moleculaire remmers); (3) Dispergeren van PDO's in afzonderlijke cellen voor flowcytometrie of magnetische kralensortering.
V: Moeten PDO's tijdens experimenten naar medicijngevoeligheid uit de matrixgel worden verteerd?
Nee, PDO's hebben een driedimensionale structuur nodig om in vivo-omstandigheden te simuleren. Als er geen ondersteuning is van de matrixgel, wordt de nauwkeurigheid van experimenten met medicijngevoeligheid beïnvloed. Over het algemeen kunnen oplosbare medicijnen de matrixgel binnendringen om op organoïden in te werken, maar bij het uitvoeren van immunocytochemische experimenten is het noodzakelijk om de matrixgel te verwijderen.
V: Kunnen PDO-experimenten diermodellen (PDX) volledig vervangen?
PDO's kunnen PDX gedeeltelijk vervangen, maar niet volledig.
V: Wat kunnen de redenen zijn voor de abnormale groei van PDO's tijdens de teelt, gekenmerkt door verkorte groeicycli en snelle proliferatie vergeleken met eerdere omstandigheden?
Externe factoren: (1) Deze afwijking kan worden veroorzaakt door de uitgebreide groei van bepaalde verontreinigende cellen, zoals fibroblasten. In dergelijke gevallen wordt aanbevolen om sectiekleuring en observatie uit te voeren om de aanwezigheid van deze verontreinigde cellen te bevestigen en ze vervolgens te verwijderen. (2) Veranderingen in de kweekomstandigheden, waaronder de toevoeging van bepaalde factoren of kleine moleculen, kunnen de proliferatiepaden van PDO's verder activeren.
Interne factoren: Mogelijke genetische mutaties. Om dit te verifiëren, wordt sequencing aanbevolen en moeten de resultaten worden vergeleken met die van de primaire PDO's om te bepalen of er genetische mutaties zijn.
V: Hoe kan de gevoeligheid van PDO's voor medicijnen worden getest?
PDO's kunnen worden getest op medicijngevoeligheid met behulp van methoden zoals CCK8-test, ATP-celviabiliteitstest en levend/dood-kleuring. Het beoordelen van de ATP-activiteit van tumororganoïden is de meest voorkomende methode. ATP is het belangrijkste energiemolecuul in cellen en kan worden gebruikt om cellulaire metabolische niveaus te meten, wat het aantal levensvatbare cellen weerspiegelt. Op basis van het effect van medicijntoediening op cellulaire ATP-inhoud, kan de IC50-waarde (halfmaximale remmende concentratie van het geteste medicijn) voor elk medicijnregime worden berekend met behulp van analysesoftware om de meest effectieve medicijnen voor tumorremming te selecteren.
V: Zijn de concentratiebereiken voor experimenten met medicijngevoeligheid van PDO's hetzelfde als die voor primaire tumorcellen?
Nee, ze zijn niet hetzelfde. Normaal gesproken moet de medicijnconcentratie voor PDO's hoger zijn dan die voor primaire cellen. Er kunnen voorlopige experimenten worden uitgevoerd om de optimale concentraties voor formele experimenten met medicijngevoeligheid te analyseren.
V: In welk groeistadium moeten organoïden worden gebruikt voor drugstesten?
Het wordt over het algemeen aanbevolen om organoïden binnen 5 passages te gebruiken voor drugstesten. In dit stadium vertonen organoïden de beste stabiliteit en activiteit.
V: Wat zijn de criteria om het succes van de ontwikkeling van organoïden te bepalen?
(1) Vroege voorlopige beoordeling: Organoïde morfologie verandert van een cellulaire staat naar vormen zoals vacuolair, ontluikend, compact of los. (2) Identificatie van specifieke biomarkerexpressie, die vergelijkbaar moet zijn met de distributie in weefselplakken. Verdere sequentieanalyse kan worden uitgevoerd voor meer gedetailleerde vergelijkingen.
V: Waarin verschilt de kweek van organoïden van reguliere celkweek?
(1) Verschillende celcultuurmethoden: Organoïden hebben de ondersteuning van substraten of ruimtelijke structuren nodig om hun driedimensionale structuur te behouden, terwijl reguliere celcultuur dit niet nodig heeft. (2) Organoïdecultuur vereist het bereiken van ex vivo differentiatie en zelfassemblage, waardoor het gebruik van combinaties van verschillende cytokines voor inductie vereist is, wat resulteert in relatief complexe kweekmediumcomponenten. Reguliere celcultuur omvat gewoonlijk slechts één type cel, dus de kweekmediumcomponenten zijn relatief eenvoudig.(3) Verschillende celbronnen: Organoïden zijn afkomstig van multipotente epitheelcellen, terwijl reguliere celkweek geschikt is voor het kweken van verschillende soorten geselecteerde cellen.
V: Hoe kan ik bepalen of de 3D-bollen die ik heb gekweekt, organoïden zijn en of ze overeenkomen met het doelweefsel?
Methoden voor het identificeren van organoïden omvatten H&E-kleuring, immunohistochemie (IHC), single-cell sequencing en andere. Het is noodzakelijk om multidimensionale oordelen te vellen vanuit morfologische, histopathologische en moleculair genetische perspectieven om te bepalen of ze consistent zijn met het doelorgaan of -weefsel. Voor tumororganoïden kan detectie van specifieke biomarkers worden gebruikt voor bevestiging.
V: Als de morfologie van de organoïden die tijdens de kweek worden waargenomen, afwijkt van wat in de literatuur wordt gerapporteerd, wat kan de reden hiervoor zijn?
Ten eerste kunnen er individuele verschillen en heterogeniteit in monsterbronnen en subtypen bestaan. Ten tweede kunnen verschillen in de kwaliteit van geselecteerde cytokines en enkele kleine moleculaire remmers die voor inductie worden gebruikt, leiden tot variaties in de differentiatiemorfologie van verschillende organoïden. Het wordt voorgesteld om de consistentie tussen organoïdemorfologie en bronweefsel te bevestigen door middel van methoden zoals HE-kleuring, IHC en genetische sequentiebepaling, in plaats van alleen te vertrouwen op literatuurbeschrijvingen.
V: Is het bij het uitvoeren van experimenten met organoïden naar medicijngevoeligheid noodzakelijk om de hoeveelheid DMSO die als oplosmiddel voor medicijnen wordt gebruikt, te controleren?
Ja, voor experimenten naar gevoeligheid voor medicijnen moet het volumepercentage DMSO doorgaans minder dan 0,5% zijn.
V: Hoe kunnen organoïden uit de matrixgel worden gewonnen?
De volgende methoden worden aanbevolen: (1) Commercieel verkrijgbare organoïde-hersteloplossingen (CAT#41421ES) kunnen worden gebruikt om op een voorzichtige en effectieve manier celsuspensies te verkrijgen zonder cellen of celoppervlakte-eiwitten te beschadigen. (2) De matrixgel kan worden ontdooid bij een lage temperatuur om deze zachter te maken en de organoïden vrij te geven.
V: Veel organoïden hechten zich aan de wanden van de centrifugebuis tijdens het herstel. Hoe kan het herstelpercentage worden verbeterd?
Bij het centrifugeren na verzameling, gebruik een horizontale rotorcentrifuge en verhoog de centrifugatiesnelheid dienovereenkomstig. Over het algemeen zijn een centrifugale kracht van ongeveer 300 g en een snelheid van ongeveer 1000-1200 tpm geschikt.
| Pproduct Nik ben | KAT | Maat |
| Menselijke Wnt-3a | 92276ES10 | 10μG |
| 92278ES20 | 20μG | |
| 92701ES10 | 10μG | |
| Menselijke Hoofd | 92528ES10 | 10μG |
| 91330ES10 | 10μG | |
| 91306ES10 | 10μG | |
| 91502ES10 | 10μG | |
| 91701ES08 | 10μG | |
| 92602ES60 | 100μG | |
| 91204ES10 | 10μG | |
| 90601ES10 | 10μG | |
| 91113ES10 | 10μG | |
| 92279ES10 | 10μG | |
| 92055ES10 | 10μG | |
| 92053ES10 | 10μG | |
| 92129ES08 | 5μG | |
| 91304ES10 | 10μG | |
| 91702ES10 | 10μG | |
| 92252ES60 | 100μG | |
| 90103ES10 | 10μG | |
| 90104ES10 | 10μG | |
| 90197ES10 | 10μG | |
| 90144ES08 | 10μG | |
| 90196ES10 | 10μG | |
| 90194ES10 | 10μG | |
| 90111ES10 | 10μG | |
| 90120ES10 | 10μG | |
| 90198ES10 | 10μG | |
| 91605ES10 | 10μG | |
| 92251ES10 | 10μG | |
| 92566ES08 | 5μG | |
| 92102ES10 | 10μG | |
| 91103ES10 | 10μG | |
| 92711ES10 | 10μG | |
| 92122ES60 | 100μG | |
| 92201ES60 | 100μG | |
| 92275ES20 | 20μG | |
| Menselijke BMP-2 | 92051ES10 | 10μG |
Gerelateerd leesvoer:
Referentie
