Matriz de membrana de base Ceturegel™ - Sua primeira escolha
Com o avanço da terapia com células-tronco e do desenvolvimento de medicamentos baseados em organoides, a matriz da membrana basal desempenha um papel fundamental como um nutriente e suporte para culturas de células-tronco e organoides, culturas de células 3D e outras aplicações, incluindo angiogênese, experimentos de tumorigênese in vivo, etc. Os extratos de membrana basal Ceturegel™ são extraídos de tumores de camundongo Engelbreth-Holm-Swarm (EHS) ricos em proteínas da matriz extracelular, incluindo laminina, colágeno tipo IV, nestina, etc. IGF, FGF e outros fatores de crescimento. Em temperatura ambiente, a matriz da membrana basal Ceturegel™ polimeriza para formar uma matriz tridimensional biologicamente ativa. Ela pode simular a estrutura, composição, propriedades físicas e funções da membrana basal celular in vivo, o que é benéfico para a cultura e diferenciação de células in vitro e é uma boa alternativa ao matrigel.
1. O que é a matriz de membrana basal Ceturegel™?
2. Qual é o papel da matriz da membrana basal Ceturegel™?
3. Quais são as características da matriz de membrana basal Ceturegel™?
4. A aplicação popular da matriz de membrana basal Ceturegel™
5. Perguntas frequentes
6. Guia de seleção da matriz de membrana basal Ceturegel™ da
1. O que é a matriz de membrana basal Ceturegel™?
A matriz adjacente às células endoteliais, células epiteliais, células musculares e neuronais forma uma matriz extracelular contínua e em camadas chamada membrana basal. A membrana basal degenera e regenera durante o desenvolvimento e a cicatrização de feridas. Ela não apenas dá suporte às células e camadas celulares, mas também desempenha um papel importante na formação de tecidos, afetando a adesão celular, migração, proliferação e diferenciação, que são funções da membrana basal. Portanto, pode-se dizer que a membrana basal é a principal barreira à invasão de células tumorais metastáticas.
Figura 1. A matriz da membrana basal Ceturegel™
A matriz de membrana basal Ceturegel™ desenvolvida e produzida pela YEASEN não contém LDEV (Lactate Dehydrogenase Enhancing Virus) e tem conteúdo de endotoxina ultrabaixo. E após a detecção de micoplasma para garantir que não haja contaminação por micoplasma, incluindo diferentes tipos, como concentração básica, alta concentração e baixo fator de crescimento.
2. Qual é o papel da matriz da membrana basal Ceturegel™?
A matriz de membrana basal Ceturegel™ pode ser usada para preparar matrizes de membrana basal de vários requisitos. Ela pode ser usada para estudos de sinalização celular, como o estudo do papel dos fatores de crescimento na formação de túbulos renais por células-tronco renais de camundongos, o estudo da expressão gênica de células-tronco epiteliais mamárias de camundongos e o experimento de invasão tumoral de Transwell. Ao mesmo tempo, ela pode ser usada para o estudo da morfologia celular, função bioquímica, migração, infecção e expressão gênica. A matriz de membrana basal Ceturegel™ pode ajudar efetivamente na fixação e diferenciação de células epiteliais e outros tipos de células, incluindo células nervosas, células-tronco, células epiteliais de mamíferos, células de melanoma, células endoteliais vasculares, células da tireoide e células do folículo piloso. Ao mesmo tempo, a matriz de membrana basal Ceturegel™ também afeta o nível de expressão proteica de células epiteliais mamárias murinas e auxilia na regeneração do nervo periférico.

Figura 2.As principais direções de aplicação da matriz de membrana basal Ceturegel™
Migração e invasão celular em detalhes: A migração celular, também conhecida como rastejamento celular, movimento ou movimento, refere-se ao movimento das células após receberem um sinal de migração ou sentirem um gradiente de certas substâncias. A migração celular é um processo alternado de extensão de pseudópodes na cabeça da célula, estabelecimento de novas adesões e retração da cauda do corpo celular. A migração celular é uma das funções básicas das células normais e também é um processo fisiológico de crescimento e desenvolvimento normais do corpo. Como uma forma onipresente de movimento de células vivas, ela pode participar de uma variedade de processos fisiológicos e patológicos coletivos. Como desenvolvimento embrionário, angiogênese, cicatrização de feridas, resposta imune, resposta inflamatória, aterosclerose, metástase de câncer, etc. Considerando que a invasão celular se refere à capacidade das células de migrar de uma área para outra através da matriz extracelular. A invasão celular é a resposta de células normais e células cancerígenas a estímulos químicos e mecânicos. A invasão celular geralmente ocorre nos processos de cicatrização de feridas, angiogênese, inflamação, metástase de células tumorais e infiltração anormal de tecidos.
3. Quais são as características da matriz de membrana basal Ceturegel™?
Alta segurança: sem LDEV (vírus com aumento da desidrogenase láctica)
Diversidade de concentração: a faixa de concentração está entre 8~20 mg/ml
Boa estabilidade do lote: rigoroso processo de inspeção de qualidade de produção para garantir desempenho estável entre lotes
Baixa endotoxina: conteúdo de endotoxina <8 UE/ml
Detecção de contaminação: não foram detectados resíduos de micoplasma, bactérias e fungos
Alta produção de lote único: a produção de lote único está acima do nível de 50L
Compatibilidade:Compatível com qualquer tipo de meio de cultura celular
4. A aplicação popular da matriz de membrana basal Ceturegel™
4.1 Ensaio de migração e invasão
O método experimental para detectar a capacidade de migração e invasão celular é o experimento Transwell, e Transwell também é chamado de experimento de perfuração. A suspensão celular é adicionada à câmara primeiro porque a câmara tem poros densos. As câmaras foram então colocadas em uma placa de 24 poços à qual um meio completo foi adicionado. As células se deformaram e passaram por orifícios na câmara para o exterior da câmara mais rica em nutrientes, onde grudaram no exterior. Ao colorir e contar as células fora da câmara, a capacidade de migração e invasão das células pode ser avaliada. O princípio do Transwell é colocar a pequena câmara na placa de cultura, a pequena câmara é chamada de câmara superior e a placa de cultura é chamada de câmara inferior. As camadas superior e inferior do fluido de cultura são separadas por uma membrana de policarbonato, a camada superior do fluido de cultura é adicionada à câmara superior e a camada inferior do fluido de cultura é adicionada à câmara inferior. As células estão na câmara superior e a composição do meio inferior afetará as células na câmara superior devido à permeabilidade da membrana. Além disso, foram investigados os efeitos dos componentes do meio inferior no crescimento e movimento celular.
Operações específicas da matriz de membrana basal Ceturegel™ em ensaios de migração e invasão: A matriz de membrana basal Ceturegel™ diluída foi adicionada à câmara superior do Transwell, e as células foram semeadas e incubadas em uma temperatura de 37°C, 5% de CO2 incubadora por 24 horas, fixada em paraformaldeído 4% e corada com solução de coloração de cristal violeta 0,1%. As células foram observadas e contadas em microscópio de contraste de fase invertido.
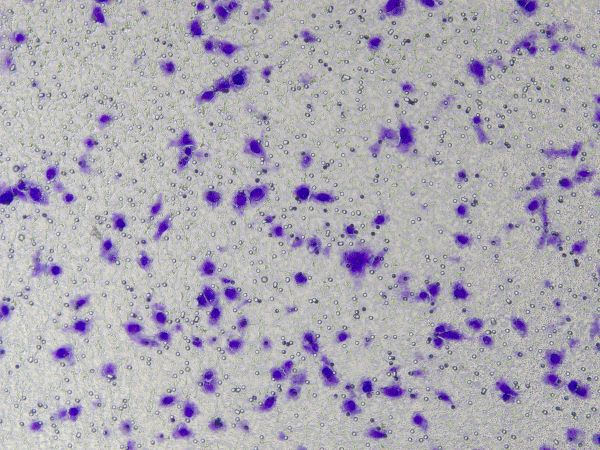
Figura 3. Resultados da coloração com cristal violeta após invasão celular
4.2 Angiogênese
1) Um dia antes do experimento, retire o Ceturegel™ Retire o Matrigel do congelador e coloque-o na geladeira a 4°C durante a noite para descongelar enquanto pré-resfria os consumíveis usados.
2) Sempre mantenha o Ceturegel™ Matrigel em uma caixa de gelo antes do experimento. Abra a embalagem estéril das lâminas angiogênicas e remova as lâminas.
3) Adicione 10 μl de Ceturegel™ Matrigel a cada poço. Observe que a ponta da pipeta deve estar perpendicular ao topo do furo interno ao adicionar Ceturegel™ Matrigel para evitar que o Matrigel flua pelo furo superior e deixe um resíduo de cola.
4) Primeiro cubra a lâmina, prepare uma placa de Petri de 10 cm e coloque toalhas de papel umedecidas em água para formar uma caixa úmida.
5) Coloque as lâminas na placa de Petri e cubra a placa de Petri. Coloque-a em um CO2 incubadora, deixe repousar por cerca de 30 minutos, espere o gel coagular e prepare a suspensão de células ao mesmo tempo.
6) Preparar as células digeridas em uma suspensão celular com densidade de 2*105 células/ml e misture bem.
7) Remova a lâmina de vidro contendo o vaso sanguíneo que se solidificou em um gel. Adicione 50 μl da suspensão de células a cada poço, tomando cuidado para manter a ponta da pipeta verticalmente acima do poço superior e não tocar no gel no poço inferior.
8) Adicione o meio de cultura celular, feche a tampa e deixe repousar. Após algum tempo, todas as células afundarão na superfície do Matrigel.
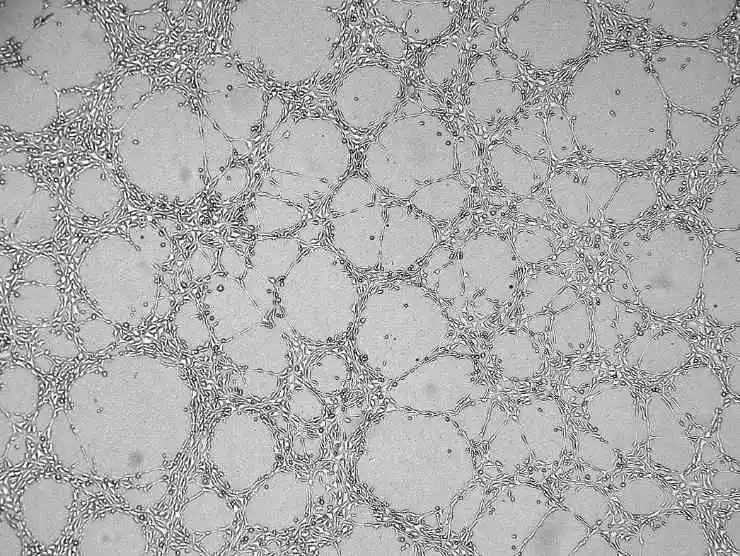
Figura 4. Gráfico de resultados da angiogênese
Coloração por imunofluorescência
1) Remova cuidadosamente o meio dos poços sem tocar na cola ou na rede celular. Dilua a calceína em meio sem soro para uma concentração final de 6–8 µg/ml. Adicione a solução de coloração celular para submergir completamente as células e incube em temperatura ambiente por 30-40 minutos no escuro.
2) Lave três vezes com PBS. Observe que o PBS deve ser adicionado lentamente aos poços superiores para evitar impacto nas células. Observação de fluorescência usando Ex=485 nm, Em=529 nm de comprimento de onda
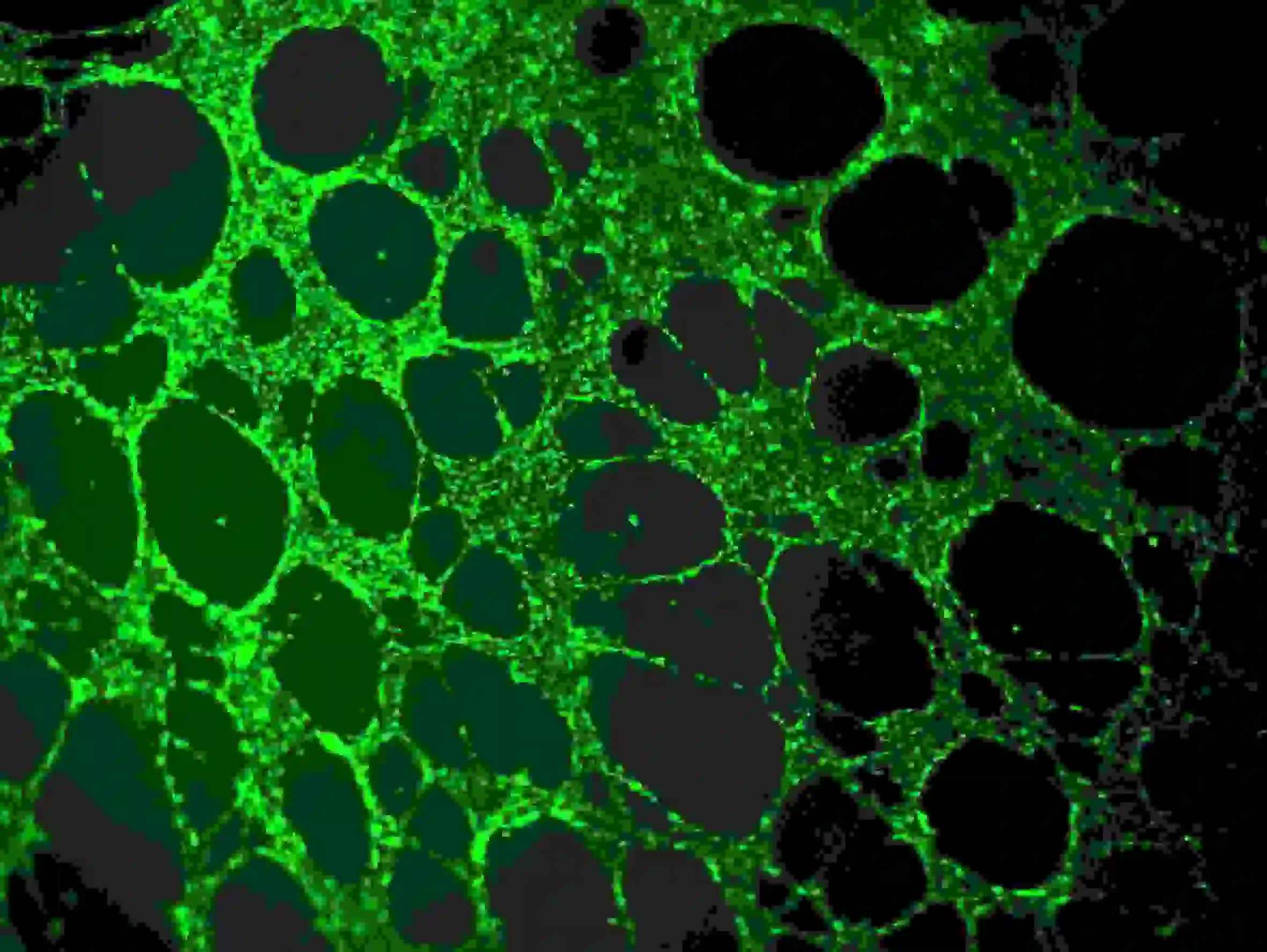
Figura 5. Coloração de imunofluorescência de vasos sanguíneos
4.3 Cultura de células 3D
Diferentemente da cultura celular tradicional, a cultura celular 3D reproduz o ambiente in vivo das células. Mesmo modelos esferoides simples podem compensar as deficiências das culturas de monocamada. Essas estruturas podem formar gradientes de oxigênio, nutrientes, metabólitos e sinais solúveis, que por sua vez formam populações celulares diversas. A tecnologia de cultura celular 3D pode simular melhor o ambiente natural em que as células vivem em organismos, tornando as interações entre células e respostas bioquímicas e fisiológicas mais realistas. Em um ambiente 3D, as respostas das células a estímulos endógenos e exógenos se assemelham mais às suas respostas in vivo.
A operação específica da matriz de membrana basal Ceturegel™ na cultura de células 3D é a seguinte: misture suavemente a matriz de membrana basal Ceturegel™ com a concentração ajustada de suspensão de célula única HepG2 1:1 e adicione 50 μl da suspensão de célula única misturada acima à placa de 24 poços pré-resfriada com uma ponta de pipeta pré-resfriada para formar gotículas de células em forma de arco que foram cultivadas em uma incubadora a 37 °C e 5% de CO2, observadas e fotografadas todos os dias.
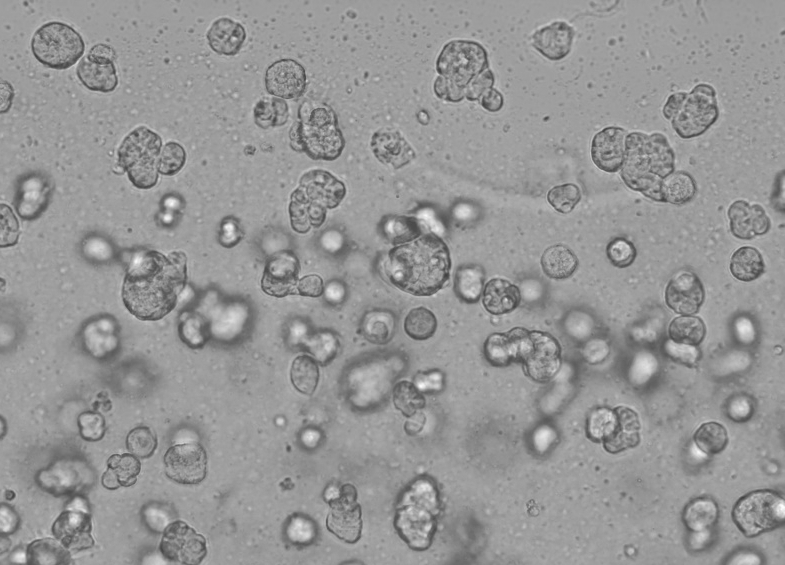
Figura 6. Resultados da cultura de células 3D
Tabela 1. Matriz de membrana basal Ceturegel™ para cultura de células 3D Referência de uso:
| Tipo de placa de cultura (prato) | Área de cultura celular (cm2) | Medição de uso (concentração ≥ 3 mg/mL)* |
|---|---|---|
| Placa de 6 poços | 9.6 | 200 μL/cm2 |
| Placa de 12 poços | 4.5 | 180 μL/cm2 |
| Placa de 24 poços | 2.0 | 180 μL/cm2 |
| Placa de 96 poços | 0,32 | 160 μL/cm2 |
| 35mm prato | 11,78 | 200 μL/cm2 |
| 100 mm prato | 58,95 | 200 μL/cm2 |
Nota: Diferentes lotes de matriz de membrana basal Ceturegel™ apresentam uma certa diferença de concentração, a dosagem recomendada é apenas para referência
4.4 Experiência de formação de tumor in vivo
Tomando como exemplo o experimento de tumorigênese subcutânea de células HepG2 em camundongos nus, a matriz de membrana basal Ceturegel™ e a suspensão celular foram usadas para diluição 1:1, e camundongos fêmeas BALB/c-nu com idades entre 4 e 5 semanas foram inoculados subcutaneamente. O processo experimental é o seguinte:
♦ Prepare células HepG2 com crescimento logarítmico e densidade celular de cerca de 80-90% e troque o meio fresco na noite anterior à coleta das células.
♦ As células são digeridas pela tripsina. Quando as células se tornam redondas e não saem da placa de cultura, a tripsina é removida, o meio sem soro é adicionado para fazer a suspensão celular, centrifugado e limpo uma vez, e a concentração final é 5 × 107 células/mL.
♦ Diluir a suspensão de células e a matriz da membrana basal Ceturegel™ na proporção de 1:1 a 4 ℃ para preparar uma concentração final de 5 × 107 células/mL.
♦ Pegue um camundongo nu fixo com a mão esquerda e injete-o subcutaneamente no ombro direito do camundongo nu. Durante a inoculação, a agulha é inserida subcutaneamente um pouco mais fundo, cerca de 1 cm de profundidade, para reduzir o transbordamento da suspensão de células do orifício da agulha após a injeção.
O volume de inoculação é de 200 μ L。 (Este processo deve ser concluído dentro de meia hora, na medida do possível. No caminho, a suspensão de células deve ser colocada no gelo para retardar a apoptose celular e evitar o fenômeno do gel).
♦ Coloque os ratos nus de volta na gaiola para continuar se alimentando, e o tumor poderá ser visto por cerca de 1 semana a 1 mês.De acordo com o delineamento experimental, sacrifique os camundongos nus quando o volume do tumor atender aos requisitos e tire fotos.
Nota: O grupo de controle é a suspensão do meio de cultura e células, e a densidade final é a mesma do grupo de teste da cola de matriz.
4.5 Cultura organoide
Organoides são tecidos minúsculos multicelulares 3D diferenciados de células-tronco. Algumas propriedades dos órgãos podem ser reproduzidas. Organoides são multicelulares e exibem um alto grau de automontagem e, portanto, são mais capazes de exibir respostas e interações celulares complexas in vivo do que culturas 2D tradicionais. Células-tronco e/ou células progenitoras de órgãos de tecidos normais ou doentes podem ser misturadas com matriz de membrana basal Ceturegel™ ou colágeno. Formam rim, tireoide, fígado, cérebro, pulmão, intestino, próstata e outros micro-órgãos. Por exemplo, para pesquisadores que conduzem triagens genéticas, substratos de matriz de membrana basal Ceturegel™ podem ser usados como biotintas para permitir a localização precisa e a incorporação de células vivas/organoides em bioimpressão 3D.
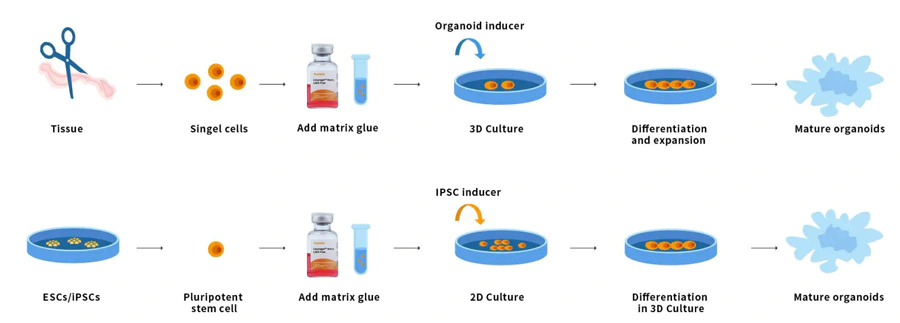
Figura 7. Processo de operação do organoide
Construção de organoides do intestino delgado de camundongo
Preparação da amostra: Os camundongos foram mortos cortando seus pescoços, e a superfície foi borrifada com álcool para esterilização. Corte o tecido intestinal 3~15cm perto da extremidade gástrica sob o ambiente estéril, remova cuidadosamente o mesentério e a gordura fora do trato intestinal com pinças, e coloque-o na solução DPBS contendo 1% de anticorpo duplo pré-resfriado a 4 ℃.
Limpeza da amostra: use uma seringa para enxaguar o trato intestinal 2 a 3 vezes, use uma tesoura cirúrgica para cortar cuidadosamente o trato intestinal com a cavidade intestinal voltada para cima e use uma lâmina cirúrgica para raspar suavemente as vilosidades intestinais na superfície da cavidade intestinal e, depois que as vilosidades intestinais forem raspadas (mostrando tecido transparente), coloque o tecido intestinal em uma nova placa de cultura contendo DPBS por 2 a 3 vezes.
Tratamento inicial das amostras: corte o tecido intestinal delgado lavado em pedaços pequenos de 2 mm de largura e, em seguida, transfira-os para um novo tubo de centrífuga de 50 ml. Lave-os suavemente de 3 a 5 vezes com DPBS para remover células de vilosidades intestinais e tecido adiposo flutuante.
Digestão da amostra: adicione 10-15 ml de DPBS pré-resfriado contendo 3-5 mM de EDTA aos fragmentos limpos do intestino delgado para digestão, incubar a 4 ℃ por cerca de 30 minutos e agitar suavemente o tubo de centrífuga a cada 10 minutos durante esse período.
Após a digestão, descarte o sobrenadante da solução de digestão com EDTA e enxágue suavemente os tecidos com nova solução tampão DPBS 2 a 3 vezes para remover o EDTA restante.
Adicione 10-15 ml de DPBS pré-resfriado contendo 0,1% de BSA nos fragmentos de tecido do intestino delgado, sopre e ressuspenda os fragmentos de tecido repetidamente para separar o recesso da camada basal, então pegue uma pequena suspensão para exame microscópico. Quando um grande número de estruturas semelhantes a recessos forem vistas, pare de soprar e use 70% para a suspensão de tecido soprada μM Filter screen para filtrar e coletar a suspensão de tecido que passa pela tela do filtro.
Repita as etapas 5 e 6 duas vezes e centrifugue a 1500 rpm e 4 ℃ por 3 min.
Formação da mistura: precipitação de tecido de recesso de suspensão pesada de cola Matrix Ceturegel™, cada suspensão de cola matrix de 10 μL contém 200~600 recessos. Após a ressuspensão, a mistura é colocada no gelo e operada o mais rápido possível para evitar que a cola matrix forme gel.
Nota: taxa de diluição da cola da matriz ≥ 50% para garantir a estabilidade da estrutura adesiva da matriz no processo de cultura do Ceturegel™.
Coloque a suspensão misturada no centro da parte inferior da placa de 24 poços, 30~50 μL por poço à esquerda e à direita para evitar que a suspensão entre em contato com a parede lateral da placa de orifício.
Coloque a placa de cultura cultivada na incubadora com temperatura constante de dióxido de carbono a 37 ℃ e incube por cerca de 30 minutos até que o gel da matriz se solidifique.
Aguarde o Ceturegel™. Depois que a cola da matriz estiver completamente solidificada, adicione lentamente o meio de cultura de órgãos intestinais preparado ao longo da parede, 800 μL por poço.
Coloque a placa de 24 poços na incubadora de dióxido de carbono a 37 ℃ para cultura. Substitua o meio fresco a cada 3 dias e monitore o status de crescimento de um órgão como órgãos. Geralmente, o órgão do intestino delgado como órgãos de camundongos é formado dentro de 5-7 dias.
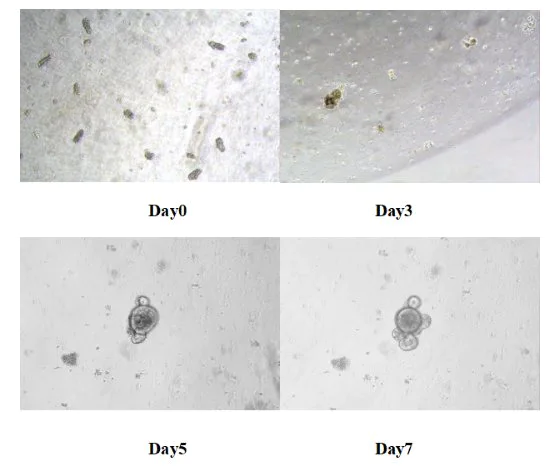
Figura 8. Resultados da cultura in vitro de órgãos semelhantes ao intestino delgado de camundongos
5. Perguntas frequentes
1. Qual é o motivo da diferença de cor (amarelo claro para vermelho escuro) do substrato obtido?
Para a matriz da membrana basal Ceturegel™ contendo vermelho de fenol, é causada principalmente pela interação do vermelho de fenol e do bicarbonato com CO2, mas a diferença de cor será reduzida após o equilíbrio com 5% de CO2. Após congelar e descongelar, agite o frasco suavemente para dispersar uniformemente a matriz da membrana basal Ceturegel™.
2. Quais questões devem ser observadas na operação da matriz de membrana basal Ceturegel™?
Todas as operações devem ser realizadas em um ambiente estéril, e uma pipeta pré-resfriada deve ser usada para garantir que a matriz da membrana basal Ceturegel™ seja homogeneizada.
3. Como congelar e armazenar a matriz de membrana basal Ceturegel™ para uso?
A matriz de membrana basal Ceturegel™ Matrix LDEV-Free congelada e descongelada pode ser distribuída em vários tubos pequenos. Todas as distribuições devem ser em criotubos pré-resfriados, que devem ser rapidamente congelados e armazenados para evitar congelamentos e descongelamentos múltiplos. Todos os itens envolvidos devem ser pré-resfriados antes do uso. Use pipetas, pontas e tubos pequenos pré-resfriados para manusear a matriz de membrana basal Ceturegel™.
6. Guia de seleção da matriz de membrana basal Ceturegel™ da Yeasen
Diferentes tipos de matriz de membrana basal Ceturegel™ têm diferentes aplicações. Concentrações padrão de matriz de membrana basal Ceturegel™ podem ser usadas para culturas de células polares, como células epiteliais. Ela pode promover a diferenciação de várias células e ser usada para experimentos de migração e invasão de células tumorais. Altas concentrações de matriz de membrana basal Ceturegel™ são amplamente usadas in vivo e podem ser usadas para experimentos de formação de túbulos. A principal função do fator de baixo crescimento (TFG) é eliminar a interferência de fatores de crescimento no experimento, e é adequada para estudos com altos requisitos para preparação de membrana basal. A matriz de membrana basal Ceturegel™ sem vermelho de fenol pode eliminar a interferência do indicador vermelho de fenol e é adequada para experimentos de desenvolvimento de cor, como colorimetria e detecção de fluorescência. A matriz de membrana basal Ceturegel™ de grau de cultura de células-tronco embrionárias humanas é especialmente usada para cultura de células-tronco embrionárias humanas, cultura de células-tronco pluripotentes induzidas sem alimentador. A
Tabela 2. Guia de seleção de matriz Ceturegel™
| Tipo de produto | Cat No. | Nome do produto | Nº do gato Matrigel. | Direção de aplicação |
| Concentração básica (8-12 mg/ml) | 40183ES | 356234/ 354234 | Adapta-se a experimentos de cultura, invasão e migração 2D e 3D e também pode ser usado para experimentos tumorigênicos in vivo | |
| 40184ES | 356237 | Usado principalmente para detecção de cores, como experimentos de detecção de fluorescência, etc. | ||
| Redução do fator de crescimento
| 40185ES | 354230 | Principalmente para excluir a interferência de fatores de crescimento no experimento. Aplicado a pesquisas relacionadas a fatores de crescimento, vias de sinalização, etc. | |
| 40186ES | 356231 | |||
| Alta concentração (≥18mg/ml) | 40187ES | 354248 | Usado principalmente em experimentos como angiogênese, embolização de gel e formação de tumor in vivo (para angiogênese, é recomendado que a concentração final da matriz de membrana basal Ceturegel™ seja ≥10mg/ml) | |
| 40189ES | Ceturegel™ Matrix Alta Concentração, GFR, LDEV-Free | 354263 | ||
| 40188ES | Ceturegel™Matrix Alta Concentração, Sem Vermelho de Fenol, Sem LDEV | 354262 | ||
| Para células-tronco | 40190ES | 354277 | Usado principalmente para cultura de células-tronco, como hESC, iPSC, etc. | |
| Específico de organoide | 40191ES | Ceturegel™Matriz para cultura de organoides, sem vermelho de fenol, sem LDEV | 356255 | Matriz de membrana basal Ceturegel™ para cultura de organoides |
