Обзор ДНК-лигазы Т4
Какие ферменты ученые используют для связывания нового гена? Само собой разумеется, ДНК-лигаза включена. Так почему же ДНК-лигаза так важна в рекомбинантной ДНК? Потому что ДНК-лигаза отвечает за лигирование целевого фрагмента с вектором, что является одним из ключевых элементов, определяющих успех эксперимента. Какую роль играет ДНК-лигаза T4 как разновидность ДНК-лигазы в экспериментах по молекулярному клонированию? Как она работает? Далее будет подробно представлена ДНК-лигаза T4.
1. Что такое ДНК-лигаза Т4?
2. Какова функция ДНК-лигазы Т4?
3. ДНК-лигазу Yeasen Biotech T4 можно использовать для лигирования адаптера NGS.
4. Руководство по выбору ДНК-лигазы Yeasen Biotech T4
1. Что такое ДНК-лигаза Т4?
ДНК-лигаза T4 — это АТФ-зависимая лигаза, катализирующая реакцию лигирования между молекулами ДНК. Она в основном образует фосфодиэстер, связывая 3'-гидроксильные и 5'-фосфатные концы. ДНК-лигазы участвуют в процессах репликации и репарации ДНК во всех организмах. Кодируемая фагом ДНК-лигаза T4 вырабатывается во время заражения E. coli фагом T4.
Лигазы, используемые в генной инженерии, в основном представляют собой ДНК-лигазу E. coli и ДНК-лигазу T4, причем последняя в настоящее время используется более широко. ДНК-лигаза T4 может восстанавливать одноцепочечные разрывы на двухцепочечной ДНК, двухцепочечной РНК или гибридных цепях ДНК/РНК для соединения двух соседних нуклеотидов и играет важную роль в восстановлении и рекомбинации ДНК.
В процессе конструирования рекомбинантной плазмиды ДНК-лигаза T4 может использоваться вместе с рестриктазами для завершения эксперимента по конструированию рекомбинантной плазмиды. Она может катализировать образование фосфодиэфирной связи между концом 5'-P и концом 3'-OH двухцепочечной ДНК и имеет хорошую эффективность соединения для липкого конца и тупого конца.
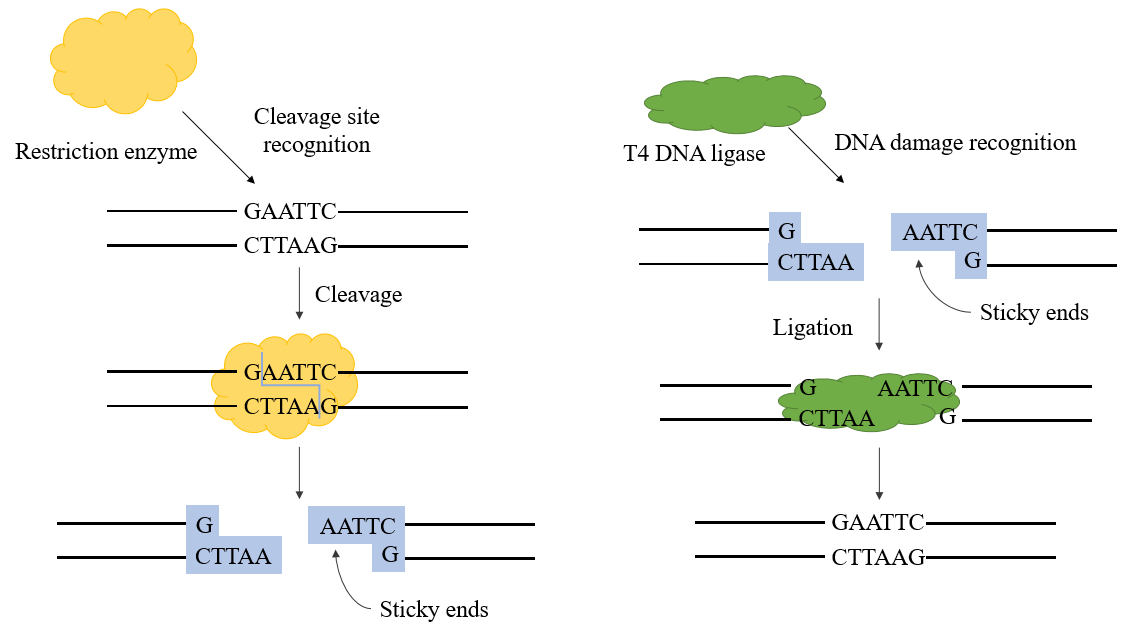
Рисунок 1. Механизм ДНК-лигазы Т4
2. Какова функция ДНК-лигазы Т4?
2.1 Построение вектора
В экспериментах по конструированию векторов различные рестриктазы могут производить различные типы концов. Для разных концов ДНК-лигаза Т4 будет иметь различные стратегии лигирования.
2.1.1 Клонирование с помощью рестриктаз, липкие концы, полученные путем однократного переваривания
Во время построения вектора, если та же самая эндонуклеаза рестрикции используется для разрезания фрагмента ДНК целевого гена и векторная молекула может производить тот же самый липкий конец, ДНК-лигаза T4 может напрямую осуществлять рекомбинационное соединение. Однако, поскольку липкие концы одинаковы, целевой ген может быть вставлен в вектор в прямом или обратном направлении, что легко увеличит рабочую нагрузку скрининга для правильных рекомбинантных клонов. Рассмотрите возможность использования метода двухферментного переваривания для построения вектора.
Кроме того, липкие концы вектора, полученные путем одноферментного расщепления, также могут быть спарены, а затем между нуклеотидами под действием ДНК-лигазы Т4 образуются фосфодиэфирные связи, что приводит к самолигированию вектора. Использование щелочной фосфатазы для обработки переваренного вектора может удалить фосфатную группу на 5'-конце вектора, так что вектор не сможет завершить самолигирование. Таким образом, под действием ДНК-лигазы Т4 вектор и целевой фрагмент соединяются для завершения построения рекомбинантного вектора.
2.1.2 Клонирование с помощью рестриктаз, липкие концы, полученные путем двойного переваривания
В процессе построения вектора, если два рестрикционных фермента с разными липкими концами используются для переваривания целевого фрагмента и вектора соответственно, могут быть получены два разных липких конца. На этом этапе ДНК-лигаза T4 может выборочно лигировать одни и те же липкие концы, чтобы гарантировать, что целевой фрагмент вставлен в вектор в правильном направлении. Когда целевой фрагмент и вектор на рисунке 2 перевариваются EcoR I и BamH I одновременно, могут быть соединены одни и те же липкие концы. Существует только одно направление лигирования между целевым фрагментом и вектором.

Рисунок 2. Лигирование липких концов, полученное в результате расщепления двойным ферментом.[1]
2.1.3 Клонирование рестрикционных фрагментов, тупой конец
Некоторые эндонуклеазы рестрикции также могут генерировать тупые концы во время ферментативных расщеплений, такие как Sma I и другие. ДНК-лигаза T4 может напрямую образовывать фосфодиэфирную связь между вектором и вставкой, и нет необходимости в спаривании между основаниями. Однако этот метод имеет низкую эффективность лигирования и склонен к самолигированию вектора. Как правило, тупые концы можно преобразовать в липкие концы, а затем лигировать. Например, добавление комплементарных оснований поли А и поли Т к концам целевого фрагмента и вектора и искусственно липких комплементарных концов соответственно повышает эффективность соединения с помощью терминальной дезоксинуклеотидилтрансферазы.
2.1.4 Клонирование ТА
Вектор T, используемый при клонировании TA, имеет T-выступ на 3'-конце. Когда последовательность ДНК целевого фрагмента неясна, фрагмент целевого гена может быть присоединен к вектору T с помощью клонирования TA, а целевой ген может быть определен путем секвенирования. ДНК-полимераза Taq, используемая в ПЦР, обладает терминальной трансферазной активностью и может добавлять нуклеотид «A» к 3'-концу фрагмента ДНК. ДНК-лигаза T4 может напрямую присоединять продукт, амплифицированный ДНК-полимеразой Taq, к вектору T, и амплифицированный ПЦР продукт может достичь цели эффективного клонирования без добавления искусственных адаптеров.
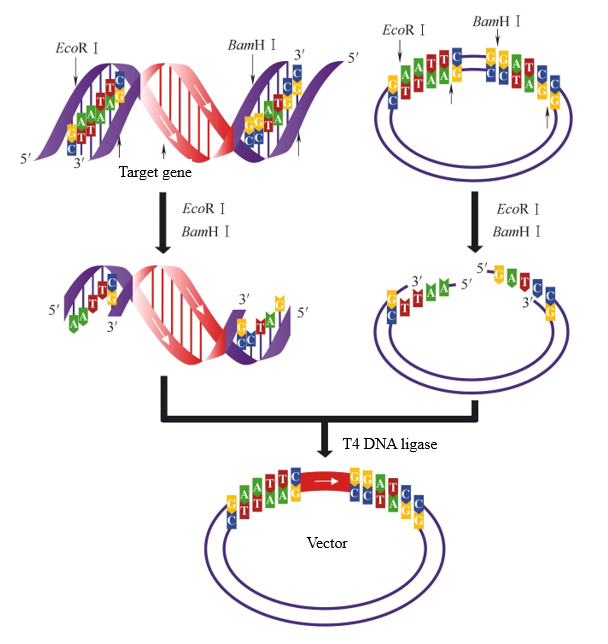
Рисунок 3. Рабочий процесс клонирования ТА[2]
2.2 Лигирование адаптера NGS
Во время построения библиотеки секвенирования следующего поколения необходимо соединить искусственный адаптер с продуктом ПЦР, прежде чем он может быть зафиксирован на проточной ячейке на чипе секвенирования для завершения секвенирования. Создание библиотеки лигирования TA-клонирования является очень распространенным техническим средством, и его принцип аналогичен вышеупомянутому TA-клонированию. После того, как фрагмент ДНК, который должен быть секвенирован, фосфорилируется на 5'-конце и "A" добавляется на 3'-конце, он становится комплементарным и спаривается с адаптером с липким концом "T". Затем полная двойная цепь формируется и секвенируется машиной.
Во время лигирования ТА различные типы образцов или сложность структуры фрагмента нуклеиновой кислоты будут влиять на эффективность лигирования, поэтому адаптеры различных платформ также будут оказывать влияние на конечный результат библиотеки.
Например, адаптер Bubble платформы MGI имеет особую вторичную структуру и требует очень высокой эффективности лигирования для ДНК-лигазы T4, а снижение эффективности лигирования напрямую влияет на выход библиотеки.
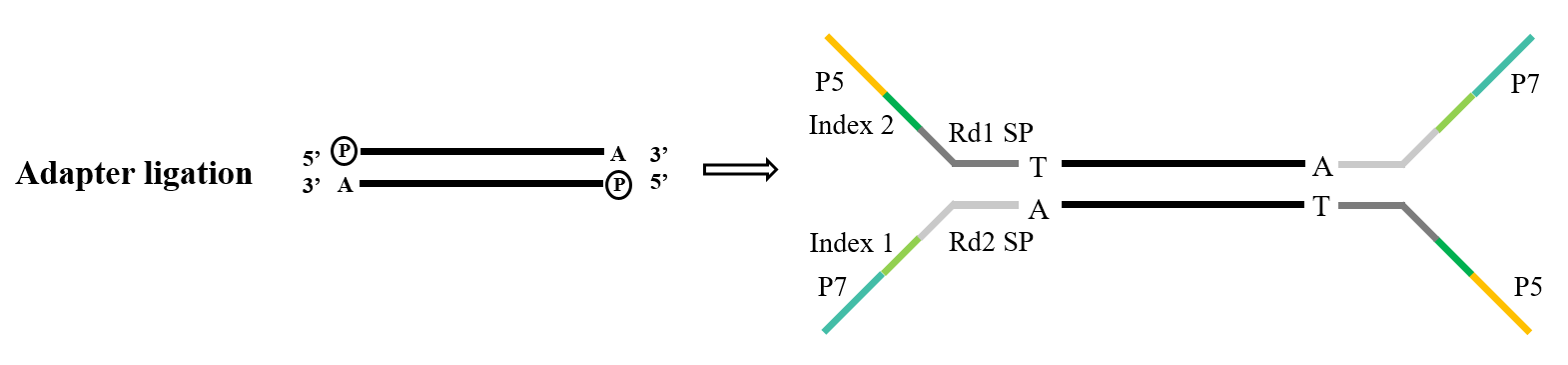
Рисунок 4. Общий процесс лигирования адаптера
3.ДНК-лигазу Yeasen Biotech T4 можно использовать для лигирования адаптера NGS
Специально разработано Yeasen Biotech Быстрая ДНК-лигаза Т4 для лигирования фрагментов ДНК и адаптеров в процессе построения библиотеки NGS. Фермент обладает эффективной способностью лигирования, не только высокой скоростью соединения, но и совместимостью с различными типами образцов, что более выгодно для соединения фрагментов нуклеиновых кислот со сложными структурами. В настоящее время это было проверено высокопроизводительным секвенированием большого количества клиентов. Для соединения адаптеров Bubble на платформе MGI также может быть получено превосходное качество секвенирования.
3.1 ДНК-лигаза Yeasen Biotech Fast T4 со сверхвысокой эффективностью лигирования
Используйте ДНК-лигазу Yeasen Biotech Fast T4 для создания библиотек с различными типами адаптеров. Образец представляет собой имитатор cfDNA размером 170 п.н., а библиотека Agilent 2100 используется для обнаружения результатов. ①Несвязанный адаптерный продукт; ②Одноконцевой адаптерный продукт; ③Двухконцевой адаптерный продукт; ④Остаточный адаптер. Из результатов видно, что эффективность лигирования одноконцевых и двухконцевых адаптеров очень высока.
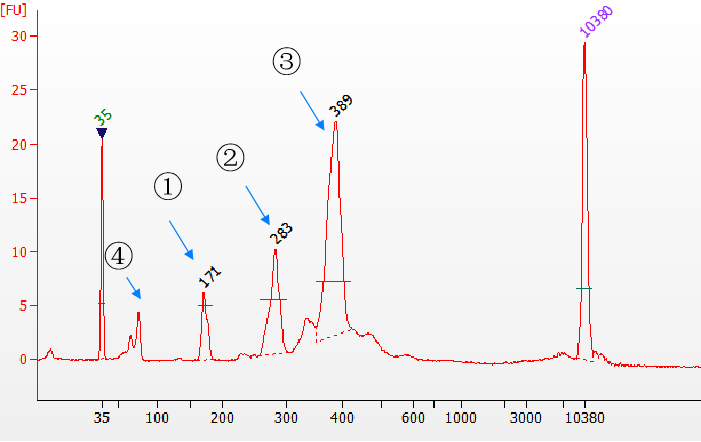
Рисунок 5. Различные типы продуктов лигирования, обнаруженные Agilent 2100
3.2 Быстрая ДНК-лигаза T4 от Yeasen Biotech с превосходным выходом библиотеки
Использование быстрой ДНК-лигазы Т4 для различных типов построения библиотек позволяет получить лучшие результаты по сравнению с другими ДНК-лигазами Т4.
Таблица 1. Выход библиотек различных видов образцов
| Типы образцов | ДНК кишечной микробиоты | cfDNA | FFPE HD200 гДНК | |||
| ДНК-лигаза Т4 (та же единица) | Йесен | Н* | Йесен | Н* | Йесен | Н* |
| Входная ДНК (нг) | 10 | 10 | 50 | |||
| Номер цикла амплификации | 10 | 10 | 8 | |||
| Средний выход (мкг) Платформа Иллюмина | 3.3 | 2.8 | 2.7 | 2.2 | 3 | 2.5 |
| Средний выход (мкг) Платформа MGI | 2.7 | 0.9 | 2.0 | 0,7 | 2.3 | 0,8 |
4. Руководство по выбору ДНК-лигазы Yeasen Biotech T4
Yeasen — биотехнологическая компания, занимающаяся исследованиями, разработкой, производством и продажей трех основных биологических реагентов: молекул, белков и клеток. Помимо Fast T4 DNA ligase, Yeasen Biotech также имеет Новая ДНК-лигаза Т4 и Быстрая ДНК-лигаза Т4 на выбор. Вы можете выбрать их на основе приложений, отображенных в следующей таблице:
Таблица 2: Сопутствующие товары
| Позиционирование продукта | Название продукта | Кот# | Приложение |
| Универсальный | ДНК-лигаза Hieff™ Gold T4 (Запросить) | 10300ES | Молекулярное клонирование. |
| Универсальный | 10301ES | Строительство библиотеки NGS. | |
| Высокая эффективность лигирования и низкий уровень заражения кишечной палочкой остатки | 10299ES | Создание библиотеки NGS, особенно подходящей для обнаружения патогенов, обнаружения НИПТ и т. д. | |
| Высокая чувствительность | 10298ES | Создание библиотеки NGS, особенно подходящей для создания библиотеки образцов cfDNA. |
Ссылки
[1] В. Юань. Генная инженерия[M]. Chemical Industry Press, 2019.
[2] Кларк Д. П., Паздерник Н. Дж., Макги М. Р. Клонирование генов для синтетической биологии - ScienceDirect[J]. Молекулярная биология (третье издание), 2019:199-239.
[3] Томкинсон AE, Виджаякумар S, Паскаль JM и др. ДНК-лигазы: структура, механизм реакции и функция [J]. Chemical Reviews, 2006, 106(2):687-699.
[4] Шуман С. ДНК-лигазы: прогресс и перспективы [J]. Журнал биологической химии, 2009, 284(26):17365-17369.
