
HCP檢測的概念與必要性
生物製品通常利用重組技術在宿主細胞(如細菌、酵母、哺乳動物、昆蟲或植物細胞)中生產,包括單株抗體、重組蛋白和疫苗。這些產品的製造和純化過程中不可避免地會引入宿主細胞蛋白(HCP)作為雜質,既包括宿主細胞的結構蛋白,也包括宿主細胞分泌的生長因子,形成具有各種物理化學和免疫學特性的複雜混合物。儘管使用了先進的純化技術,但一些宿主細胞蛋白質仍可能作為製程相關的雜質殘留在中間藥物產品中。
這些雜質具有潛在的免疫原性,可能增強生物製藥產品的免疫原性反應,影響其穩定性和功效,對人類安全構成風險。因此需要建立適當的HCPs去除監控策略,並控制最終產品中HCPs的含量,以滿足藥品品質的要求。
醫療保健人員的監管要求
生物製品中HCPs的殘留量通常被認為是產品的關鍵品質屬性(CQA)、製程穩健性監控的重要評估指標、產品的關鍵品質控制指標。各國監管機構對於HCP均有規定,要求對生物製藥進行分析和純化,以將宿主細胞蛋白HCP降低到可接受的水平。 HCP 的接受程度將根據具體情況進行評估,並取決於劑量、給藥頻率、藥物類型和疾病嚴重程度等多種因素。
中國藥典(2020年版)規定:對於CHO細胞,殘留HCP需<0.05%(相當於小於500ppm);對於大腸桿菌,殘留HCP需要<0.01%。
美國藥典USP<1132>章節規定:應採用高靈敏度的方法來檢測藥物中的HCP,含量應低於檢測極限(通常小於100 ppm,即1 mg總蛋白中HCP含量應小於100 ng,或<0.01%)。
歐洲藥典EP 2.6.34規定:生物製品中,HCPs的含量應小於0.1%。
人用藥品註冊技術要求國際協調會(ICH)指導原則:ICH Q6B規定應採用靈敏且經過驗證的方法來監測殘留的HCP,殘留量通常要求低於100 ppm。
可以看出,監管機構對於HCP的要求高度一致。生物製品製程開發必須經過HCP檢測,證明純化製程可將HCP降低至安全水平,且中美兩國均建議最終產品中的殘留含量限值低於0.01%。
HCP 檢測方法
酵素連結免疫吸附試驗(ELISA)是目前最常使用的HCP檢測方法。中國藥典2020年版第3412/3413/3414章中提到的宿主蛋白殘留檢測方法均為ELISA方法。
美國藥典USP<1132>章節中也提到可採用電泳、ELISA、LC-MS/MS等方法檢測HCP含量,其中ELISA由於操作簡便、快速、靈敏度高、通量高等特性被推薦為HCP檢測的首選方法。
酵素連結免疫吸附試驗(ELISA):
目的: 檢測HCP中蛋白質的總量,可用於產品開發和製程控制,是目前檢測HCP的常用方法。
優點: 高靈敏度和特異性;高吞吐量和自動化能力;定量的;操作簡便、快速。
缺點: 需要特定的抗體;無法具體識別和評估個別HCP;方法開發複雜,需要特殊的抗原製備;此方法的影響因素較多,HCP覆蓋率需要評估;無法辨別種類。

蛋白質印跡法:
目的: 用於對大量樣本進行一致性篩檢,檢測與抗HCP抗體反應的未知蛋白質。適用於檢測HCP並提供有關HCP相對分子量的近似資訊。
優點: 特異性;結果直觀:可視化蛋白質大小和表現量的差異;可以檢測並量化特定的 HCP。
缺點: 半定量;侷限於特定的蛋白質:只能檢測與抗體結合的HCP;對於複雜的蛋白質混合物不夠敏感;蛋白質SDS變性可能導致構象表位的喪失;敏感性取決於多克隆抗體的品質。
雙向凝膠電泳(2-DE):

目的: 它通常用於上游或下游製程開發和表徵,可以區分單一凝膠上的不同 HCP。
優點: 無需進行Western印跡法,避免了轉移問題;可以從產品中分離出微量的HCP雜質;提供有關相對分子量和等電點的近似資訊。
缺點: 過多的蛋白質可能會掩蓋HCP斑點;可以觀察樣本中 HCP 的分佈,但無法量化。

質譜分析:
目的: 識別單一 HCP,為宿主細胞蛋白質提供準確的識別和定量資訊。
優點: 高解析度和準確度;識別並監控單一 HCP;提供全面的 HCP 光譜;可以涵蓋廣泛的蛋白質;可以辨識HCP物種。
缺點: 設備和技術要求高;操作複雜;成本高;方法通量低;複雜的樣品前處理;潛在的基質效應;需要專業的數據分析能力。
ELISA是各國藥典建議的檢測生物製品中HCP殘留的方法,可以測定HCP的總量。但它在識別HCP的類型和豐度方面存在局限性,需要藉助其他方法進行補充。每種檢測方法都有其優點和缺點,實際應用中,可根據實驗目的、樣品特性、準確度、操作方便等因素進行選擇,結合使用不同的方法,以獲得更全面、準確的結果。
此外,還有美國藥典USP<1132>和歐洲藥典EP 2.6.34。 HOST-CELL PROTEIN ASSAYS指出在產品研發的不同階段應使用不同的ELISA試劑進行HCP檢測,將HCP檢測方法分為商業化試劑、產品/製程特定方法、平台方法。
USP<1132>提到,在缺乏平台方法的情況下,商業試劑可用於臨床前、I期和II期臨床試驗;在III期臨床試驗/製程驗證及產品上市後,由於商業化通用HCP檢測試劑的抗體覆蓋率不足等限制,應考慮細胞類型、製程特異性等因素,採用平台方法或針對產品/製程的方法進行上游製程開發。
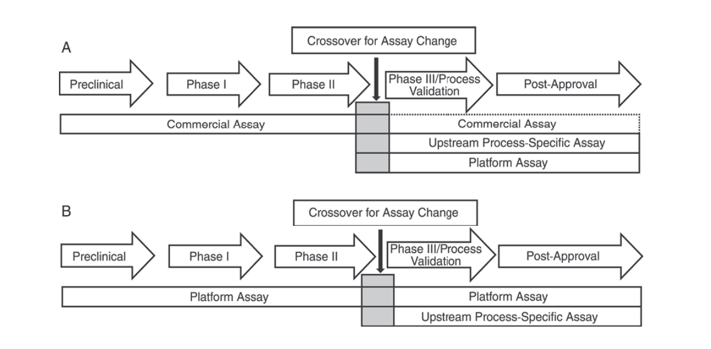
圖 1. 在 USP <1132> 中,建議在產品開發的不同階段使用特定方法檢測 HCP。
| 方法 | 商業試劑盒 | 產品/製程特定檢測 成套工具 | 平台檢測 成套工具 |
| 可用性 | 隨時可用
| 需要製備抗原,包括克隆宿主細胞系
| 需要使用裸細胞或空載體細胞系製備抗原
|
| 發展 | 只需極少的準備 | 檢測開發(包括抗原表徵、免疫和確認)通常需要至少 6 個月 | 檢測開發(包括抗原表徵、免疫和確認)通常需要至少 9 個月 |
| 多樣性 | 僅限於最常見的表達系統 | 可以使用各種類型的表達系統 | 可以使用各種類型的表達系統 |
| 特異性 | 特異性可能較差,可能存在未被發現的 HCP
| 特異性通常會增強,抗體覆蓋範圍針對特定的 HCP 模式 | 與商業檢測方法相比,特異性有所提高,檢測性能的理解有所增強,HCP 類型的覆蓋率也有所提高 |
| 成本 | 初始價格相對便宜,但整個下游淨化製程的開發成本將迅速上升 | 初始成本較高,但損益平衡點通常為 100 套試劑盒的價值 | 由於其適用於多種產品,具有顯著的成本優勢 |
| 依賴 | 依賴特定的供應商,試劑和控制方案處於「黑箱」狀態。 | 全面控制所有試劑和緩衝液,隨時可調整 | 對所有試劑擁有完全的所有權和控制權,降低供應鏈和批次可比性的風險 |
| 監管要求 | 不適合支援行銷 授權申請 | 適用於支援授權產品從早期開發到上市的整個過程 | 適用於支援早期開發直至獲得上市許可 |
表 1.不同HCP試劑盒類型的比較
Yeasen 生物技術客製化HCP檢測開發服務
鑑於 HCP 檢測的重要性,
客製化時間表
宿主細胞殘留蛋白檢測試劑盒的客製化服務通常需要6到10個月。
抗原抗體製備:確定HCP抗原、建立HCP參考標準、設計免疫途徑及策略、製備HCP抗體等,一般需4~6個月。
檢測試劑盒開發:抗體優化、覆蓋率分析、檢測試劑盒方法驗證等,一般需要2到4個月。
Yeasen 生物技術 HCP 抗體覆蓋率驗證服務
據了解,ELISA是業界檢測殘留HCP的黃金標準,但此方法的準確性取決於對HCP的多克隆抗體的覆蓋率。美國藥典和歐洲藥典均提及免疫純化和 2D-WB 作為表徵 HCP ELISA 抗體及其覆蓋範圍的建議方法。
HCP 抗體覆蓋率 確認 服務
2D-WB 首先使用二維凝膠電泳根據大小和電荷分離蛋白質,然後將這些蛋白質轉移到膜上,與 HCP 抗體一起孵育以檢測蛋白質印跡。
我們 擁有全套2D-WB儀器設備和豐富的實驗室經驗,為CHO、E.coli、HEK293等宿主細胞的HCP樣本提供抗體覆蓋率驗證服務。
相關產品:
| 產品 | 目錄編號 | 尺寸 |
| 36712ES | 48噸/96噸 | |
| 36713ES | 48噸/96噸 | |
| CHO HCP ELISA 試劑盒(CHO-K1) | 36714ES | 48噸/96噸 |
| 大腸桿菌 HCP ELISA 試劑盒(質粒) | 36721ES | 48噸/96噸 |
