隨著類器官研究的不斷深入,越來越多的人加入其中,本文總結了一些關於類器官的常見知識點[1-5],希望對大家有幫助。
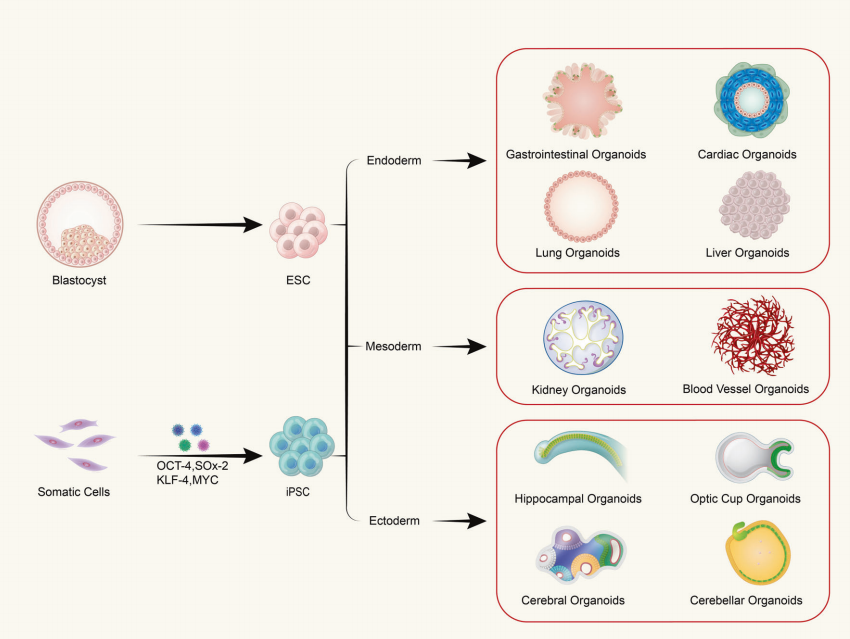
Q:類器官是由單一類型的細胞還是多細胞組織組成?
類器官是由成體幹細胞或多能幹細胞在體外三維(3D)培養形成的,具有一定空間組織的組織樣結構。類器官不是由單一細胞組成的結構;而是由具有幹細胞特性的起始細胞經過誘導分裂分化,自我組裝成具有一定空間結構、形態和功能的與體內相應器官相似的組織。
Q:培養類器官的來源有哪些?
(1)多能幹細胞的類器官包括成體幹細胞(ASC)、多能幹細胞(PSC)和誘導性多能幹細胞(iPSC)。 (2)來自組織提取細胞的類器官常見於腫瘤組織中。
Q:在沒有新鮮組織的情況下,冷凍組織可以進行三維培養嗎?
可以,但是對冷凍組織的尺寸要求較高,且原代冷凍組織和細胞的活力會顯著下降,導致後續培養的成功率大大降低。
問:如何冷凍和復甦類器官?
冷凍類器官的最佳時間為2-5代,此時類器官的活性和分化潛力最佳。類器官的復甦可以遵循細胞復甦的方法。
Q:培養的類器官的大小需要控制嗎?
是的,需要控制大小,最好在500μm以內,因為類器官缺乏內部血管和氣液循環系統。當類器官的尺寸很大時,靠近中心的細胞很難與外部環境交換氧氣和營養。因此,結構越大,死細胞的數量就越多。
Q:除了使用基質凝膠外,還有什麼可以用來培養類器官?
除了基質凝膠外,培養類器官的替代品包括(1)去細胞的細胞外基質和其他衍生蛋白質,(2)合成水凝膠,和(3)工程重組蛋白質凝膠。
Q:如何實現類器官的定向分化?
類器官中幹細胞誘導分化的早期發育受到多種訊息傳遞路徑共同調控。體外培養需要添加生長因子來模擬這些訊息傳遞路徑的活性,引導細胞朝特定的方向分化。例如,以Y27632和Activin A誘導可以將胚胎幹細胞(ESC)或誘導多能幹細胞(iPSC)分化為胚狀體(EB)。隨後,訊息傳遞路徑受到Wnt3a、FGF-4、Noggin等因子的調控,誘導幹細胞向特定方向分化。
Q:取得臨床樣本時如何避免污染?
(1)盡可能確保無菌取樣。 (2)拔除前先在含有抗生素的PBS中浸泡幾分鐘:對於位於胃、腸、膀胱等可能與外界環境接觸的部位的腫瘤,建議在含有3%-5%抗生素的PBS中浸泡5-10分鐘;對於其他常見腫瘤,則浸泡在含有1%-2%抗生素的PBS中約5分鐘。 (3)細胞萃取過程中使用的所有試劑都應含有 1% 的抗生素和適當濃度的主要抗生素。
問:腫瘤組織的採集、保存和運送應注意什麼?
盡可能收集腫瘤細胞含量高的腫瘤組織,並盡量減少組織樣本暴露在空氣中的時間,以減少污染的機率。將採集的腫瘤組織樣本盡快放入含有專用檢體保存液的無菌管中,低溫(4℃左右)快速運送至檢測單位(爭取採樣後2~4小時內送達)。
Q:從病灶部位培養的類器官和從鄰近組織培養的類器官有什麼不同?
腫瘤組織取材部位有何要求?是的,是有差別的。腫瘤本身表現出異質性,因此觀察到不同來源的類器官之間的差異是很常見的。從形態學上看,來自原發性病變的類器官比來自鄰近組織的類器官往往具有更具侵襲性的結構,通常看起來更不規則。為了最大限度地減少建模或藥物篩選的錯誤,應從活動良好的區域採集多個樣本。
Q:哪些類型的藥物可以用於腫瘤類器官的藥敏測試?
臨床上主要的抗腫瘤藥物類型可分為三類:細胞毒性藥物(如紫杉醇、順鉑/卡鉑、5-FU等)、標靶藥物(針對EGFR、HER2、VEGFR等的藥物)和以免疫檢查點抑制劑(PD-1抗體、PD-L1抗體等)代表的免疫療法藥物。
Q:PDO培育的成功率是多少?
PDO培養的成功率依來源不同而略有不同。大部分PDO的成功率在63%~70%之間,甚至更高,可達90%,這很大程度上與組織本身的活性有關。此外,臨床治療可能會影響成功率。透過減少組織離體時間和操作步驟可以提高成功率。
Q:冷凍組織可以用於類器官培養嗎?
一般來說,由於組織活力的嚴重喪失,不建議進行組織冷凍保存。然而,如果組織保存在-80°C下,類器官培養的最佳時間是保存後6週內。如果將組織保存在液態氮中,保存時間可以更長,但最好不要超過六個月。
Q:提取原代細胞時,通常會有纖維母細胞混入,該如何處理?
(1)由於成纖維細胞粘連性較差,可透過反覆粘連將其去除。(2)可以使用纖維母細胞去除試劑,但是否影響類器官培養仍需實驗驗證。
Q:培養腫瘤類器官需要多少原始腫瘤組織?切片樣本足夠嗎?
一般手術組織應大於2-3個黃豆大小;若透過針吸活檢獲取,至少需要2-3個樣本,而內視鏡切片檢查則需要夾取至少6個以上的腫瘤組織。
Q:如果腫瘤組織樣本太少,培養出的類器官數量不足以進行後續檢測,該怎麼辦?
由於來自腫瘤來源的類器官在傳代後可能表現出表型差異,因此通常不建議傳代。文獻建議將類器官的傳代限制為 2-3 代,最多為 5 代。如果細胞數量太少,傳代5代後仍無法滿足檢測要求,可以考慮改變檢測方法,例如使用更小的384孔板或嘗試用微流控晶片進行檢測。
Q:腫瘤組織裡會有正常細胞嗎?如何去除這些正常細胞?
可能存在少量正常細胞。首先,採集過程中盡量避免取樣正常組織。其次,在提取原代細胞後,可以利用磁珠分選或流式細胞儀進行進一步的類器官培養。當存在極少量正常細胞時,它不會顯著影響後續的類器官建模和培養,因此可能不需要移除。
問:從腫瘤組織中提取原代細胞時,為什麼細胞會呈現紅色?
體內組織血液供應豐富,因此紅血球較多。在大多數情況下,這不需要處理,也不會影響類器官的培養。如果紅血球過多,可以在培養前用裂解緩衝液適當處理。
問:在類器官培養過程中,發現了黑色顆粒。如何除去它們?
黑色顆粒很可能是雜質或細胞碎片。可以透過兩種方式將其刪除:
消化類器官並用培養基反覆清洗以稀釋雜質。
使用無菌手術刀將類器官切成兩半,然後使用裝有培養基的 1ml 注射器輕輕沖洗出類器官中的雜質。
Q:類器官培養的傳代次數有限制嗎,可以進行幾次傳代?
傳代次數通常取決於源細胞的特性。大多數類器官可以在體外傳代最多 10 次(>6 個月)。培養條件的選擇也可能產生一些影響,條件培養基通常優於合成因子培養基。
Q:腫瘤細胞系(例如 HepG2 細胞系)可以培養成 PDO 嗎?
PDO 是複雜的自組裝結構。單一細胞系形成的3D培養體係不能稱為PDO;它們被簡單地稱為 3D 球面狀態。
Q: 類器官的傳代標準是什麼?
根據類器官的發育狀況,時間會有所不同,通常在5-10天之間,直徑約100-200μm。一些發育緩慢的類器官可能需要數週才能達到適當的傳代狀態。
問:如何計數活體類器官的數量?
實驗時取出預先配製的Calcein-AM保存液,將Calcein-AM溶液加入培養基中,使終濃度為0.2μmol/L。在 37°C 下孵育 60 分鐘。時間到後,用 PBS 慢慢洗去含有 Calcein-AM 的培養基,並加入新鮮培養基。使用激發波長為 490 nm、發射波長 515 nm 的螢光顯微鏡觀察並拍攝類器官。活的類器官呈現綠色並具有清晰的邊緣。計數直徑 >20μm 的類器官。
Q:如何計算類器官的活力?
類器官活力計算公式為:X=(Nlive/Ntotal)×100%,其中:X代表類器官活力; Nlive表示活體類器官的數量; Ntotal 代表類器官的總數。
Q: 鑑別類器官的方法有哪些?
最基本的方法是透過顯微鏡觀察類器官的形態,並進行H&E染色。進一步的方法包括Western Blot、qRT-PCR、免疫螢光、流式細胞儀來檢測類器官是否表達相應的生物標記。基因定序可以辨識培養的類器官和源組織之間的基因匹配。對於一些類器官,可以進行功能測試,看看它們是否具有特定的功能。例如,研究顯示胃類器官可以分泌胃酸,心臟類器官可以自主跳動。
問:正常細胞也能長成類器官嗎?腫瘤類器官培養過程中如何移除正常類器官?
正常細胞也可以長成類器官。移除正常類器官的方法包括:(1)顯微鏡下根據HE染色結果進行人工選擇; (2)透過調節培養基成分(如生長因子/小分子抑制劑)純化PDO; (3)將PDO分散到單一細胞中,進行流式細胞儀或磁珠分選。
Q:在藥物敏感性實驗中,是否應該將PDO從基質凝膠中消化掉?
不,PDO 需要三維結構來模擬體內條件。如果沒有基質凝膠的支撐,藥敏實驗的準確性就會受到影響。一般情況下,可溶性藥物能夠滲透基質凝膠作用於類器官,但在進行免疫細胞化學實驗時,則需要去除基質凝膠。
Q:PDO實驗能完全取代動物模型(PDX)嗎?
PDO可以部分取代PDX,但不能完全取代。
Q:PDO在培養過程中生長異常的原因可能是什麼,與先前的情況相比,其生長週期縮短、增殖速度加快?
外在因素: (1)這種異常可能是由某些污染細胞(如成纖維細胞)的大量生長引起的。在這種情況下,建議進行切片染色和觀察以確認這些受污染細胞的存在,然後將其去除。 (2)改變培養條件,包括添加某些因子或小分子,可以進一步活化PDOs的增殖途徑。
內部因素: 可能發生基因突變。為了驗證這一點,建議進行定序,並將結果與原始 PDO 的結果進行比較,以確定是否存在任何基因突變。
Q:如何測試PDO對藥物的敏感性?
可以使用 CCK8 分析、ATP 細胞活力分析和活/死染色等方法來測試 PDO 的藥物敏感性。評估腫瘤類器官的 ATP 活性是最常見的方法。 ATP是細胞中最重要的能量分子,可以用來衡量細胞代謝水平,反映活細胞的數量。根據給藥對細胞ATP含量的影響,利用分析軟體計算出每種給藥方案的IC50值(受試藥物的半數最大抑制濃度),從而篩選出對腫瘤抑制最有效的藥物。
:PDO的藥敏實驗濃度範圍和原代腫瘤細胞的濃度範圍相同嗎?
不,它們不一樣。通常,PDO 的藥物濃度需要高於原代細胞的藥物濃度。可以進行初步實驗,分析正式藥敏實驗的最佳濃度。
問:類器官應在哪個生長階段用於藥物測試?
一般建議使用5代內的類器官進行藥物測試。在此階段,類器官表現出最佳的穩定性和活性。
Q:判斷類器官建立成功的標準是什麼?
(1)早期初步評估:類器官形態從細胞狀態轉變為液泡、出芽、緊密或鬆散等形式。 (2)辨識特定的生物標記的表達,其應與組織切片中的分佈相似。可以進行進一步的定序分析以進行更詳細的比較。
Q:類器官培養與常規細胞培養有何不同?
(1)細胞培養方式不同:類器官需要基質或空間結構的支撐來維持其三維結構,而常規細胞培養則不需要這樣做。 (2)類器官培養需要實現體外分化和自組裝,因此需要採用多種細胞激素的組合進行誘導,導致培養基成分相對複雜。常規細胞培養通常只涉及單一類型的細胞,因此培養基成分相對簡單。(3)細胞來源不同:類器官來自多能上皮細胞,而常規細胞培養適合培養各類選定的細胞。
Q:我如何確定我培養的 3D 球體是否是類器官,以及它們是否與目標組織一致?
識別類器官的方法包括 H&E 染色、免疫組織化學 (IHC)、單細胞定序等。需要從形態學、組織病理學、分子遺傳學等多維度判斷是否與目標器官或組織一致。對於腫瘤類器官,可以透過檢測特定的生物標記來確認。
問:如果在培養過程中觀察到的類器官的形態與文獻通報的不同,原因為何?
首先,樣本來源、亞型可能存在個體差異與異質性。其次,所選用的細胞激素和一些用於誘導的小分子抑制劑的質量差異,可能導致不同類器官的分化形態改變。建議以HE染色、IHC、基因定序等方法確認類器官形態與源組織的一致性,而不要單純依賴文獻描述。
Q:使用類器官進行藥敏實驗時,是否需要控製作為藥物溶劑的DMSO的量?
是的,一般藥敏實驗要求DMSO的體積百分比小於0.5%。
Q:如何從基質凝膠中回收類器官?
建議使用以下方法:(1)可使用市售的類器官恢復溶液(CAT#41421ES)溫和有效地獲得細胞懸浮液,且不損傷細胞或細胞表面蛋白。 (2)基質凝膠可在低溫下解凍,使其軟化並釋放類器官。
問:在恢復過程中,許多類器官黏附在離心管壁上。如何才能提高治癒率?
收集後離心時,採用水平轉子離心機,並適當提高離心轉速。一般離心力300g左右,轉速1000-1200rpm左右較為適合。
| 磷產品 否英文 | 貓 | 尺寸 |
| 人類Wnt-3a | 92276ES10 | 10μ克 |
| 92278ES20 | 20μ克 | |
| 92701ES10 | 10μ克 | |
| 人類的頭腦 | 92528ES10 | 10μ克 |
| 91330ES10 | 10μ克 | |
| 91306ES10 | 10μ克 | |
| 91502ES10 | 10μ克 | |
| 91701ES08 | 10μ克 | |
| 92602ES60 | 100μ克 | |
| 91204ES10 | 10μ克 | |
| 90601ES10 | 10μ克 | |
| 91113ES10 | 10μ克 | |
| 92279ES10 | 10μ克 | |
| 92055ES10 | 10μ克 | |
| 92053ES10 | 10μ克 | |
| 92129ES08 | 5μ克 | |
| 91304ES10 | 10μ克 | |
| 91702ES10 | 10μ克 | |
| 92252ES60 | 100μ克 | |
| 90103ES10 | 10μ克 | |
| 90104ES10 | 10μ克 | |
| 90197ES10 | 10μ克 | |
| 90144ES08 | 10μ克 | |
| 90196ES10 | 10μ克 | |
| 90194ES10 | 10μ克 | |
| 90111ES10 | 10μ克 | |
| 90120ES10 | 10μ克 | |
| 90198ES10 | 10μ克 | |
| 91605ES10 | 10μ克 | |
| 92251ES10 | 10μ克 | |
| 92566ES08 | 5μ克 | |
| 92102ES10 | 10μ克 | |
| 91103ES10 | 10μ克 | |
| 92711ES10 | 10μ克 | |
| 92122ES60 | 100μ克 | |
| 92201ES60 | 100μ克 | |
| 92275ES20 | 20μ克 | |
| 人類BMP-2 | 92051ES10 | 10μ克 |
相關閱讀:
參考
